铜胁迫对菹草无菌苗多胺及活性氧代谢的影响*1
姜 岩,施国新,陈 霖,汪鹏合,乔绪强,田秀丽
(南京师范大学生命科学学院,江苏省生物多样性与生物技术重点实验室,南京210046)
Cu2+是植物生长发育必需的微量营养元素,但过量的Cu2+会对植物产生毒害[1-2].Cu2+胁迫导致植物体内产生大量活性氧,对细胞膜、细胞结构等造成伤害,导致细胞代谢紊乱[3].多胺是一类高生物活性的脂肪族含氮碱,能促进植物的生长发育,延迟衰老,提高植物的抗逆性等[4].有研究表明,外源多胺可以缓解Cu2+胁迫对水鳖的毒害症状[5],提高Cu2+胁迫下荇菜叶片生物膜的保护作用[6],但关于内源多胺在植物体抵抗Cu2+胁迫方面的研究较少.目前研究中所采用的实验材料大多为自然生长的植物,取材受季节限制,实验结果易受植物生长环境的影响.鉴于此,本文以菹草无菌苗为实验材料,研究了Cu2+胁迫对菹草无菌苗的抗氧化酶活性、产生速率、H2O2含量、MDA含量及可溶性蛋白含量的影响,并研究了Cu2+胁迫对菹草无菌苗内源多胺代谢的影响,试图探讨菹草无菌苗内源多胺在Cu2+胁迫逆境适应中的变化及作用,并为进一步研究植物抗重金属胁迫的生理生化机制提供理论依据.
1 材料和方法
1.1 实验材料
菹草(Potamogeton crispus L.)为眼子菜科植物,多年生沉水草本,根状茎细长,多分枝,侧枝短,叶呈披针形.本次实验所用菹草于2010年11月采自南京市琵琶湖水域,以菹草带节间的幼嫩茎段诱导产生的无菌苗作为研究对象.
1.2 研究方法
1.2.1 菹草无菌苗的培养 选取菹草靠近顶端的幼嫩茎段作为外植体,用清水冲洗干净,在无菌环境中依次经过5%的H2O2消毒15 min,无菌水冲洗3次;10%次氯酸钠消毒30s,无菌水冲洗5次后将菹草带侧芽的茎段剪成约8 mm长,接种于含6-BA(2.0 mg/L)和IBA(0.5 mg/L)的MS培养基中诱导芽分化;15 d左右茎间侧芽约2 cm长,转入含6-BA(2.0 mg/L)的MS继代培养基继代培养20 d;而后置于1/10的无菌Hoagland营养液中进行生根培养1个月以得到完整的无菌苗.整个组培过程在培养室进行,培养温度为25℃,每天光照16 h,光照强度为1200~1500 lx.
1.2.2 Cu2+对菹草无菌苗的毒害处理 选取生长状况一致的菹草无菌苗植株置于含0、1、2、4、8和12 μmol/L CuSO4(以纯Cu2+计)的无菌1/10 Hoagland营养液(Cu2+浓度为32 nmol/L)中,每个处理设3次重复,置于与培养无菌苗环境一致的培养室中培养.处理5 d后取菹草无菌苗完整植株,去离子水洗净、揩干,进行各项生理指标测定.
1.2.3 SOD、POD和CAT活性的测定 SOD活性测定采用NBT光化还原法[7],以抑制NBT光还原50%所需的酶量为1个酶活性单位(U);POD活性测定采用愈创木酚方法[8],以每分钟OD470的变化为1个酶活性单位(U);CAT活性测定采用钼酸盐方法[9],以每分钟分解1 μmol H2O2所需的酶量为1个酶活性单位(U).
1.2.5 可溶性蛋白含量的测定 可溶性蛋白含量用考马斯亮蓝G-250法[12]测定,以牛血清白蛋白(BSA)为标准蛋白.
1.2.6 多胺含量及其代谢酶的测定 多胺含量的测定采用Aziz等[13]的方法,以nmol/g(FW)表示;精氨酸脱羧酶(ADC)和鸟氨酸脱羧酶(ODC)的活性根据Zhao等[14]的方法测定,其活性分别以1 μmol Agm/h和1 μmol Put/min为1个酶活性单位(U)表示;多胺氧化酶(PAO)和二胺氧化酶(DAO)的活性测定参照汪天等[15]的方法,以0.001ΔOD550/min 为 1 个酶活性单位(U).
1.3 统计分析
实验结果为3次重复的平均值±标准差,采用Excel和SPSS 17.0统计软件对实验数据进行制图和统计分析.用相关系数(r)对各指标与Cu2+浓度间进行相关性统计,P≥0.05表示无显著相关性,P<0.05表示显著差异,P<0.01表示极显著差异.
2 实验结果
2.1 Cu2+胁迫对菹草无菌苗SOD、POD、CAT活性的影响
随着Cu2+浓度升高,SOD活性明显被激活,表现为逐渐上升的趋势,在Cu2+浓度为12 μmol/L时最大,为对照的 1.92倍;POD和CAT活性随Cu2+浓度的升高均表现为先升后降,二者均在Cu2+浓度为1 μmol/L时达到峰值,分别为对照的3.97和2.52倍,后逐渐降低.相关性分析表明,SOD活性变化与Cu2+处理浓度间达到极显著正相关(r=0.9796,P <0.01)(图1).

图1 Cu2+胁迫对菹草无菌苗POD、SOD和CAT活性的影响(不同字母代表差异显著,下同)Fig.1 Effects of Cu2+stress on POD,SOD and CAT activities in aseptic seedlings of P.crispus
2.2 Cu2+胁迫对菹草无菌苗 产生速率、H2O2含量和MDA含量的影响

图2 Cu2+胁迫对菹草无菌苗产生速率(A)和H2O2、MDA含量(B)的影响Fig.2 Effects of Cu2+stress on generation rate(A),H2O2and MDA contents(B)in aseptic seedlings of P.crispus
2.3 Cu2+胁迫对菹草无菌苗可溶性蛋白含量的影响
随着Cu2+浓度的升高,菹草无菌苗可溶性蛋白含量在短暂升高后迅速降低,在Cu2+浓度为12 μmol/L时最低,为对照的84.59%(图3).
2.4 Cu2+胁迫对菹草无菌苗多胺含量的影响
2.4.1 游离态多胺含量的变化 随着Cu2+浓度升高至2 μmol/L,菹草无菌苗游离态Put含量短暂上升至最大,为对照的1.45倍,后迅速降低;游离态Spd的含量则随Cu2+浓度的升高逐渐降低,当Cu2+浓度为12 μmol/L时,其含量仅为对照组的56.50%;游离态Spm的含量在Cu2+浓度为0~8 μmol/L时逐渐上升,在12 μmol/L时略有下降,但仍为对照组的1.46倍(图4A);游离态(Spd+Spm)/Put的比值在Cu2+浓度为0~2 μmol/L时有所降低,之后随着Cu2+浓度的升高迅速增大(图4B).相关性分析表明,游离态Spd的含量变化与Cu2+浓度之间呈极显著负相关(r=-0.8920,P <0.01).
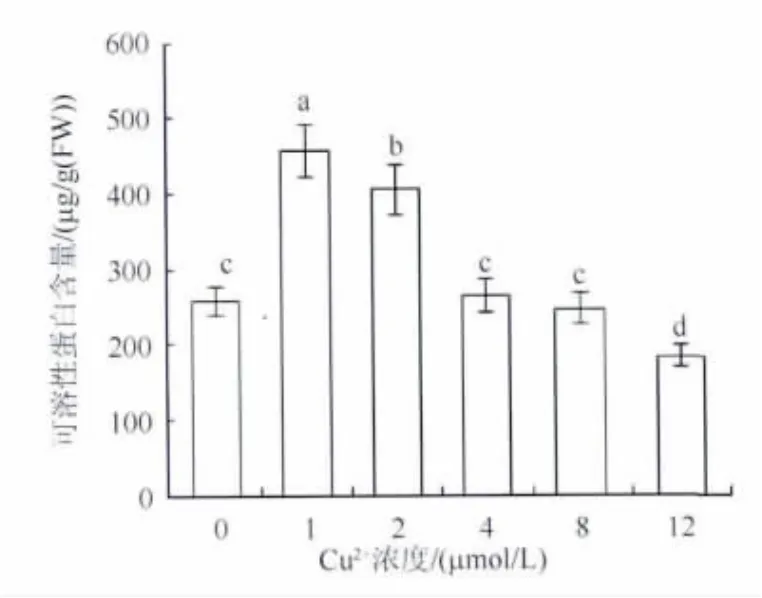
图3 Cu2+胁迫对菹草无菌苗可溶性蛋白含量的影响Fig.3 Effect of Cu2+stress on soluble protein content in aseptic seedlings of P.crispus
2.4.2 结合态多胺含量的变化 菹草无菌苗的结合态Put含量在Cu2+浓度为0~2 μmol/L时缓慢上升并在2 μmol/L时达到峰值,为对照组的1.17倍,后其含量迅速下降并显著低于对照;随着Cu2+浓度升高,结合态Spd的含量与对照组相比有所上升;结合态Spm含量随Cu2+浓度的升高逐渐升高,当Cu2+浓度为8 μmol/L时含量达到最大值,为对照组的1.87倍(图4C).相关性分析表明,结合态Put含量变化与Cu2+处理浓度之间达到显著负相关(r= -0.8478,P<0.05);结合态Spm含量变化与Cu2+处理浓度之间呈极显著正相关(r=0.9178,P <0.01).
2.4.3 束缚态多胺含量的变化 束缚态Put及Spd的含量均随Cu2+浓度升高逐渐升高,分别在Cu2+浓度为4 μmol/L和2 μmol/L时达到峰值,分别为对照组的5.59和1.78倍,之后二者含量均降低,但仍高于对照;束缚态Spm的含量随Cu2+浓度升高逐渐降低,当Cu2+浓度为12 μmol/L时,其含量仅为对照组的4.49%(图4D).
2.4.4 多胺总含量的变化 随着Cu2+浓度升高,Put总含量呈先升后降的趋势,在Cu2+浓度为2 μmol/L时达到最大值,为对照组的1.35倍,之后其含量迅速降低并低于对照;Spd的总含量随着Cu2+浓度的升高逐渐降低,当Cu2+浓度为12 μmol/L时,其含量最低,仅为对照组的68.03%;随Cu2+浓度升高,Spm的总含量逐渐上升,在Cu2+浓度为8 μmol/L时达到峰值,为对照组的1.78倍,之后略有降低.相关性分析表明,Spd总含量变化与Cu2+处理浓度之间达到极显著负相关(r=-0.8748,P<0.01);Spm总含量变化与Cu2+处理浓度呈显著正相关(r=0.8039,P <0.05)(图4E).
2.5 Cu2+胁迫对菹草无菌苗ADC、ODC、PAO和DAO活性的影响
随着Cu2+浓度升高,ADC的活性表现为先升后降,在Cu2+浓度为1 μmol/L时活性最大,为对照组的1.18倍,后其活性逐渐降低并低于对照;ODC活性随着Cu2+浓度升高,变化不明显;PAO和DAO的活性随Cu2+浓度升高均表现为先升后降趋势,分别在Cu2+浓度为4 μmol/L和1 μmol/L时达到峰值,之后酶活性下降,但均高于对照(图5).相关性分析表明,PAO活性变化与Cu2+处理浓度呈显著正相关(r=0.7714,P <0.05).
3 讨论

图4 Cu2+胁迫对菹草无菌苗多胺含量的影响Fig.4 Effects of Cu2+stress on PAs content in aseptic seedlings of P.crispus
可溶性蛋白含量降低是植物重金属胁迫的特征之一,本研究结果显示,高浓度Cu2+胁迫导致菹草无菌苗可溶性蛋白含量迅速降低(图3).这主要是因为:(1)Cu2+进入细胞后促进蛋白水解酶的活性,加强原有蛋白质的分解[19];(2)Cu2+对蛋白合成的众多酶系均有毒害和抑制作用,并且使蛋白质合成的相关细胞器受到损伤,抑制新蛋白的合成[20].
多胺可以参与植物对逆境的响应,在清除活性氧自由基、维持生物膜稳定性等方面具有重要作用[21].多胺的代谢特征之一是植物受到逆境胁迫时,体内多胺含量迅速发生变化,并且不同种类、不同形态的多胺可以相互转化[22].多胺的氨基化程度越高,氨基数目越多,清除自由基的效果越好,因此三胺、四胺清除自由基的能力大于二胺,也就是说Spd和Spm清除自由基的能力要大于Put[23].相关研究表明,游离态(Spd+Spm)/Put的升高有利于植物抵抗重金属胁迫[24].本研究结果表明,在高浓度Cu2+胁迫时,游离态(Spd+Spm)/Put迅速增大(图4B),这可能是因为游离态Put向Spd和Spm发生转化,对增强菹草无菌苗抵抗Cu2+胁迫有重要的作用.

图5 Cu2+胁迫对菹草无菌苗ADC、ODC(A),PAO、DAO(B)活性的影响Fig.5 Effects of Cu2+stress on ADC,ODC(A),PAO,DAO(B)activities in aseptic seedlings of P.crispus
研究表明,游离态多胺可以向结合态和束缚态多胺转化,结合态多胺能形成分子屏障、抵御外界不良因素的侵染,束缚态多胺则可通过大分子的交联稳定细胞内成分,结合态和束缚态多胺含量的增加可以增强植物抵抗胁迫的能力[25].本研究结果显示,低浓度Cu2+胁迫时,结合态多胺含量均有所上升,可能是游离态多胺向结合态发生了转化,之后随着胁迫作用的加强,结合态Spd和Spm有所积累(图4C),较高含量的结合态Spd和Spm有利于菹草无菌苗抵御Cu2+胁迫.在较低浓度Cu2+胁迫时,束缚态Put和Spd含量上升,随着Cu2+浓度进一步增大,束缚态Put含量迅速降低,而束缚态Spd含量变化平缓,可能是Put向Spd发生了转化,但二者含量仍高于对照(图4D).由于束缚态Put和Spd是束缚态多胺的主要成分,在胁迫期间,维持较高的束缚态Put和Spd含量,有利于稳定细胞结构[23,26],提高菹草无菌苗的抗逆性.而束缚态Spm含量(图4D)随Cu2+浓度升高迅速降低,可能是向结合态发生了转化,也说明其对Cu2+胁迫比较敏感.
植物合成Put有两条途径,一是精氨酸(Arg)在ADC的作用下脱羧,生成鲱精胺(Agm),再脱去一分子氨生成Put;二是精氨酸(Arg)先脱去一分子脲,生成鸟氨酸(Orn),然后经ODC催化生成Put.汪沛洪[27]认为在渗透胁迫条件下,Put含量的上升是由于胁迫导致了ADC活性的上升,ODC则不参与反应.本实验中,处理后,在低浓度Cu2+胁迫时ADC活性受到激发,逐渐上升,之后随着Cu2+胁迫的进一步加深,其活性下降并低于对照,但ODC活性变化不明显(图5A),说明Put的ADC生物合成途径与菹草无菌苗对Cu2+胁迫的反应有关.Put的降解酶DAO活性随Cu2+浓度升高表现与ADC相同,均为先升后降,但DAO活性均高于对照组(图5B),可能是Put快速合成,并作为底物激活DAO,使其氧化活性增强,从而反馈调节Put.PAO是催化生物体内多胺降解的关键酶,其通过调节细胞内多胺的水平和生成物浓度,参与植物体对各种逆境胁迫的反应和生长发育过程[28].本研究表明,随着Cu2+浓度升高,PAO活性逐渐升高,后有所降低但仍明显高于对照组(图5B),这可能是因为Spm含量的升高诱导了PAO活性的同步升高,进而维持多胺代谢平衡.Spd在PAO的降解作用下,其含量随着Cu2+浓度的升高逐渐下降.而Spm含量升高可能是菹草无菌苗抵抗Cu2+胁迫的信号之一,是对胁迫伤害的一种适应性反应,提高了菹草无菌苗抗胁迫的能力.
综上所述,在Cu2+胁迫下,菹草无菌苗活性氧积累,膜脂过氧化程度增大,可溶性蛋白含量降低,表现出明显的氧化胁迫.在一定Cu2+胁迫浓度范围内,菹草无菌苗抗氧化酶活性的升高,Spm含量的增大,Put向Spd和Spm的转化以及不同状态多胺之间的转化,在一定程度上有利于降低活性氧对植物体的破坏,稳定细胞结构,提高菹草无菌苗抵抗Cu2+胁迫的能力.
[1]Sommer AL.Copper as an essential for plant growth.Plant Physiology,1931,6(2):339-345.
[2]Fernandes JC,Henriques FS.Biochemical,physiological,and structural effects of excess copper in plants.The Botanical Review,1991,57(3):246-273.
[3]潘秋红,施国新,徐勤松等.Cu2+对菱叶片生理指标及超微结构的毒理学效应分析.武汉植物学研究,2009,27(5):527-532.
[4]王 聪,朱月林,杨立飞等.NaCl胁迫对菜用大豆种子多胺代谢的影响.应用生态学报,2011,22(11):2883-2893.
[5]王红霞,胡金朝,施国新等.外源多胺对铜胁迫下水鳖叶片多胺代谢、抗氧化系统和矿质营养元素的影响.生态学报,2010,30(10):2784-2792.
[6]王 学,徐恒戬.外源多胺对铜胁迫下荇菜叶片生物膜的保护作用.植物生理学通讯,2008,44(3):449-453.
[7]Beyer WF,Fridovich I.Assaying for superoxide dismutase activity:Some large consequences of minor changes in conditions.Analytical Biochemistry,1987,161(2):559-566.
[8]张志良,瞿伟菁.植物生理学实验指导.北京:高等教育出版社,2003:67-69.
[9]Karsten U,Franklin LA,Lüning K et al.Natural ultraviolet radiation and photosynthetically active radiation induce formation of mycosporine-like amino acids in the marine macroalga Chondrus crispus(Rhodophyta).Planta,1998,205(2):257-262.
[10]王爱国,罗广华.植物的超氧物自由基与羟胺反应的定量关系.植物生理学通讯,1990,(6):55-57.
[11]李合生.植物生理生化实验原理和技术.北京:高等教育出版社,2000:164-165.
[12]Bradford MM.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding.Analytical Biochemistry,1976,72(1/2):248-254.
[13]Aziz A,Martin TJ,Larher F.Stress-induced changes in polyamine and tyramine levels can regulate proline accumulation in tomato leaf discs treated with sodium chloride.Physiologia Plantarum,1998,104(2):195-202.
[14]Zhao FG,Sun C,Liu YL et al.Relationship between polyamine metabolism in roots and salt tolerance of barley seedlings.Acta Botanica Sinica,2003,45(3):295-300.
[15]汪 天,郭世荣,刘 俊等.多胺氧化酶检测方法的改进及其在低氧水培黄瓜根系中的应用.植物生理学通讯,2004,40(3):358-360.
[16]丁能飞,傅庆林,刘 琛等.盐胁迫对两个大白菜品种抗氧化酶活性及离子吸收的影响.浙江农业学报,2008,20(5):322-327.
[17]计汪栋,施国新,杨海燕等.铜胁迫对竹叶眼子菜叶片生理指标和超微结构的影响.应用生态学报,2007,18(12):2727-2732.
[18]Mittler R.Oxidative stress,antioxidants and stress tolerance.Trends in Plant Sci,2002,7(1):405-410.
[19]王 学,施国新,徐勤松等.镧、铈及重金属元素铬、锌对竹叶眼子菜的毒害作用.中国稀土学报,2004,22(5):682-686.
[20]Prasad MNV,Malec P,Waloszek A.Physiological response of Lemna trisulca L.(duckweed)to cadmium and copper bioaccumulation.Plant Science,2001,161:881-889.
[21]刘正鲁,朱月林,魏国平等.NaCl胁迫对茄子嫁接苗叶片多胺代谢和ABA含量的影响.生态学报,2008,28(4):1586-1592.
[22]Alcázar R,Altabella T,Marco F et al.Polyamines:molecules with regulatory functions in plant abiotic stress tolerance.Planta,2010,231(6):1237-1249.
[23]Drolet G,Dumbroff EB,Legge RL et al.Radical scavenging properties of polyamines.Phytochemistry,1986,25(2):367-371.
[24]田秀丽,施国新,徐 君等.Cr6+胁迫对水花生(Alternanthera philoxeroides)愈伤组织多胺代谢的影响.湖泊科学,2011,23(6):955-960.
[25]赵福庚,刘友良.高等植物体内特殊形态多胺的代谢及调节.植物生理学通讯,2000,36(1):1-6.
[26]Slocum RD,Kaur-Sawhney R,Galston AW.The physiology and biochemistry of polyamines in plants.Archives of Biochemistry and Biophysics,1984,235(2):283-303.
[27]汪沛洪.植物多胺代谢的酶类与胁迫反应.植物生理学通讯,1990,(1):1-7.
[28]张自坤,刘世琦,刘素慧等.嫁接对铜胁迫下黄瓜幼苗根系多胺代谢的影响.应用生态学报,2010,21(8):2051-2056.

