聚乳酸-聚乙二醇三嵌段共聚物包载紫杉醇纳米胶束的制备及其体外药物释放行为
齐 旭,刘 佩,李速明,范仲勇
(复旦大学 材料科学系,上海200433)
紫杉醇是提取自红豆杉科植物树皮的一种植物抗癌药物,广泛应用于多种肿瘤的治疗,如卵巢癌、乳腺癌、非小细胞肺癌、肝癌、脑瘤等[1-5].然而紫杉醇在水中的溶解度很低,为了更好地应用,临床上采用聚氧乙烯蓖麻油和无水乙醇体积比为1∶1的混合溶剂做助溶剂得到紫杉醇浓缩制剂,使用前以生理盐水或5%葡萄糖进行稀释后静脉滴注给药.这种配方使用方便,但聚氧乙烯蓖麻油会引起过敏反应、神经毒性、心脏毒性[6]等不良反应,增加了患者的痛苦.采用脂质体、微球、胶束、前药等方法进行物理包埋或化学键合,能够得到水溶药物制剂,减轻副作用.两亲性聚合物自组装形成的核壳结构是药物的良好载体,同时可依据丰富的合成方法对聚合物分子结构进行调控,这些都使得聚合物纳米胶束在药物传递方面具有应用前景.
生物可吸收聚乳酸聚乙二醇嵌段共聚物纳米胶束,作为良好的药物载体已经得到了广泛的研究及应用[7-10].通过透析法、溶剂挥发/薄膜水化法、复乳法等可制备具有核壳结构的载药纳米胶束.在水溶液中,聚乳酸链段聚集组成胶束的疏水内核,聚乙二醇则形成胶束的外壳.聚乳酸在体内可以代谢完全,具有很好的生物相容性.分子量在30 000以下的聚乙二醇能够通过肝脏代谢出体外[11].另外,聚乙二醇链段作为载药胶束外部壳结构,具有控制蛋白调理素的作用,这使得载药胶束免于被网状内皮组织非特异性吸收,具有被动靶向的作用.现有文献研究结果表明,共聚物嵌段序列比以及共聚物分子量对药物包封率、释放行为有影响.
在前期研究[12]中发现,立构复合胶束的载药量是单一胶束载药量的1.6倍.另一方面,载药胶束的制备方法对药物释放行为亦有影响,如在30d药物释放实验中,直接溶解法制备的载药胶束药物累积释放率可达透析法的2倍等结果.在此基础上,本文报道采用聚乙二醇引发丙交酯开环聚合,合成了不同分子量的聚乳酸-聚乙二醇-聚乳酸(Polylactide-poly(ethylene glycol)-polylactide,PLA-PEG-PLA)嵌段共聚物,分别采用直接溶解法和溶剂挥发/薄膜水化法制备了载药胶束,对其形态、释放、对肿瘤细胞抑制行为进行了研究.
1 实验部分
1.1 主要试剂与仪器
左旋-乳酸(AR级),国药集团化学试剂有限公司;双羟基聚乙二醇(PEG,数均分子量为2 000,6 000),德国Fluka公司;乳酸锌(Zn(La)2),美国Sigma公司;紫杉醇(paclitaxel,PTX),西安昊轩生物科技有限公司;透析袋(MWCO=1 000,3 500),上海绿鸟生物科技有限公司.乙酸乙酯、无水乙醚、二氯甲烷、吐温80等,AR级,国药集团化学试剂有限公司.乙腈、四氢呋喃,HPLC级,国药集团化学试剂有限公司.磷酸氢二钠,AR级,上海强顺化学试剂有限公司.磷酸二氢钾,AR,上海大合化学品有限公司.
1H核磁共振测试(1H NMR)在BRUKER液体核磁共振仪上进行.共振频率为500MHz,溶剂为氘代氯仿,化学位移以四甲基硅烷(TMS)作内标.
差示扫描量热分析(DSC)在 Perkin-Elmer DSC6仪器上完成,样品质量为 6±0.1mg,在30mL/min N2保护下以10℃/min升温速度从室温到150℃.
扫描电镜测试(SEM)在S-4800高分辨场发射扫描电镜上完成,浓度为10mg/mL聚合物样品滴在硅片上风干后进行观察.
凝胶渗透色谱(GPC)测定聚合物分子量采用带折光指数的 Water 410仪器测试得到.流动相为四氢呋喃,流速1.0mL/min,以聚苯乙烯为标样.
高效液相色谱(High Performance Liquid Chromatography,HPLC)在日本岛津公司LC-10A型液相色谱仪上完成,配以SPD-10A紫外UV检测器和Dionex色谱柱(C18填料,5μm,4.6mm×250mm).检测波长227nm流动相为乙腈/水(55∶45,体积比),流速为1.0mL/min.
粒径测试采用马尔文Zetasizer Nano粒度电位分析仪,制备聚合物浓度为0.5mg/mL的样品进行测定.溶剂挥发/薄膜水化法制备胶束在EYELA N-100旋转蒸发仪上完成.
1.2 载药胶束的制备及粒径测定
直接溶解法采用磁力搅拌器,在转速500r/min下,将50mg共聚物于溶解于5mL去离子水中,随后在室温下加入紫杉醇搅拌、分散24h后,离心去除不溶药物,0.45μm滤膜过滤,于4℃保存.溶剂挥发/薄膜水化法首先需要配制共聚物和紫杉醇的乙腈溶液,使用旋转蒸发仪除去溶剂乙腈,得到均匀透明聚合物膜.真空放置过夜,除去痕量溶剂.加入去离子水室温溶解薄膜,离心去除不溶药物,0.45μm滤膜过滤,于4℃保存.
采用马尔文粒度电位分析仪,对聚合物浓度为0.5mg/mL的样品进行粒径测定.将样品滴加载硅片自然风干后SEM观察形貌.
1.3 载药胶束的体外释放和载药量测定
转移1mL载药胶束至透析袋,浸没在5mL释放介质磷酸盐缓冲溶液(PBS,0.01mol/L,pH=7.4,含有0.1%体积比吐温80)中,37℃恒温振荡模拟体内循环条件.于设计实验点将释放介质全部取出,补充等体积新鲜缓冲介质.取出的释放介质,使用HPLC测试药物浓度,绘制体外释放紫杉醇累积释放率-时间曲线.定体积的载药胶束加入容量瓶中,甲醇定容超声15min后使用HPLC测定紫杉醇浓度,确定载药胶束的载药量和包封率.
1.4 载药胶束对大鼠脑胶质瘤细胞的抑制
3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(噻唑蓝,MTT)能够被活细胞线粒体中琥珀酸脱氢酶氧化,但同死细胞不发生反应,利用MTT氧化后转化为蓝紫色结晶甲臜对溶液的吸光度影响,设计实验测试游离紫杉醇蓖麻油乙醇制剂、两种方法制备载紫杉醇的胶束对体外大鼠脑胶质瘤细胞(C6)存活率.C6由上海交通大学肿瘤研究所提供,以每孔5 000的密度接种在96孔板中,之后每孔中加入不同浓度的游离紫杉醇或载药胶束溶液,每个浓度平行做三组.给药48h后更换含MTT(5mg/mL)的DMEM细胞培养介质,孵育3h.除去MTT溶液,每孔加入150μL DMSO溶解细胞.用酶标仪读数,测量495nm处的吸光度值.
2 结果与讨论
2.1 PLA-PEG-PLA三嵌段共聚物的合成和表征
以乳酸锌作为催化剂,PEG端羟基引发L型丙交酯开环聚合[13]得到聚乳酸-聚乙二醇三嵌段共聚物(PLA-PEG-PLA),合成路线见图1,共聚物中两组分的摩尔比n(EO)∶n(LA)=y∶2x.依据PEG分子量将共聚物命名为PEG2k/PLA和PEG6k/PLA.

图1 双羟基PEG引发L型丙交酯开环聚合生成PLA-PEG-PLA三嵌段聚合物Fig.1 Ring-opening polymerization of L-lactide in the presence of dihydroxyl PEG using zinc lactate as catalyst
图2为两种三嵌段共聚物的1H NMR谱图,特征质子化学位移依图所示.其中LA单元中次甲基上H原子的化学位移为5.2×10-6~5.3×10-6;EO单元中亚甲基上的 H 原子化学位移为3.6×10-6~3.7×10-6.依据2-H与1-H峰面积的比值可以计算三嵌段共聚物PEG2k/PLA和PEG6k/PLA的EO/LA值,分别为4.0和5.9.
由GPC测得嵌段共聚物的分子量,PEG2k/PLA与PEG6k/PLA 的Mn分别为2 760和6 740,这与1H NMR计算出的分子量2 790和7 660结果基本一致,分子量分布分别为1.06和1.13.
临界胶束浓度(Critical Micellar Concentration,CMC)是评价胶束的重要参数,通过测定共聚物溶液的表面张力得到.图3以表面张力对溶液对数浓度作图,转折点为胶束溶液的CMC.室温下PEG2k/PLA和PEG6k/PLA在纯水中的CMC分别为0.067,0.057g·L-1.CMC值越小,形成胶束越容易.在该条件下PEG6k/PLA分子更易于缔合成胶束,胶束也更加稳定.

图2 PLA-PEG-PLA嵌段聚合物在CDCl3中的的1H核磁共振图谱Fig.2 1H NMR spectra of PLA-PEG-PLA copolymers in CDCl3
2.2 载药嵌段共聚物胶束的包封率和载药量
使用HPLC测定紫杉醇浓度,得到载入胶束的紫杉醇质量Mc.紫杉醇投药质量为Md,聚合物质量为Mm.胶束体系的包封率和载药量分别依据公式Mc/Md和Mc/(Mc+Mm)计算得到.
两种制备方法(直接溶解法和溶剂挥发/薄膜水化法)所得胶束的药物包封结果如表1所示.采用Dx-y或Sx-y代表不同胶束体系:D和S指制备方法为直接溶解法 (direct dissolution)或 溶 剂 挥 发/薄 膜 水 化 法(solvent evaporation/membrane hydration),x代表聚合物为PEG2k/PLA或聚合物PEG6k/PLA,y代表投药量百分比.比如D2-10指采用直接溶解法制备、聚合物为PEG2k/PLA、投药量为10%的胶束体系.与之类似S6-5指采用溶剂挥发/薄膜水化法制备、聚合物为PEG6k/PLA、投药量为5%的胶束体系.
比较表1数据可以发现溶剂挥发/薄膜水化法的载药量和包封率明显高于直接溶解法.这种区别与胶束的制备过程有着很重要的联系.直接溶解法在制备载药胶束时,存在一个紫杉醇溶解-进入胶束的平衡过程:首先聚合物形成胶束,加入紫杉醇后,溶于水中的少量紫杉醇因为亲水-疏水作用,扩散进入胶束的疏水内核中,因为紫杉醇在水中的溶解度很小,只有0.5μg/mL,加入的紫杉醇是大大超过其在水中的饱和度的,所以游离的紫杉醇溶解至水相中,然后再进入胶束,最后达到扩散平衡.溶剂挥发/薄膜水化法在制备载药胶束时,首先将紫杉醇和聚合物一起溶解在良溶剂乙腈中,之后经过溶剂挥发后形成聚合物薄膜,其中聚合物分子链与药物分子均匀分布.水化溶解的步骤给聚合物形成胶束提供了水相条件,聚合物自主形成胶束,形成胶束的过程中位于聚合物分子链附近的疏水紫杉醇药物分子因为同疏水性的聚乳酸链段的作用而被包覆进入到胶束核心.
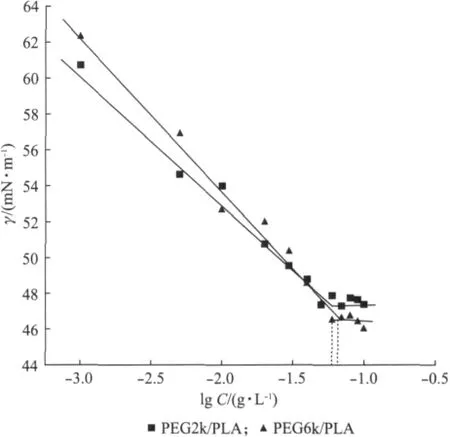
图3 三嵌段共聚物水溶液的表面张力-浓度变化曲线Fig.3 Surface tension changes of triblock copolymer solutions as a function of concentration
两种制备方法在药物包载过程中具有明显的差别,直接溶解是逐步性地将药物载入胶束内部,溶剂挥发则是一次性地包载药物至胶束核心.直接溶解法受限于紫杉醇在水中的扩散,因此具有时间效应,即随着搅拌时间的增加胶束的载药量逐步上升,是一个动态增加的过程,这一点已经在本组文章[12]中进行了详细的讨论.溶剂挥发/薄膜水化法是一个静态载药的过程,因此在相同的投药量的条件下,载药量和包封率都高于直接溶解法.
观察不同投药量的对比数据,D6-10与D6-5相比,载药量前者是后者的1.3倍,S6-10与S6-5相比,载药量前者是后者的2倍.直接溶解法的制备过程基于动态载药过程,投药量的增加对载药量的影响不甚明显.
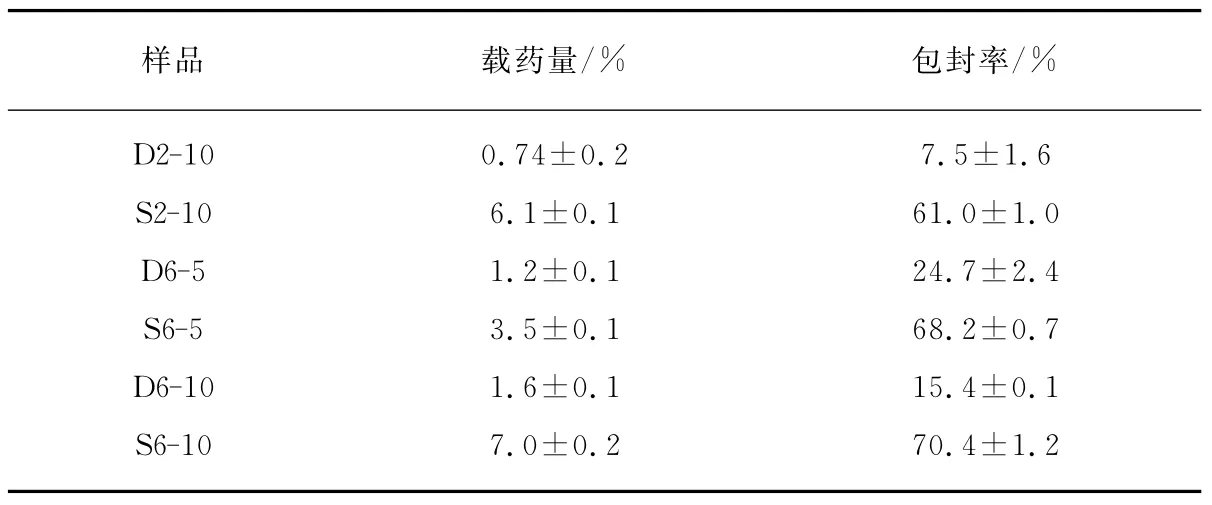
表1 直接溶解法和溶剂挥发/薄膜水化法所得胶束的药物包封结果Tab.1 Drug encapsulation data of PTX-loaded micelles prepared by direct dissolution and solvent evaporation/membrane hydration methods
2.3 胶束的粒径研究
表2给出了胶束粒径和粒径强度分布数据.疏水性药物的包载会破坏单一胶束的稳定性,造成粒径值增大或影响粒径的分布.对于聚合物PEG2k/PLA,D2-10与D2-0的粒径差异不大,较低的载药量对粒径影响甚微.S2-10的粒径高于S2-0,在高载药量条件下药物分子进入胶束内核,胶束粒径增加.对于聚合物PEG6k/PLA,D6-10与 D6-0粒径相比增加了200nm,S6-10大尺寸粒子峰强比S6-0增加了34.4%.
对比两种制备方法可以发现,采用溶剂挥发/薄膜水化法制备的胶束尺寸较直接溶解法的小.S2-0胶束体系存在两中尺寸的粒子,粒径均小于D2-0,同时S6-0胶束小尺寸粒子峰强为46.7%,高出D6-0峰强20%,胶束体系中尺寸小的胶束比例较高.
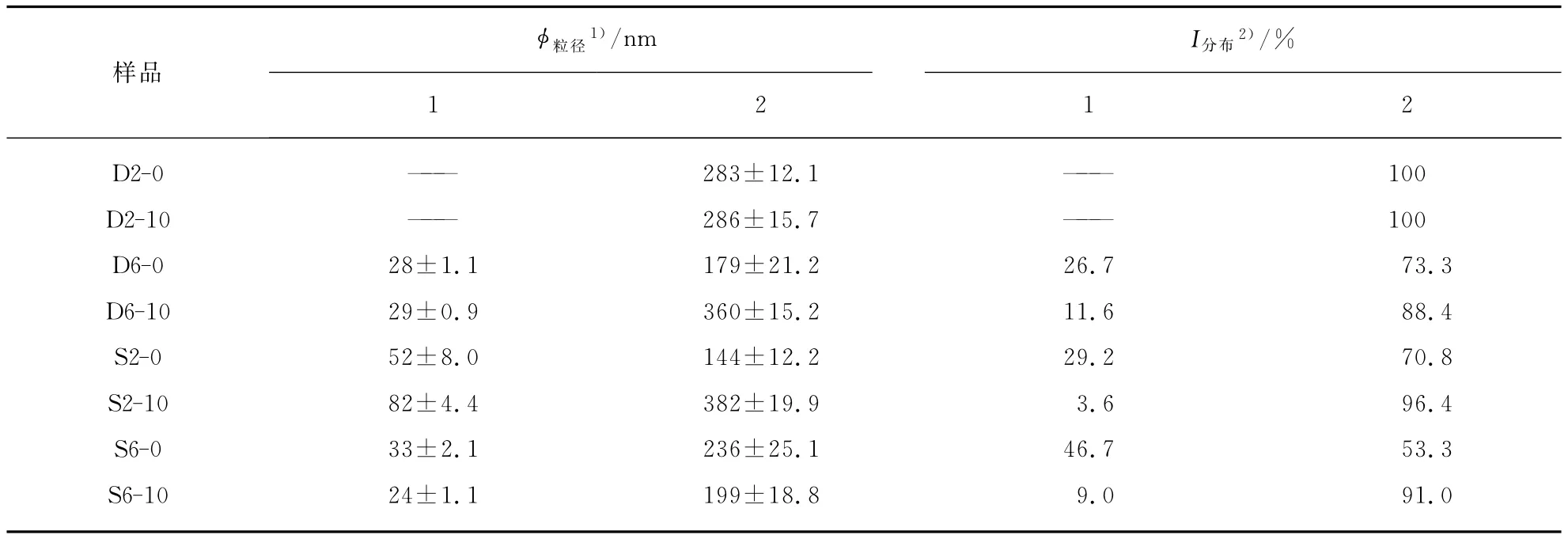
表2 不同投药量的D2,D6,S2,S6胶束粒径和强度分布Tab.2 Size and intensity distributions of D2,D6,S2,S6micelles
纳米胶束的结构形态通过SEM观察得到.图4显示了D6空白胶束和S6空白胶束的照片,可以估算出空白胶束的粒径.图4(a)中,通过直接溶解法制备的胶束的球体,粒径均一在200nm左右.图4(b)为采用溶剂挥发/薄膜水化法制备的胶束,可以明显看到存在两种尺寸的纳米粒子,粒径在50,150nm附近,胶束的边缘不规则.SEM图的粒径结果与DLS结果一致.

图4 用直接溶解法及薄膜水化法制备的空白胶束D6-0(a),S6-0(b)扫描电镜图Fig.4 SEM images of D6blank micelles prepared by direct dissolution method(a)and S6blank micelles prepared by solvent evaporation/membrane hydration.method(b)
2.4 载药胶束的体外释药性质
图5(a)给出投药量在10%的条件下选取的两种聚合物通过两种方法制备载药胶束的体外释放曲线,释放时间为2d,各胶束体系都呈现出类抛物线的释放趋势.聚合物PEG2k/PLA制备的载药胶束无论是采用直接溶解法还是溶剂挥发/薄膜水化法,其累积释放率均高于由PEG6k/PLA制备的载药胶束.D2-10和S2-10在时间点2d均达到30%左右的累积释放率,D6-10和S6-10在该时间点的累积释放率在10%左右.图5(b)列出了溶剂挥发/薄膜水化法制备的S2-5、S6-5的体外紫杉醇药物释放曲线,释放时间为20d,S2-5一直保持着高于S6-5的释放速率,这与图5(a)呈现的规律一致.
释放曲线体现出三种不同的体外释放情况:S2-5、S2-10释放的初始阶段突释明显,释放比例在20%左右,S6-10、D6-10突释释放比例在10%左右,很快在后续的时间点呈现出释放放缓的平稳阶段;S6-5在释放的初始阶段突释在1%以内,后续呈线性增长趋势,继而过度至放缓的平稳阶段;D2-10的释放曲线最接近抛物线,释放均匀且在2d的释放时间内没有呈现出明显的放缓状态.以共聚物PEG2k/PLA制备的载药胶束释放曲线均出现了较为明显的突释,与PEG6k/PLA相比其分子量更低,胶束外冠结构疏松内核分子链也较短,这使得药物通过缠结分子链释放到胶束外部更加容易,因此在释放初期药物以较快的速度释放到外界形成突释.
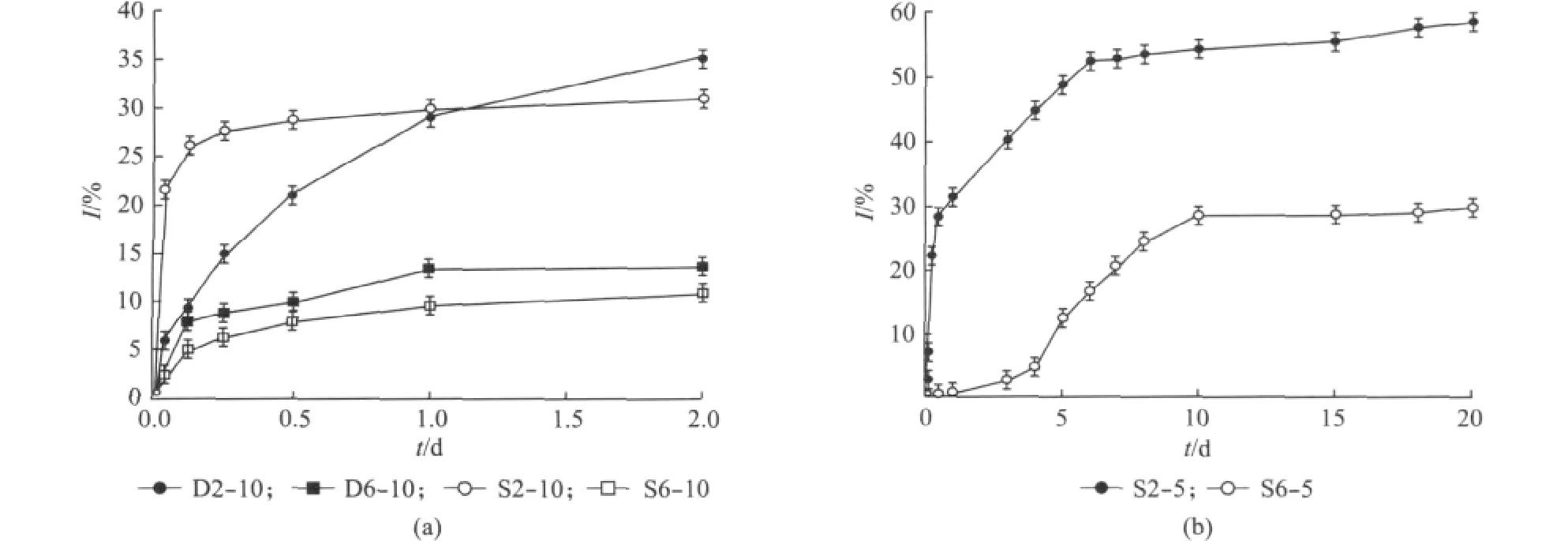
图5 直接溶解法制备所得胶束D2-10,D6-10和溶剂挥发/薄膜水化法制备胶束S2-10,S6-10的体外紫杉醇药物释放曲线(a),溶剂挥发/薄膜水化法制备的S2-5、S6-5的体外紫杉醇药物释放曲线(b)Fig.5 In vitro release of PTX from D2-10,D6-10prepared by direct dissolution and S2-10,S6-10 prepared by solvent evaporation/membrane hydration.method(a),from S2-5and S6-5 micelles prepared by solvent evaporation/membrane hydration(b)
对药物纳米粒的释放进行公式[14-16]拟合,Ritger-Peppas与Weibull方程均可以很好地拟合两种方法的释放曲线(R2>0.9),表3中列出了依据Ritger-Peppas指数模型Mt/M∞=ktn进行曲线拟合,Mt/M∞为药物在某一时刻的累积释放分数,t为释放时间,k为常数是表征释放速率的参数,n为特征参数,表示释放机制.当n<0.45时,药物的释放符合Ficks扩散机制,药物释放主要以扩散为主;当n>0.9时,药物释放是由胶束溶蚀造成的;而当n介于0.45和0.9之间时,药物释放则是二者共同作用下进行的.对比释放特征参数,D2-10的释放过程是扩散和胶束在释放介质中松弛变化共同作用的结果;S6-5的释放过程主要是胶束的结构变化引起的;而D6-10、S2-10、S6-10、S2-5主要是依赖药物的扩散作用将药物释放出来.这同样证明了PEG6k/PLA胶束结构要更加稳定.
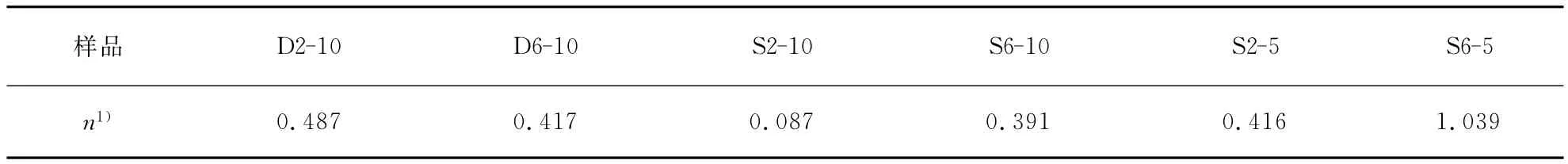
表3 Ritger-Peppas模型计算 D2-10,D6-10,S2-10,S6-10,S2-5及S6-5体外释放特征参数Tab.3 Release indicative of D2-10,D6-10,S2-10,S6-10,S2-5and S6-5micelles,calculated from Ritger-Peppas model
2.5 空白胶束及载药胶束对C6细胞的存活率的影响
将两种聚合物胶束以不同的浓度加入到C6细胞的培养基中,考察空白胶束的细胞毒性.从图6(a)的柱状图中可以了解到,两种制备方法均具有较好的细胞相容性,对细胞的生长抑制率最高为20%,对细胞的正常生长没有影响.溶剂挥发/薄膜水化法尽管在制备过程中引入有机溶剂的乙腈,但细胞毒性仍旧很低.
游离紫杉醇溶液、D2-10,S2-10对C6活力抑制-浓度对数曲线见图6.通过图6计算得到游离紫杉醇溶液、D2-10,S2-10对C6细胞的IC50分别是0.6、0.7和21.6μg/ml.48h的长周期孵育时间,D2-10与游离紫杉醇对C6细胞的毒性接近,可以在较低的药物浓度下对细胞的活性予以抑制,S2-10的细胞抑制能力弱于其他两组.这是因为,D2-10的药物胶束在孵育环境下,对于S2-10更易于逐步释放至外界环境中,以实现持续的给药.S2-10药物在前期突释后,随着药物释放速度进入平台区,细胞的活力抑制也趋于稳定.另外,这种释放规律在24h短周期孵育实验中也有体现,24h内同浓度的D2-10比S2-10对细胞的活力抑制弱.这也体现了二者释放的不同,D2-10在24h内释放较为缓慢,48h可以实现有效的缓释效果;S2-10在24h内明显突释,后续药物释放速率减缓.

图6 空白胶束D6-0和S6-0的C6细胞存活率-浓度柱状图(a),载药胶束及游离紫杉醇的C6细胞存活率-对数浓度曲线(b)Fig.6 C6viability inhibition-concentration bars of blank micelles of D6-0and S6-0(a)C6viability inhibition-logarithmic concentration curve of PTX loaded micelles(b)
聚乳酸聚乙二醇三嵌段共聚物制备紫杉醇纳米载药胶束的制备技术对胶束的粒径、药物释放行为、对肿瘤细胞的抑制效果有着显著的影响.直接溶解法具有操作方便、经济的特点,所制备的胶束为200nm粒径的球形结构.该胶束的体外释放速率稳定,对C6细胞的体外抑制结果可匹敌游离紫杉醇.然而,溶剂挥发/薄膜水化法制备的纳米胶束具有较高的载药量和包封率.与直接溶解法相比,其所制备的纳米胶束粒径较小,且存在50nm和150nm粒径共存的现象,其中,50nm粒径的纳米球约占46.7%.实验证明,聚乳酸聚乙二醇三嵌段共聚物制备纳米载药胶束具有良好的相容性特点.采用紫杉醇作为药物模型综合释放行为和药效评价对两种纳米载药体系进行筛选表明,直接溶解法具有制备的胶束稳定、粒径均一,可以实现药物的稳定释放保证长循环下的良好的药效,具有更显著的应用前景.
[1]Bergmann T K, Green H,Brasch-Andersen C,etal.Retrospective study of the impact of pharmacogenetic variants on paclitaxel toxicity and survival in patients with ovarian cancer[J].European JournalofClinicalPharmacology,2011,67(1):693-700.
[2]Chopra A,Kim T S I O S,Martinez D,etal.Combined therapy of an established,highly aggressive breast cancer in mice with paclitaxel and a unique DNA-based cell vaccine[J].IntJCancer,2006,118(11):2888-2898.
[3]Stathopoulos G P,Katis C,Tsavdaridis D,etal.Front-line paclitaxel and topotecan chemotherapy in advanced or metastatic non-small-cell lung cancer:aphase II trial[J].CancerChemotherapyand Pharmacology,2006,58(11):555-560.
[4]Iesalnieks I,Tange S,Scherer M N,etal.Paclitaxel promotes liver graft survival in rats and inhibits hepatocellular carcinoma growth in vitro and is a potentially useful drug for transplant patients with liver cancer[J].TransplantProc,2002,34(6):2316-2317.
[5]Spencer C M,Faulds D.Paclitaxel-a review of its pharmacodynamic and pharmacokinetic properties and therapeutic potential in the treatment of cancer[J].Drug,1994,48(5):794-847.
[6]Liggins R T,Burt H M.Polyether-polyester diblock copolymers for the preparation of paclitaxel loaded polymeric micelle formulations[J].AdvancedDrugDeliveryReviews,2002,54(2):191-202.
[7]Zhang X C,Jackson J K,Burt H M.Development of amphiphilic diblock copolymers as micellar carriers of taxolOriginal Research Article[J].IntJPharm,1996,132(1-2):195-206.
[8]Dong Y C,Feng S S.Methoxy poly(ethylene glycol)-poly(lactide)(MPEG-PLA)nanoparticles for controlled delivery of anticancer drugs[J].Biomaterials,2004,25(14):2843-206.
[9]Lee S C,Huh K M,Lee J,etal.Hydrotropic polymeric micelles for enhanced paclitaxel solubility:In vitroandInvivocharacterization[J].Biomacromolecule,2007,8(1):202-208.
[10]Ruan G,Feng S S.Preparation and characterization of poly(lactic acid)-poly(ethylene glycol)-poly(lactic acid)(PLA-PEG-PLA)microspheres for controlled release of paclitaxel[J].Biomaterials,2003,24(28):5037-5044.
[11]Veronese F M,Pasut G.PEGylation,successful approach to drug delivery[J].DrugDiscoveryToday,2005,10(21):1451-1458.
[12]Yang L,Wu X H,Liu F.Novel biodegradable polylactide/poly(ethylene glycol)micelles prepared by direct dissolution method for controlled delivery of anticancer drugs[J].PharmaceuticalResearch,2009,26(10):2332-2342.
[13]Li S M,Vert M.Synthesis,characterization,and stereocomplex-induced gelation of block copolymers prepared by ring-opening polymerization of l(d)-Lactide in the presence of poly(ethylene glycol)[J].Macromolecules,2003,36(21):2338-2342.
[14]Kim H,Fassihi R.Application of a binary polymer system in drug release rate modulation.1.Characterization of release mechanism[J].JournalofPharmaceuticalSciences,1997,86(3):316-322.
[15]Radwan M.Invitroevaluation of polyisobutylcyanoacrylate nanoparticles as a controlled drug carrier for theophylline[J].DrugDevelopmentandIndustrialPharmacy,1995,21(20):2371-2375.

