石榴酸对人膀胱癌T24细胞凋亡的影响
王 雯 雯, 王 晗, 王 际 辉, 叶 淑 红, 肖 珊
( 大连工业大学 食品学院, 辽宁 大连 116034 )
0 引 言
共轭脂肪酸是一类特殊的多不饱和脂肪酸。最常见的共轭脂肪酸为共轭亚油酸(CLA)和共轭亚麻酸(CLNA)。2001年,Suzuki等[1]利用高效液相色谱法,从桐油、石榴籽油等植物油中分离提纯出多种CLNA的异构体。研究发现CLNA具有比CLA更为显著的抗癌能力,因此推测CLNA强烈的胞质毒性是取决于其位置异构而非顺反异构,其抗癌机理可能与脂类过氧化有关[1-2]。对老鼠饲喂富含石榴酸的石榴籽油后,可以抑制其结肠癌和皮肤癌的发生[3-4];此外,石榴籽油还能抑制人类乳腺癌细胞系MCF-7细胞分化和通过Matrigel membrane诱导雌激素受体阴性乳腺癌细胞株MDA的凋亡[5]。
目前石榴酸 (Punicic acid, PA) 对人膀胱癌T24细胞凋亡的影响尚未有报道,本实验就是以α-亚麻酸为对照研究石榴酸对膀胱癌T24细胞的凋亡的影响,为癌症的治疗提供新的依据。
1 实 验
1.1 材料与仪器
人膀胱癌细胞株T24,大连医科大学提供;石榴酸,纯度大于98%;Hoechst33342染色剂;Annexin V-PI试剂盒;四甲基偶氮唑盐(MTT)。
CO2恒温培养箱,倒置荧光显微镜,流式细胞仪,酶标仪。
1.2 方 法
1.2.1 MTT法检测细胞活力
取对数期生长的T24细胞,胰酶消化制成每毫升含有2×107个细胞的悬液,接种于96孔培养板,每孔100 μL,5% CO2、37 ℃培养24 h,细胞贴壁后,更换无胎牛血清的培养液继续培养4 h,使细胞处于饥饿状态。用无水乙醇将α-LNA 和PA溶解。将不同浓度的 α-LNA (0、10、20、30、40、60 μmol/L)和PA (0、10、20、30、40、60 μmol/L) 分别加入对数期的细胞中,每组设3个复孔。5% CO2、37 ℃处理24 h,每孔加入20 μmol/L 的MTT溶液 10 μL,孵育3 h后吸去孔内培养液。各孔中加入150 μL二甲基亚砜(DMSO)后振荡10 min,使紫色结晶充分溶解。在OD570处使用酶联免疫检测仪测量各孔的吸光值。细胞存活率=实验组吸光度/对照组吸光度。
1.2.2 荧光染色凋亡细胞核形态观察
取对数期生长的T24细胞,胰酶消化制成每毫升含有5×107个细胞的悬液,接种于24孔培养板,每孔500 μL。37 ℃、5% CO2孵育24 h,细胞完全贴壁展开后,更换无胎牛血清的培养液继续培养4 h,使细胞处于饥饿状态。将不同浓度的α-LNA(0、10、20、30、40、60 μmol/L)和石榴酸(0、10、20、30、40、60 μmol/L)加入细胞中,每组设3个复孔,对照组只加入无水乙醇。细胞培养48 h后,在每孔中加入4 μg/mL Hoechst33342 500 μL,将其置于暗处染色10 min,最后利用荧光显微镜来观察细胞形态。
1.2.3 流式细胞术分析T24细胞凋亡
取对数生长期的细胞,制成每毫升含有5×107个细胞的悬液后接种于6孔板,每孔加入2 mL 的细胞悬液,接种后将细胞置于5% CO2、37 ℃的环境中孵育24 h,然后换成无血清培养基后继续培养4 h,使细胞状态均一。用不同浓度的PA (0、20、30、40、60 μmol/L)处理细胞24 h,对照组加入无水乙醇。在各孔细胞中加入胰酶做成细胞悬液后离心,将离心后的细胞加入200 μL缓冲液中重悬。后在此缓冲液中加入碘化丙啶(PI)及Annexin V-FITC各5 μL,置于暗处避光10 min后用流式细胞仪(Annexin V-PI法)检测细胞凋亡情况。其中Annexin-V染色阳性且PI染色阴性的细胞为凋亡细胞,细胞凋亡率为凋亡细胞所占的百分比。
2 结果与讨论
2.1 石榴酸对T24细胞增殖的影响
不同浓度的石榴酸处理T24细胞24 h(α-亚麻酸作对照),各组膀胱癌细胞在570 nm的吸光值明显降低,结果见图1。由图1可以明显地看出,当石榴酸的浓度较低(10 μmol/L)时,与对照组相比,实验组的细胞相对活力并未出现明显的变化。当石榴酸的浓度为30 μmol/L时,细胞的相对活力明显下降,约为50%,而相同浓度的石榴酸与α-亚麻酸相比,前者对细胞活力的影响作用明显强于后者,且在一定浓度范围内呈剂量依赖性,这可能与石榴酸具有的共轭三烯结构有关。由此可以看出,石榴酸对T24细胞的增殖有抑制作用,且石榴酸对T24细胞的IC50为30 μmol/L,这种抑制作用明显强于α-亚麻酸(*P<0.05)。
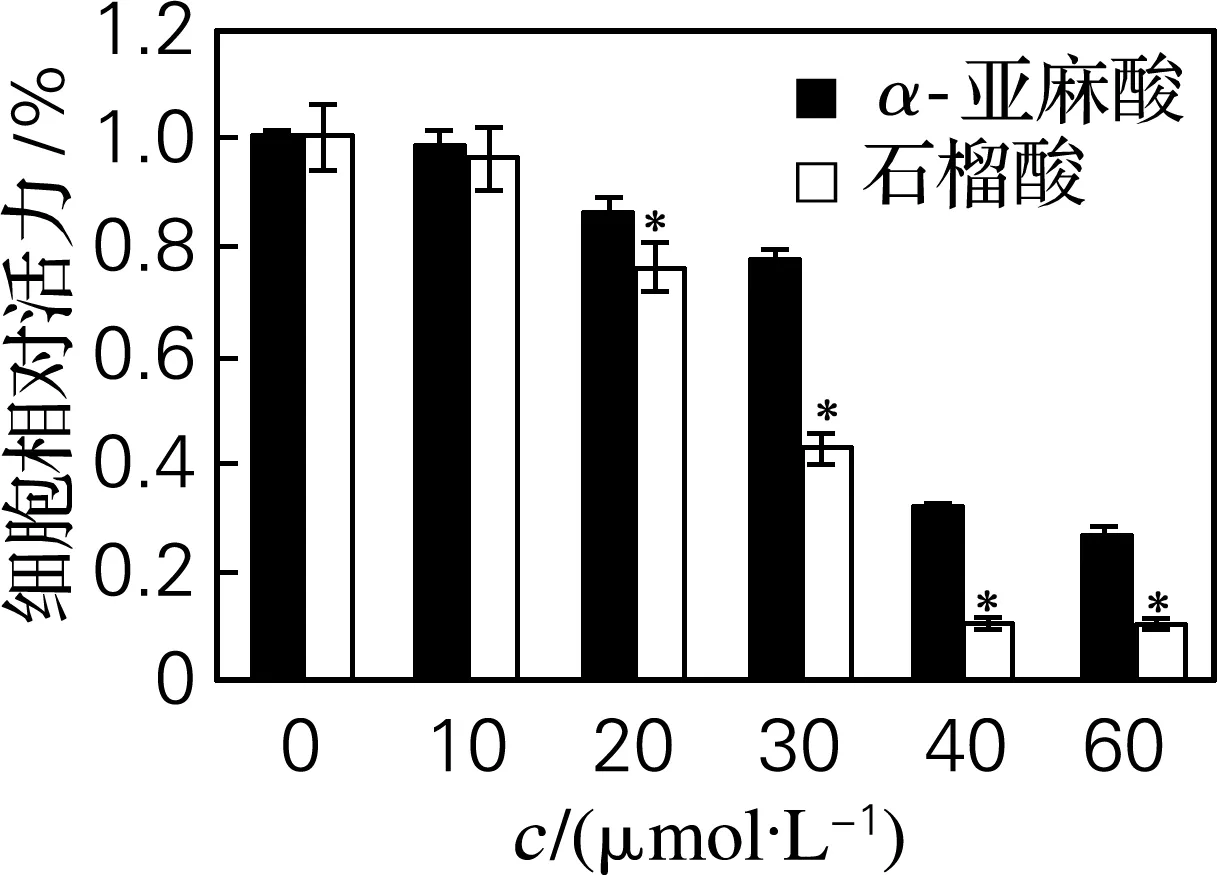
图1 石榴酸对T24细胞活动的影响
2.2 荧光显微镜检测石榴酸对T24细胞凋亡的影响
在MTT法检测结果基础上,用不同浓度的石榴酸(0、30、60 μmol/L)处理T24细胞,采用荧光显微镜观察T24细胞形态的变化,对照组为不加石榴酸的处理组,结果见图2。由图2可以看出,加入石榴酸的实验组可以明显观察到典型的细胞凋亡形态。对照组细胞的细胞核边缘整齐,表面均匀,荧光较弱;30 μmol/L 石榴酸处理48 h后,细胞核体积明显变小、皱缩,呈现致密的颗粒块状强荧光,同时核膜凹陷,染色增强;当石榴酸浓度为60 μmol/L时,细胞凋亡更加显著,凋亡程度也增强。从图2可以得出,石榴酸在较低浓度(30 μmol/L)时就对T24细胞呈现明显的促凋亡作用,使细胞形态学发生较明显的改变。
2.3 流式细胞仪检测石榴酸对T24细胞凋亡的影响
用不同浓度的石榴酸(0、30、60 μmol/L)处理细胞24 h后,T24细胞出现凋亡现象,见图3。由图3可以明显看出,在一定浓度范围内,T24细胞凋亡比例随石榴酸浓度的增加而增加,并呈剂量依赖性。30和60 μmol/L石榴酸分别处理24 h,T24细胞的凋亡率分别为49.4%和80.6%。

图2 细胞凋亡形态学检测
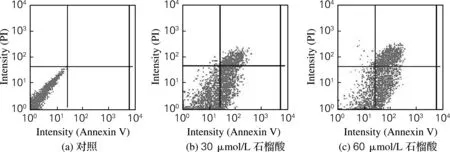
图3 细胞凋亡实验结果
3 结 论
以α-亚麻酸为对照,考察了石榴酸对膀胱癌T24细胞的凋亡影响。MTT结果显示,石榴酸与α-亚麻酸相比较,对T24细胞的抑制作用更加明显。Hoechst染色实验证明,石榴酸能引起细胞形态学的改变,这一改变是由细胞凋亡引起的。流式细胞术结果显示,石榴酸与α-亚麻酸相比,对T24的凋亡作用更明显。
综上所述,石榴酸能抑制膀胱癌T24细胞的生长活力,诱导T24细胞凋亡。本研究为膀胱癌的治疗提供了新的思路和材料,与目前抗癌类药物和放疗化疗治疗膀胱癌相比,天然产物石榴酸具有原料易提取、安全性高、毒副作用小等优点,是功能性食品开发的新材料。
[1] SUZUKI R, NOGUCHI R, OTA T, et al. Cytotoxic effect of conjugated trienoic fatty acids on mouse tumor and human monocytic leukemia cells[J]. Lipids, 2001, 36(5):477-482.
[2] AIBERCHT M, JIANG W, DIAKA J, et al. Pomegranate extracts potently suppress proliferation, xenograft growth, and invasion of human prostate cancer cells[J]. Journal of Medical Food, 2004, 7(3):274-283.
[3] HORA J J, MAYDEW E R, LANSKY E P, et al. Chemopreventive effects of pomegranate seed oil on skin tumor development in CD1 mice[J]. Journal of Medical Food, 2003, 6(3):157-161.
[4] KIM N D, MEHTA R, YU W P, et al. Chemopreventive and adjuvant therapeutic potential of pomegranate (Punica granatum)for human breast cancer[J]. Breast Cancer Research and Treatment, 2002, 71(3):203-217.
[5] MEHTA R, LANSKY E P. Breast cancer chemopreventive properties of pomegranate (Punica granatum) fruit extracts in a mouse mammary organ culture[J]. European Journal of Cancer Prevent, 2004, 13(4):345-348.

