稀酸水解绿潮藻及发酵制生物丁醇研究*
衣 丹,高春蕾,王能飞,庞 敏,张学雷
(国家海洋局 第一海洋研究所,山东 青岛266061)
近年能源危机引起了世界对未来供应不足的普遍关注,促使人类寻求可再生能源。丁醇是重要化工原料,也是极具潜力的新型生物燃料[1]。联合国国际能源署将生物丁醇列为第二代生物燃料[2-3]。但是传统生产生物丁醇的原料淀粉、糖蜜成本高昂,约占丙酮丁醇发酵总成本的60%[4],成为丙酮丁醇发酵工业缺乏竞争性的重要因素。同时,随着地球上人口的急剧膨胀,食品用粮及工业用粮均感严重不足。而纤维资源是自然界有机物中分布最广、生产量最大的可再生生物质能源。我国对纤维生物质能源的开发利用主要集中在秸秆、玉米芯、稻草、废弃木材等,而对海藻生物质能源的研究相对较少,我国绿潮藻浒苔资源十分丰富,仅福建沿海每年的产量就在10万t以上,养殖海域中一年四季均可发生[5]。2008年以来,我国南黄海连续3年爆发绿潮藻,且规模和生物量一年比一年大,如何处置和利用如此巨大的海藻,已成为我国绿潮藻灾害防灾减灾重大项目研究内容之一[6]。因此探索利用绿潮藻浒苔纤维生产燃料成为生物质能源发展战略的重要组成。
目前,能进行丁醇发酵的微生物有Clostridium acetobutylicum,C.beijerinckii,C.saccharoperbutylacetonicum和C.saccharobutylicum四种[7]。由于溶剂产生菌不能直接有效利用纤维素,因此纤维原料必须先经预处理(物理法、化学法或生物法)成为单糖再进行发酵[8]。本研究通过稀酸法[9-10]从绿潮藻浒苔中提取还原糖,考察不同条件下浒苔渣的水解情况,并以浒苔渣水解液为底物以丙酮丁醇梭菌(Clostridium acetobutylicum)作为发酵菌,发酵生产丁醇,探讨利用绿潮藻浒苔生产丁醇技术,实现海洋生物质资源的高效利用。
1 材料与方法
1.1 浒苔藻种
2011-08采自青岛海区漂浮的绿潮藻,主要种类为浒苔(Enteromorphaprolifera)。用干净海水冲,除去杂物,晒干,放于干燥避光通风处储存备用。
1.2 菌 种
丙酮丁醇梭菌(Clostridium acetobutylicum)CICC8016,购自中国工业微生物菌种保藏中心。
1.3 仪器与试剂
p H计PHS-3C,生化培养箱GNP-9080BS-Ⅲ,分光光度计UV754N,自动压力蒸汽灭菌锅GI54DS,气相色谱仪Agilent GC(6890N),实验中所用化学试剂为分析纯。
1.4 培养基
种子培养基的成分(g/L):葡萄糖10;胰蛋白胨5;酵母粉5;大豆蛋白胨5;K2HPO40.5;MgSO4·7H2O 0.2;FeSO4·7 H2O 0.01;L-半胱氨酸0.5。将培养基在115℃下灭菌15 min,热处理的孢子悬浊液在37℃条件下培养14~16 h后作为接种液。
发酵培养基:浒苔水解液经过抽滤、中和、灭菌后作为碳源,添加其他营养成分作为发酵培养基。
1.5 实验方法
1.5.1 浒苔水解反应条件
将晒干浒苔用粉碎机粉碎,过40目筛备用。在250 m L三角烧瓶中加入一定体积和质量分数的硫酸,加入一定量的浒苔渣并混匀,研究硫酸质量分数、料水比、水解温度和水解时间对浒苔渣水解效果的影响。设计反应条件如下:1)硫酸质量分数为1%,1.5%,2%,2.5%,3%,4%,5%;2)料水比(g∶m L)为1∶5,1∶10,1∶15,1∶20,1∶25;3)反应温度为90,100,110,120,130℃;4)水解时间为10,20,30,40,50,60,90,120 min。
1.5.2 浒苔水解液发酵
以10%接种量转接种子液到发酵培养基(50 m L培养基于总容积为150 m L的厌氧培养瓶)中,37℃静置发酵72 h。发酵结束后,取2 m L样品,8 000 r/min离心10 min后,取上清液,保存于-20℃冰箱,待测。
1.5.3 溶剂质量浓度测定
用气相色谱Agilent GC(6890N)测定溶剂各组分,FID检测器。色谱条件:色谱柱Thermo TGWAXMS(30.0 m×320μm×0.5μm),柱温箱程序升温:起始50℃,以5℃/min升到150℃,保持10 min,进样温度160℃,FID检测器温度250℃,H2流速30 mL/min,空气流速300 mL/min,载气N2流速4 m L/min,进样量0.2μL,分流比5∶1。
1.5.4 糖质量浓度测定
总还原糖质量浓度测定分别采用DNS法[11]。
1.5.5 计算方法
还原糖提取率/%=还原糖质量浓度×水解液体积/浒苔渣干重×100%
丁醇得率/%=丁醇质量浓度/发酵液还原糖质量浓度×100%
溶剂转化率/kg·kg-1=溶剂产量kg/浒苔渣干重kg
2 结 果
2.1 浒苔稀酸水解
2.1.1 硫酸质量分数对还原糖质量浓度和提取率的影响
在料水比为1∶15、温度为120℃、水解时间为30 min的反应条件下,考察不同的硫酸质量分数对浒苔渣水解还原糖产率的影响,实验结果(图1)显示:随着酸质量分数的增加,还原糖质量浓度不断升高,对实验仪器的腐蚀越强,硫酸质量分数过高又会破坏葡萄糖等单糖分解成羟甲基糠醛、类黑素等[12]影响发酵,且还原糖提取率在硫酸质量分数>3%后,上升幅度不大,因此确定稀酸水解适宜的硫酸质量分数为3%。
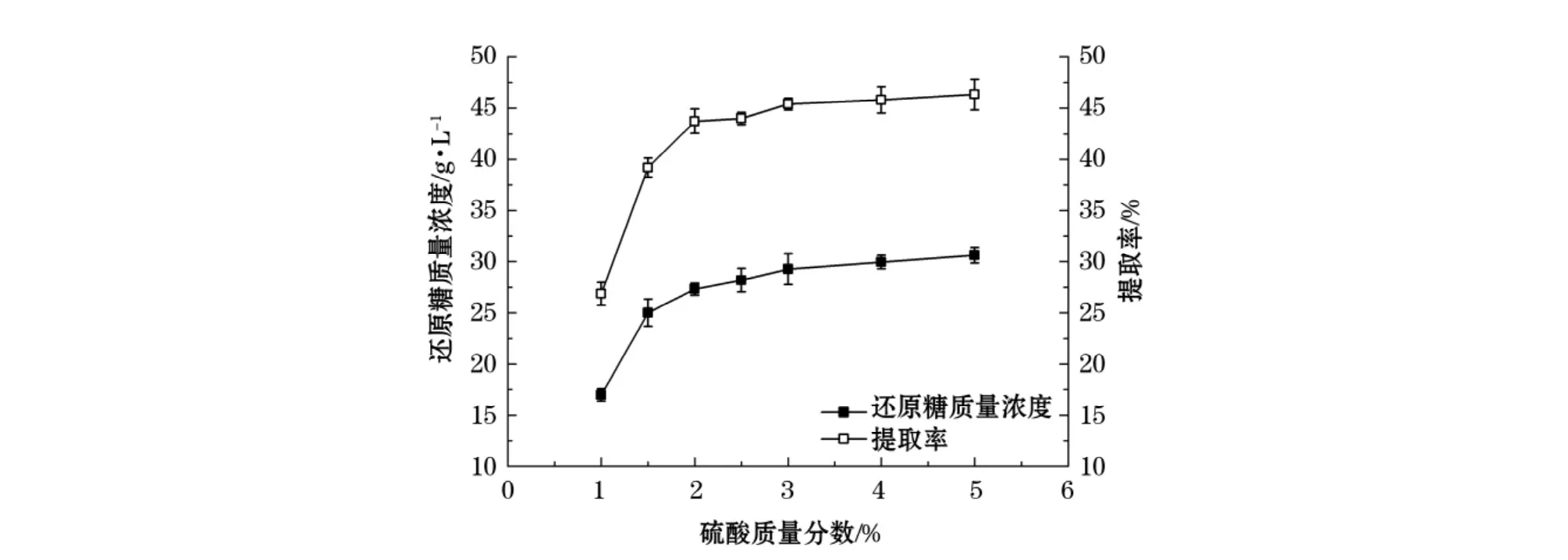
图1 硫酸浓度对还原糖质量浓度和提取率的影响Fig.1 The effect of sulfuric acid concentrations on concentration and extraction rate of reducing sugar
2.1.2 料水比对还原糖质量浓度和提取率的影响
在温度为120℃,硫酸质量分数为3%,水解时间为30 min的反应条件下,考察不同料水比对浒苔渣水解还原糖产率的影响,实验结果(图2)显示:在料水比小于1∶15时,水解液中还原糖提取率随着料水比的增大而升高显著;料水比大于1∶15后,还原糖提取率的增加相对减小。这是因为料水比较小时,浒苔渣和硫酸混合不均匀,硫酸不能完全浸入,不利于水解,所以提取率不高。同时还原糖质量浓度随料水比的增加逐渐降低。当料水比为1∶25时,还原糖提取率虽然最高,但还原糖质量浓度只有19.12 g/L对后续的单糖利用不利。综合以上实验结果料水比采用1∶15最合适。
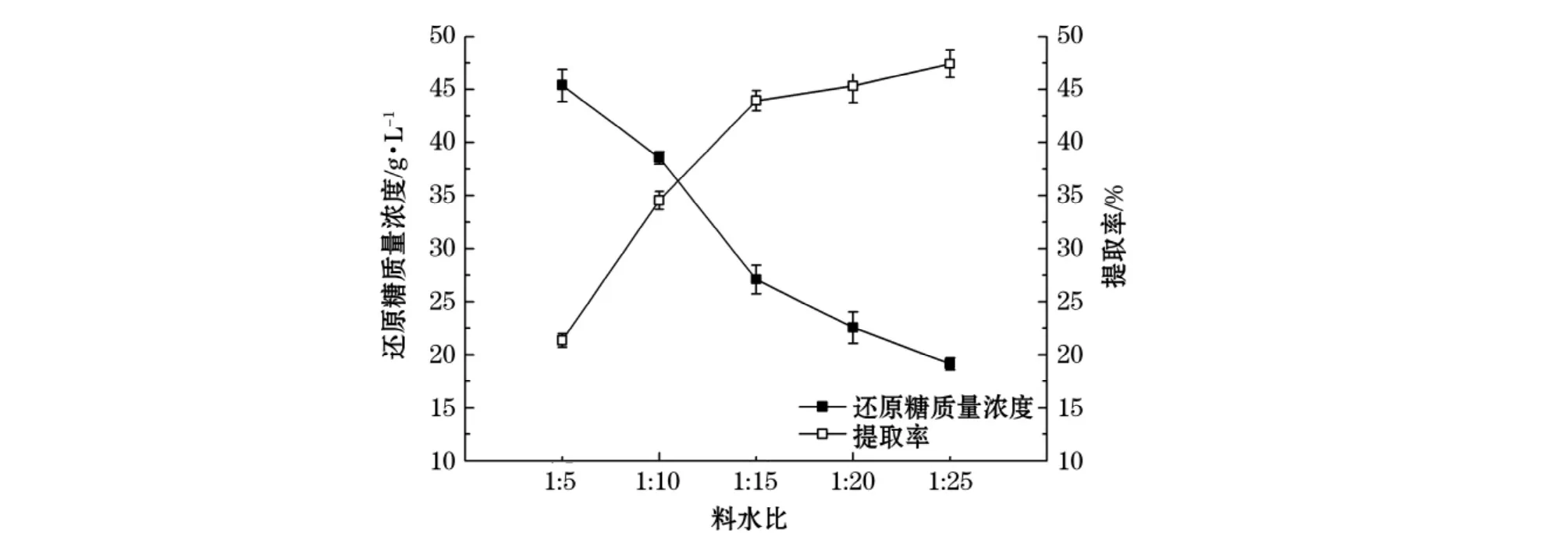
图2 料水比对还原糖质量浓度和提取率的影响Fig.2 The effect of solid-liquid ratio on concentration and extraction rate of reducing sugar
2.1.3 反应温度对还原糖质量浓度和提取率的影响
在料水比为1∶15,酸质量分数为3%,水解时间为30 min的反应条件下,考察温度变化对浒苔渣水解还原糖产率的影响。实验结果如图3所示:在90℃时反应几乎不进行,100℃还原糖的质量浓度和提取率很低,之后随着温度的升高,反应速率加快,还原糖质量浓度及提取率快速提高,但在高温下生成的单糖会受热降解,因此,实验选取最适宜温度为120℃。
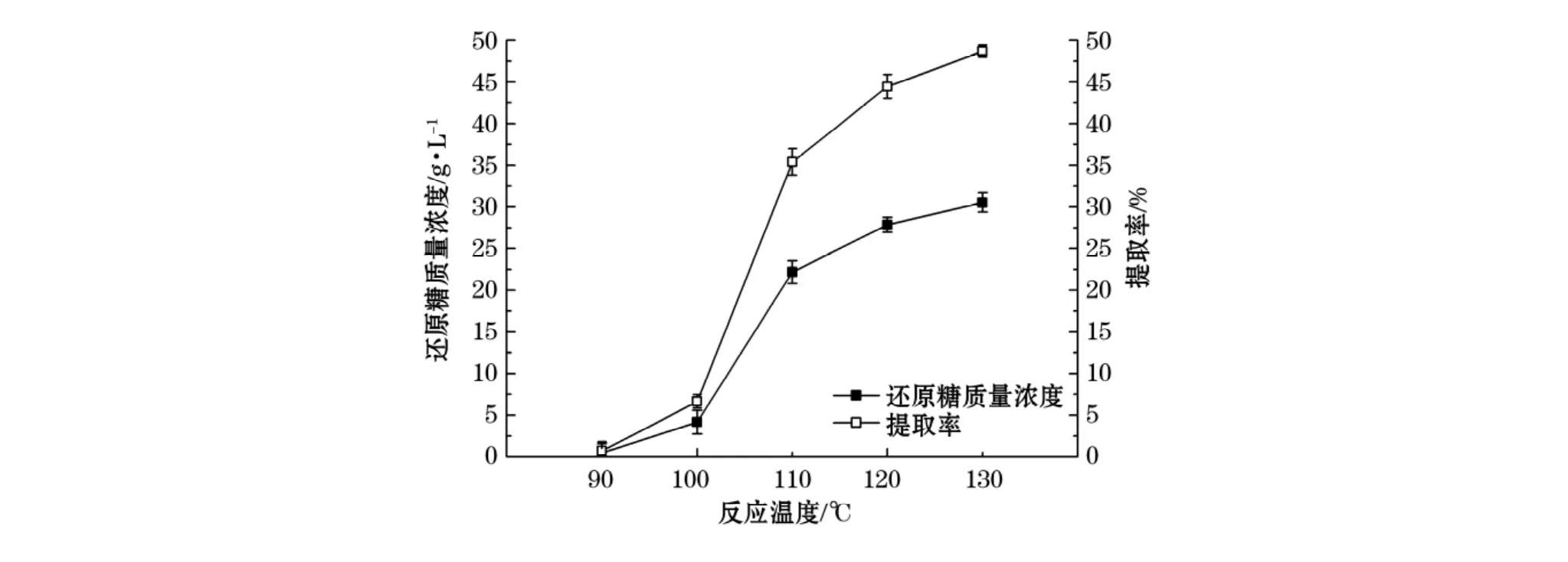
图3 反应温度对还原糖质量浓度和提取率的影响Fig.3 The effect of temperature on concentration and extraction rate of reducing sugar
2.1.4 反应时间对还原糖质量浓度和提取率的影响
在料水比为1∶15,酸质量分数为3%,水解温度为120℃的反应条件下,考察反应时间对浒苔渣水解还原糖产率的影响,实验结果如图4所示:随着反应时间的延长,还原糖的质量浓度和提取率不断升高,在60 min后还原糖的质量浓度和提取率随时间的延长变化很小,综合考虑在实验中选择反应60 min。
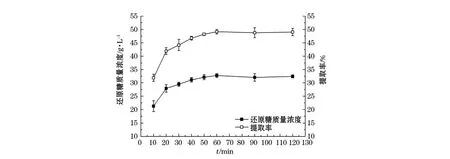
图4 反应时间对还原糖质量浓度和提取率的影响Fig.4 The effect of treating time on concentration and extraction rate of reducing sugar
经过以上稀酸水解条件的优化,得到水解液的还原糖质量浓度为32.78 mg/m L,还原糖提取率为49.17%。
2.2 浒苔稀酸水解液发酵制丁醇
2.2.1 氮源对丁醇发酵的影响
以中和处理后的浒苔渣水解为发酵培养基,在其中添加质量分数0.2%的不同氮源(硫酸铵、氯化铵、乙酸铵、柠檬酸铵、硝酸铵、尿素),并以不加任何氮源的原始发酵液为对照,进行发酵培养。从图5分析可知,丙酮丁醇梭菌可利用多种无机氮源。硝酸铵为氮源时丁醇质量浓度很低;以乙酸铵为无机氮源时,丙酮的质量浓度明显高于其它发酵,这是由于乙酸铵含有乙酸基,在丁醇发酵时乙酸基转化为丙酮,从而增加了丙酮的质量浓度;总体来说与不添加任何氮源的水解液进行发酵对比,氮源的种类对发酵影响不大,其中以硫酸铵为氮源时发酵的丁醇质量浓度效果最好。
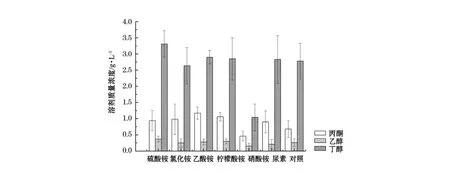
图5 氮源种类对丁醇发酵的影响Fig.5 The effect of nitrogen source on fermentation for butanol production
2.2.2 初始糖质量浓度对丁醇发酵的影响
高质量浓度的还原糖底物对丙酮丁醇梭菌有较强的抑制作用,为防止底物对生物体的毒害作用,需将底物浓度维持在一定范围。
从图6分析可知随着还原糖质量浓度的增加,丁醇产量也是随之增加,还原糖质量浓度超过30 g/L丁醇产量开始下降,分析原因可能是过高的还原糖质量浓度对丙酮丁醇梭菌的生长具有一定的抑制作用,还原糖量过高产生过多的丁酸或乙酸也同时对它的代谢构成一定的负面作用。质量浓度在20~40 g/L之间时,还原糖达到较高的利用率,而且比较稳定。当还原糖质量浓度为30 g/L时,产生的丁醇达到最大值,产量为3.39 g/L。
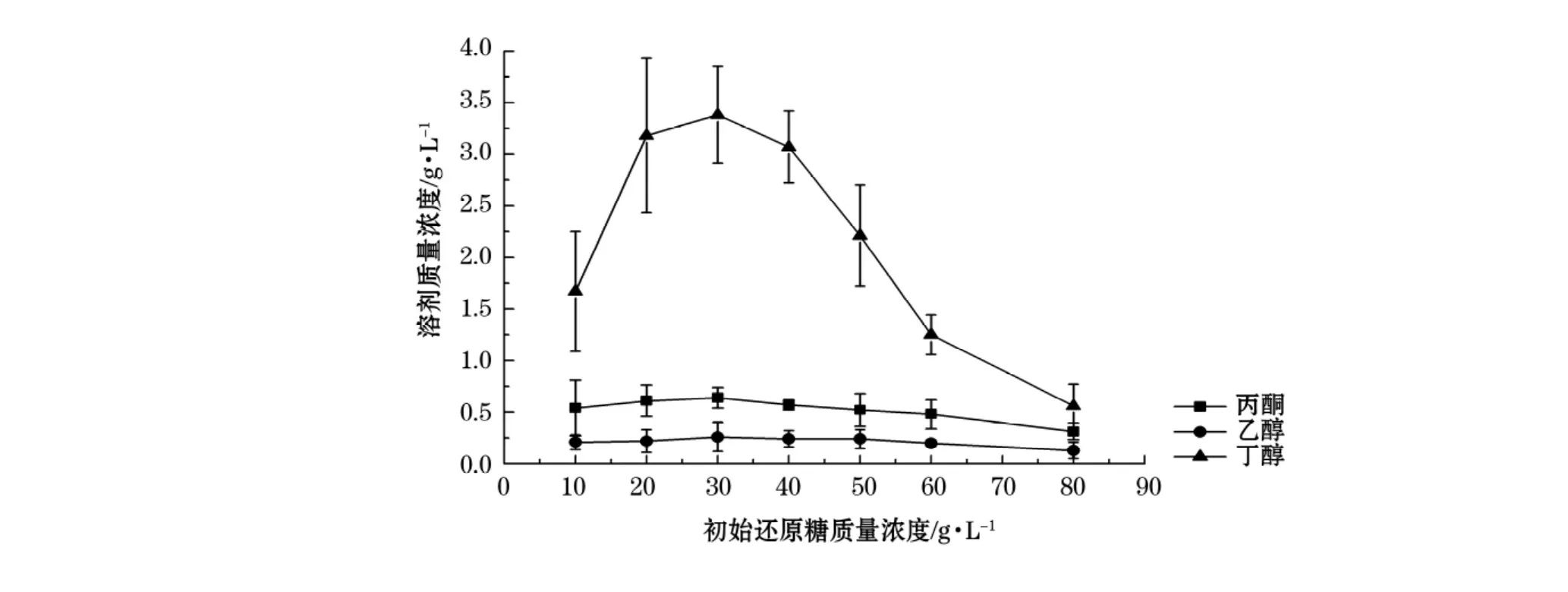
图6 初始糖浓度对丁醇发酵的影响Fig.6 The effect of initial reducing sugar concentrations on fermentation for butanol production
2.2.3 稀酸水解液丁醇发酵结果
由表1可知,在中和后的发酵液中添加2%的硫酸铵,还原糖质量浓度为30 g/L时,发酵72 h,丁醇质量浓度达到3.39 g/L,总溶剂质量浓度达4.29 g/L,丁醇得率为11.3%,总溶剂转化率为0.069 kg/kg。
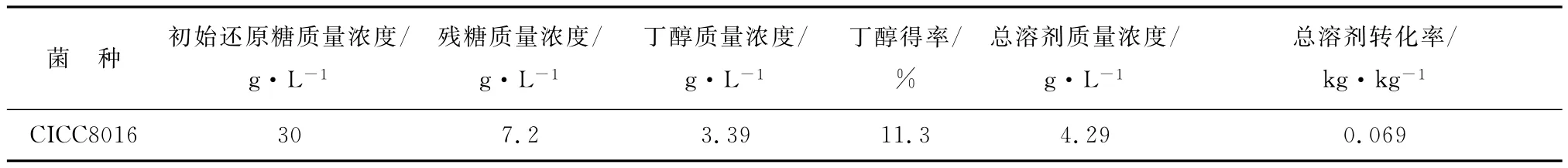
表1 稀酸水解液丁醇发酵结果Table 1 The result of hydrolysate fermentation for utanol production
3 讨 论
大型绿潮藻浒苔已经连续多年在青岛近岸聚集,影响人们正常生活和城市旅游业的发展,浒苔是具有开发潜力的大型海藻,目前我国对浒苔资源的利用还仅限于作为食品、饲料原料和某些生物活性物质的提取。利用浒苔作为生物质资源生产清洁燃料,是浒苔资源综合利用的重要选择,对解决我国生物质能资源短缺具有重要意义。
秦松等[13]发明了浒苔经过预处理、稀酸水解(不需经过酶解),发酵液用氢氧化钙中和至中性,直接用于制备生物乙醇技术。张维特等[6]采用酸水解法利用浒苔生产乙醇,用5%硫酸在90℃下处理70 min,经酿酒酵母S2发酵后乙醇质量浓度为2.1 g/L,乙醇得率为26%,但是所用硫酸浓度较高,对仪器设备有一定损害。本研究利用稀酸预处理可以使浒苔渣中纤维素降解,通过单因素试验确定稀酸预处理的条件为:硫酸质量分数3%、料水比1∶15、温度120℃下处理60 min,可得还原糖浓质量浓度为32.78 g/L,还原糖提取率为49.17%。所得还原糖质量浓度与张维特[6]用质量分数5%硫酸预处理所得还原浓度39.73 g/L的结果比稍低,但是硫酸质量分数要小对仪器设备损害小,对还原糖破坏性低。根据初始糖质量浓度对丁醇发酵的影响实验,32.78 g/L的还原糖质量浓度更接近理想的发酵底物浓度,不用稀释,可以直接用于接下来的丙酮丁醇梭菌发酵。
绿潮藻浒苔中的纤维素和半纤维素的质量分数为33.7%,是良好的纤维素生物质来源[14],目前以浒苔为原料生产丁醇还未见报道。国内厌氧发酵生产生物丁醇的主要原料为玉米、谷物、薯干等淀粉质粮食资源。如何利用廉价非粮食原料生产丁醇来降低其生产成本,成为该产业所必须直面的问题。相关研究人员正在尝试用纤维资源替代粮食作物,用于作为丁醇发酵的原料有玉米、水稻、小麦的秸秆,甜菜蜜糖、稻草等。
本研究以浒苔渣稀酸水解液中和后作为发酵液,被丙酮丁醇梭菌8016有效利用,在添加质量分数2%的硫酸铵,还原糖质量浓度为30 g/L时,厌氧发酵后可产丁醇3.39 g/L。浒苔经稀酸处理和溶剂发酵,1 kg干浒苔渣可产0.069 kg溶剂,而理论上1 kg玉米可生产0.265 kg溶剂,1 kg糖蜜(含蔗糖50%)可生产0.15 kg溶剂,1 kg干稻草可生产0.103 kg溶剂[4],因此1 kg干浒苔渣可相当0.26 kg玉米、0.46 kg糖蜜或0.67 kg干稻草。可见,绿潮藻浒苔水解液的丙酮丁醇发酵有着巨大的潜在应用价值。随着预处理方法的改进,水解液脱毒处理,相信可以进一步提高丁醇产量,也是今后的研究方向。
:
[1] HUANG X,CAI Y H.Research status and progress of biological butanol[J].Sci-tech Information Development And Economy,2010,20(35):148-150.黄潇,蔡颖慧.生物丁醇研究现状及进展[J].科技情报开发与经济,2010,20(35):148-150.
[2] LEE S Y,PARK J H,JANG S H,et al.Fermentative butanol production by clostridia[J].Biotechnology and Bioengineering,2008,101(2):209-228.
[3] LIU Y,LIU H J,ZHANG J A,et al.Research progress in new biofuel butanol[J].Modern Chemical Industry,2008,28(6):28-33.刘娅,刘宏娟,张建安,等.新型生物燃料-丁醇的研究进展[J].现代化工,2008,28(6):28-33.
[4] CHEN S W,MA X,WANG L S,et al.Acetone-butanol fermentation of rice straw enzymatic hydrolysate[J].Industrial Microbiology,1998,28(4):30-34.陈守文,马昕,汪履绥,等.稻草酶法水解液的丙酮丁醇发酵[J].工业微生物,1998,28(4):30-34.
[5] ZHANG Y,LIU P X,CHENG X S.The use and research progress of Enteromorphaprolifera[J].Ocean Development and Manage-ment,2009,26(8):97-100.张勇,刘鹏霞,程祥圣.浒苔的利用和研究进展[J].海洋开发与管理,2009,26(8):97-100.
[6] ZHANG W T,SHI X,OU J,et al.Effect of preparing alcohol with green tide algae biomass by acid hydrolysis[J].Journal of Shanghai Ocean University,2011,20(1):131-136.张维特,时旭,欧杰,等.酸法水解绿潮藻生物质及发酵制乙醇的效果[J].上海海洋大学学报,2011,20(1):131-136.
[7] KEIS S,SHAHEEN R,JONES D T.Emended descriptions of Clostridium acetobutylicum and Clostridium beijerinckii,and descriptions of Clostridium saccharoperbutylacetonicum sp.nov.and Clostridium saccharobutylicum sp.nov[J].international Journal of Systematic and Evolutionary Microbiology,2001,51(6):2095-2103.
[8] EZEJI T,QURESHI N,BLASCHEK H P.Butanol production from agricultural residues:Impact of degradation products on Clostridium beijerinckii growth and butanol fermentation[J].Biotechnology and Bioengineering,2007,97(6):1460-1469.
[9] CHANG C,MA X J,LI H L,et al.Kinetic studu on sawdust decomposition under high temperatureand dilute acid conditions[J].Actaenergiaesolaris sinica,2009,30(8):1714-1716.常春,马晓建,李洪亮,等.高温稀酸条件下木屑降解动力研究[J].太阳能学报,2009,30(8):1714-1716.
[10] YAO X Q,WANG N N.Resrerch of ethanol production from Jerusalem artichoke by dilute acid hydrolyzation[J].Applied Chemiacal Industry,2011,40(3):502-506.姚秀清,王娜娜.稀酸水解菊芋制乙醇技术研究[J].化工应用,2011,40(3):502-506.
[11] GUO W,ZHANG Z,WANG P.An investigation into sugar extracting from cassava stalk with acid pretreatment and enzyme hydrolyzsis[J].Paper Science And Technology,2009,28(3):24-27.郭薇,张曾,王萍.酸预处理—酶水解法从木薯秆中提取糖的研究[J].造纸科学与技术,2009,28(3):24-27.
[12] LAI C H.The study on single cell protein feed from cassava starch residua[D].Guangxi:Guangxi University,2006.赖翠华.木薯淀粉渣制取单细胞蛋白饲料的实验研究[D].广西:广西大学,2006.
[13] QIN S,FENG D W,LIU H Y,et al.A kind of method Enteromorphaprolifera as raw material to prepare ethanol:China,200810157676[P].2009-04-29.秦松,冯大伟,刘海燕,等.一种以浒苔为原料制取生物乙醇的方法:中国,200810157676[P].2009-04-29.
[14] LIU Z K.The research on transformed craft of biological ethanol of low value seaweed Enteromorphaprolifera[D].Qingdao:Ocean University of China,2011.刘政坤.低值海藻浒苔生物 (Enteromorphraprolifera)乙醇转化工艺的研究[D].青岛:中国海洋大学,2011.

