不同因素对高温脱脂豆粕蛋白提取率的影响
刘明美 齐 斌 赵国琦 张文豪 朱伟成
(1.扬州大学动物科学与技术学院,扬州 225009;2.江苏联合职业技术学院淮安生物工程分院,淮安 223200;3.常熟理工学院,苏州 215500)
被誉为“绿色牛奶”、“植物肉”的大豆蛋白是一种可与动物蛋白相媲美的优质蛋白质,目前国内外主要以蛋白质变性程度较低的低温脱脂豆粕为原料,通过碱溶酸沉法提取[1-3]。而占国内豆粕产量90%以上的高温脱脂豆粕经高温处理后,一方面,因豆粕内大部分的不耐热抗营养因子活性被降低或灭活,从而更有利于动物对蛋白质的消化吸收和利用;另一方面,豆粕蛋白变性严重,不利于蛋白提取,主要用作畜禽饲料,从而大大限制了高温脱脂大豆粕深加工产品的开发及应用。近年来,国内外虽然开展了利用高温脱脂豆粕生产醇洗浓缩蛋白[4]、酶解[5]或超声提取蛋白[6-7]等研究,但缺少对影响其蛋白提取率各因素的系统研究,从而无法较为全面地确定高温脱脂豆粕蛋白提取的最佳条件。为此,我们在前人研究基础上,通过单因素和正交试验设计,采用传统的碱溶酸沉与超声辅助技术相结合的方法,对影响蛋白提取率的提取温度、超声时间、pH、粉碎细度、水料比、超声功率、提取时间7因素进行了系统研究,并优化了高温脱脂豆粕的大豆蛋白提取条件,以期为高温脱脂豆粕进行深加工,开发其更大、更广的利用价值提供依据。
1 材料与方法
1.1 试验材料
高温脱脂豆粕(粗蛋白质含量为51.96%):吉林丰正大豆食品有限公司;三蒸水:实验室自制;考马斯亮蓝试剂盒:南京建成生物工程研究所;HCl与NaOH:分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
KQ-500DE型数控超声波清洗器;FS-6D型大流水式粉碎机;赛多利斯PB-21型酸度计;SHA-C型恒温水浴锅;FA2004型分析天平;Anke低速大容量离心机;756型分光光度计;DHG-9240A型电热恒温鼓风干燥箱;SZ-97型自动三重纯水蒸馏器。
1.3 试验设计
1.3.1 单因素试验设计
在单因素试验中,分别研究了提取温度、超声时间、pH、粉碎细度、水料比、超声功率、提取时间对高温脱脂豆粕蛋白提取率的影响。各因素设置水平如下:提取温度,20、30、40、50、60、70 ℃;超声时间,0、5、10、15、20、30 min;pH,8.0、8.5、9.0、9.5、10.0、10.5;粉碎细度,0(未粉碎)、40、60、80、100、120 目;水料比,5∶1、10∶1、15∶1、20∶1、25∶1、30∶1(mL/g);超声功率,0、200、300、400、500 W;提取时间,15、30、45、60、90 min。各因素的每个水平设3个重复。测定某一因素时其他因素为非测定因素,预试验选择非测定因素的水平为提取温度50℃、超声时间15 min、pH 10.0、粉碎细度80目、水料比15∶1(mL/g)、超声功率 400 W、提取时间60 min(超声+水浴震荡)。
1.3.2 正交试验设计
根据单因素试验结果,设计出7因素3水平正交试验(表1),设3个重复。
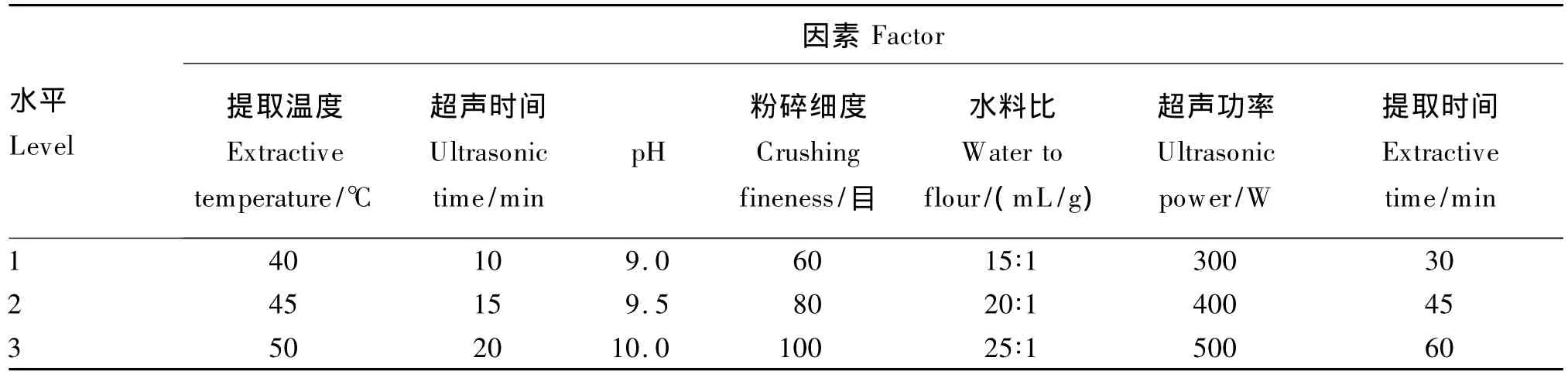
表1 L18(3)7正交试验设计Table 1 L18(3)7 orthogonal design
1.4 大豆蛋白的提取与测定方法
准确称取经去杂、粉碎等预处理的高温脱脂豆粕1 g,按比例加入三蒸水,调节其pH,在一定温度下经不同功率不同超声时间处理后,恒温水浴振荡提取一定时间,通过滴加1 mol/L NaOH或HCl溶液保持液料pH在提取过程中不变。浸提后离心(4 000 r/min,20 min),收集上清液,考马斯亮蓝法测定上清液的蛋白质含量。

凯氏定氮法测定试验材料高温脱脂豆粕中的粗蛋白质含量[8]。
1.5 数据处理与分析
试验数据通过Excel 2007整理后,采用SPSS 16.0单因素方差分析(one-way ANOVA,LSD),以P<0.05作为差异显著性标准。
2 结果
2.1 单因素提取条件对蛋白提取率的影响
在其他6个因素相对固定的条件下,分别测定了不同水平的某一因素对大豆蛋白提取率的影响,结果如表2所示。由表2可以看出,各粉碎组的豆粕蛋白提取率显著高于未粉碎组(P<0.05),其中80目组的蛋白提取率显著高于其他各组(P<0.05),较0、40、60目组的蛋白提取率分别提高了83.81%、40.46%和17.43%;粉碎细度高于80目后,蛋白提取率却出现下降趋势。在本试验设置的pH范围内,随着pH的增加,大豆蛋白提取率升高,其中pH 10.5组的蛋白提取率比pH 8.0组提高了38%,差异显著(P<0.05)。提取温度小于50℃时,蛋白提取率随着提取温度升高而显著增加(P<0.05);但当提取温度高于50℃后,蛋白提取率增加减缓,随着提取时间组的延长,蛋白提取率逐渐上升,但差异不显著(P>0.05)。水料比为 20∶1组的蛋白提取率比 5∶1组提高了21.39%,显著高于水料比为 5∶1、10∶1、15∶1 组的蛋白提取率(P<0.05)。超声组的大豆蛋白提取率都显著高于未超声组(P<0.05),但不同超声时间组的差异却不显著(P>0.05),超声时间5 min组的大豆蛋白提取率比未超声组提高了29.76%。超声功率在0~300 W范围内时,随着超声功率的提高,蛋白提取率增加,超声功率300 W组的提取率比未超声组提高了8.24%,超声功率400、500 W组的蛋白提取率稍微下降,但差异不显著(P>0.05)。
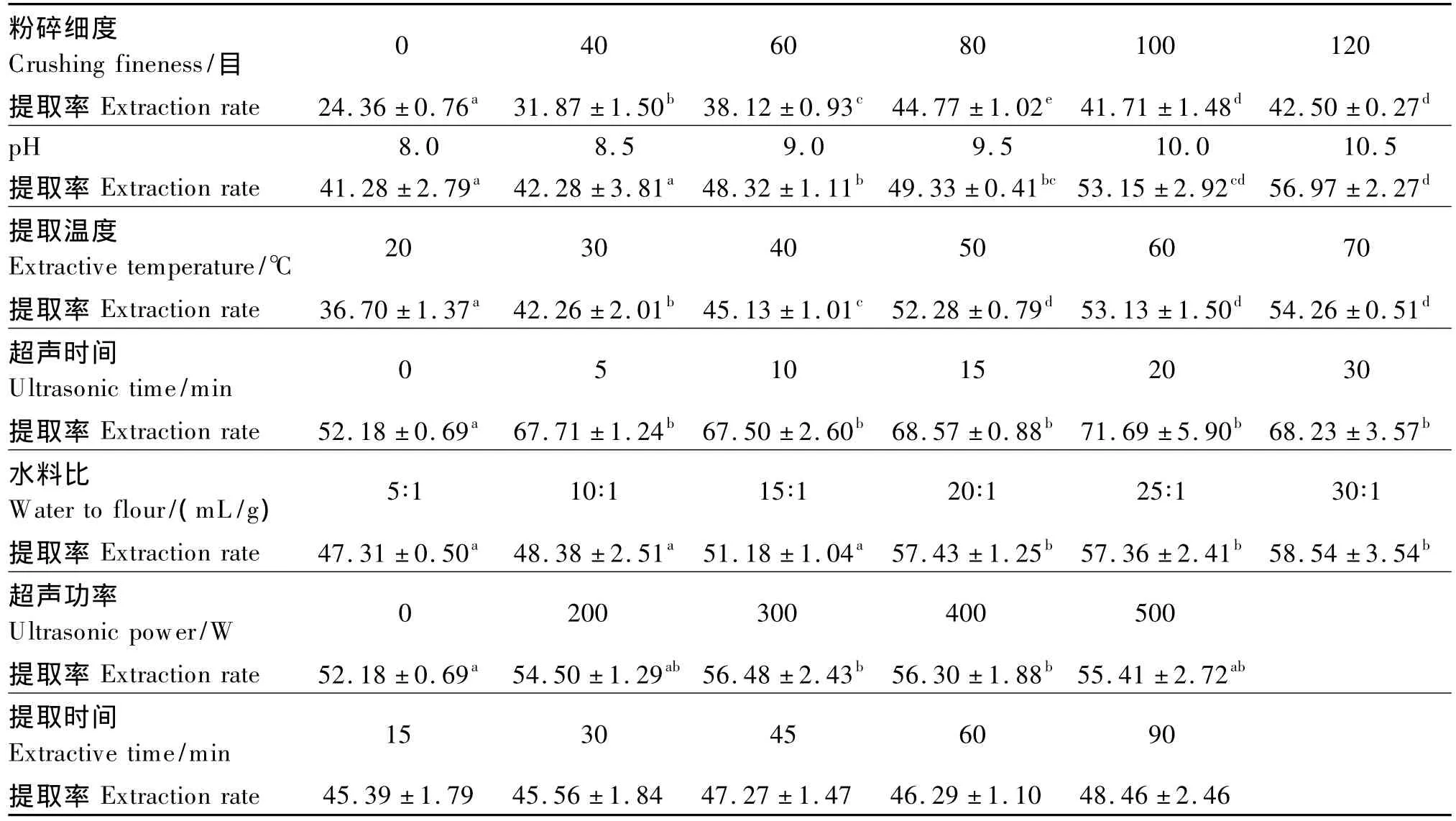
表2 单因素提取条件对蛋白提取率的影响Table 2 Effects of single factor extraction condition on protein extraction rate %
2.2 正交试验
通过SPSS 16.0软件对正交试验结果进行方差分析,输出的数据较多,从中节选部分列出。由表3可以看出,在本试验选择的7个因素中,超声功率和提取时间对高温脱脂豆粕蛋白提取率的影响显著,其他因素影响不显著(P>0.05);各因素影响依次是:提取时间>超声功率>水料比>超声时间>粉碎细度>提取温度>pH。
以大写字母分别代表下列各因素:提取温度(A)、超声时间(B)、pH(C)、粉碎细度(D)、水料比(E)、超声功率(F)、提取时间(G),综合表4和表5可以看出:A3平均值(45.144)最大,A3>A2> A1,但 A1、A2、A3之 间差异不显 著(P >0.05);同理,可以通过另外几张表格的分析得出:B2平均值(45.631)最大,B2> B3> B1,但 B1、B2、B3之间差异不显著(P>0.05);C2平均值(44.706)最大,C2> C3> C1,但 C1、C2、C3之间差异不显著(P>0.05);D3平均值(45.690)最大,D3>D2> D1,但 D1、D2、D3之间差异不显著(P >0.05);E3平均值(46.201)最大,E3>E2>E1,但E1、E2、E3之间差异不显著(P >0.05);F3平均值(48.173)最大,F3>F1>F2,且 F1与 F2之间差异不显著(P>0.05),F3与 F2、F1之间差异显著(P<0.05);G2平均值(47.415)最大,G2>G3>G1,且 G1与 G2、G3之间差异显著(P <0.05),但G2与G3之间差异不显著(P>0.05)。
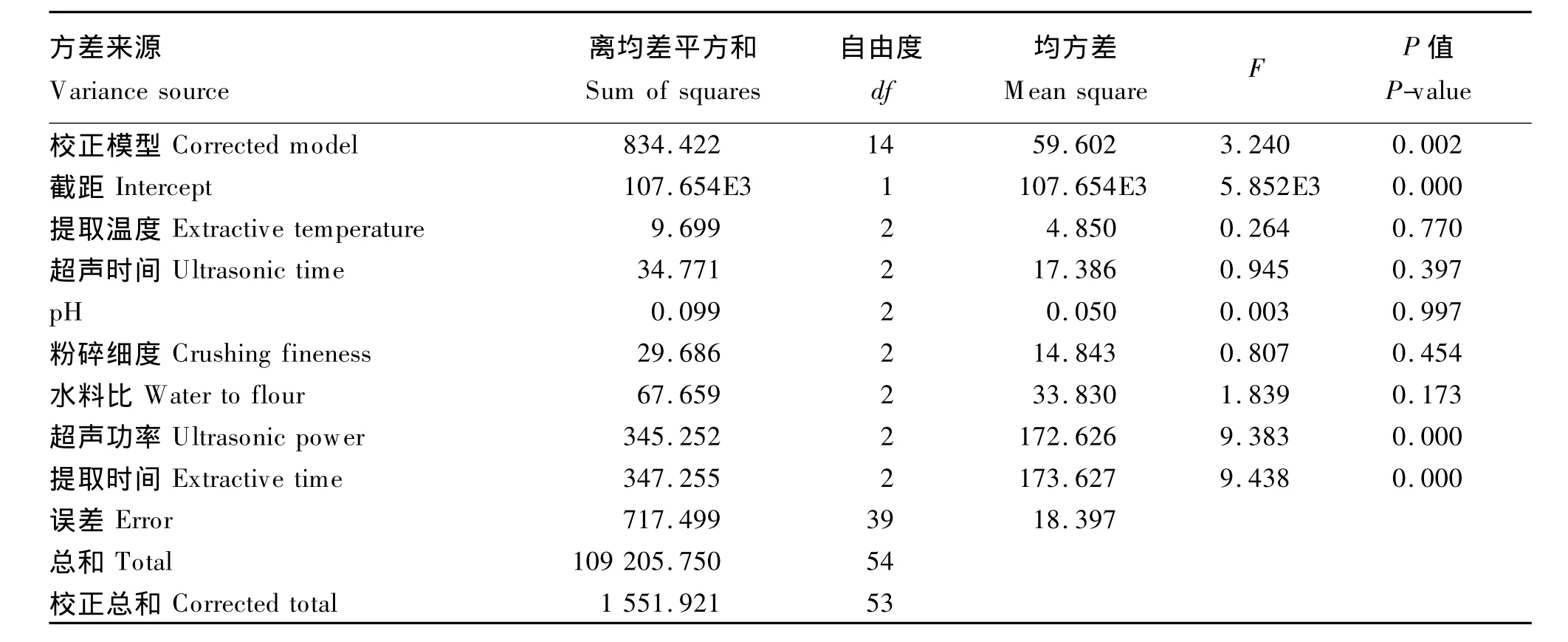
表3 正交试验方差分析表(因变量∶提取率)Table 3 The analysis of variance table of orthogonal experiment(dependent variable∶extractive rate)

表4 单因素统计量表(提取温度∶提取率)Table 4 The statistics table of single factor(extractive temperature∶extractive rate)

表5 配对比较表(因变量∶提取率)Table 5 Pair-wise comparisons table(dependent variable∶extractive rate)
3 讨论
3.1 单因素提取条件对蛋白提取率的影响
3.1.1 粉碎细度对大豆蛋白提取率的影响
李宝山等[9]试验表明,60和80目高温脱脂豆粕的蛋白提取率分别是39.82%和44.95%。一般来说,豆粕粉碎越细,其细胞壁被破坏越严重,且相同质量豆粕的表面积越大,从而与提取溶剂接触的面积也就越大,越有利于蛋白的提取;但粉碎过细会增加过滤和浆渣分离的难度,反而影响蛋白得率。本试验结果表明,粉碎细度为80目组的高温脱脂豆粕的蛋白提取率最高,分别比0、40、60目组提高了83.81%、40.46%和17.43%;但超过80目后的提取率却有所降低。
3.1.2 水料比对大豆蛋白提取率的影响
水料比是影响大豆蛋白提取率的另一重要因素。郑田要等[10]通过试验发现,料水比为1∶30(g/mL)、pH为10.0、热水处理时间20 min时的高温豆粕蛋白溶出率可达59.03%。一般来说,加水量过少,碱提液浓度高,体系黏度大,蛋白不易溶出;但随着加水量的增加,蛋白溶出率却会趋于平衡。本试验结果也证实了这一点。
3.1.3 pH对大豆蛋白提取率的影响
碱液可使豆粕紧密结构变得疏松,促进结合物与蛋白分离,提高蛋白提取率,因此,理论上讲,在一定碱性范围内,pH越高,蛋白溶出率越高;但碱性过强会引起蛋白质极端变性,产生有毒物质,且部分蛋白质会发生水解,生成低分子量、低密度产品,以乳清形式流失,反而使蛋白得率下降。因此,综合考虑豆粕大豆蛋白质的提取率和提取蛋白的质量,本试验将pH设定在8.0~10.5之间,并证实了pH为10.5时,蛋白提取率最高,高达56.97%,是pH为8.0时的1.38倍。这与郑田要等[10]的试验结果相似。
3.1.4 提取温度和时间对大豆蛋白提取率的影响
车康等[11]通过试验发现,在55~75℃提取温度内,65℃时的高温豆粕蛋白提取率最高。本试验结果也表明,提取温度50℃时的蛋白提取率在20~70℃内最高。究其原因可能是:当提取温度较低时,增加提取温度可以促进分子运动,从而有助于蛋白的浸出;但当溶出率达到最大值后,继续提高提取温度一方面可能增加了水分蒸发,致使水料比下降,另一方面可能是提取温度过高时蛋白质热变性程度增加,引起蛋白质聚集,从而使蛋白质的溶解度下降,最终从而导致大豆蛋白提取率下降。
大豆蛋白要从高温豆粕中溶出,需要与溶剂进行充分的接触,因此,在一定时间范围内,浸提时间越长,越利于豆粕蛋白的浸出,但超过一定时间后,随着时间的延长蛋白溶出率趋于平衡,提取率就不再增加。本试验结果表明,碱提时间为45 min时的蛋白提取率最高。这与车康等[11]的试验结果一致。
3.1.5 超声时间和功率对大豆蛋白提取率的影响
超声波因具有成本低、设备简单、操作容易、提取率高等优点而被广泛应用于目的物质的强化提取。李宝山等[6]将高温粕分别进行了先粉碎后超声、先超声后粉碎和直接粉碎处理后提取大豆蛋白,结果表明,其大豆蛋白提取率分别为55.21%、53.46%和36.21%。杨晓泉等[7]研究发现用300 W、12 Hz低频超声处理8 min,高温脱脂豆粕的蛋白浸出率为73.43%,而45℃加热搅拌提取1 h,高温脱脂豆粕的蛋白浸出率仅为49.58%。本试验发现,0~500 W内的超声功率,300 W超声处理的大豆蛋白提取率最高;超声时间为0~30 min时,20 min超声处理的大豆蛋白提取率最高。这可能与其能促使溶剂更大程度的渗入细胞中,从而提高物质传递及破裂细胞壁便于目的物质释放等有关[12]。
3.2 筛选最佳提取条件
蛋白质在用碱处理或加热时会生成赖丙氨酸[13],而试验表明赖丙氨酸可使大鼠肾脏产生病变(肥大),肾小管细胞质、细胞核增大[14],且细胞癌变前期也是细胞质及细胞核的肥大[15]。因此,为避免高温、高pH致使大豆蛋白提取过程中有毒物质赖丙氨酸的生成,同时考虑较高提取率的获得,在前面单因素试验基础上,我们将正交试验中的提取温度设为40、45、50℃ 3个水平,pH设为9.0、9.5、10.0 3个水平。这可能是本试验蛋白提取率低于车康等[11]超声波法及郑田要等[10]热压法提取率的原因之一;而高温豆粕加工工艺不同,受热变性程度不同,提取率也就必然会存在差异,这可能是本试验中提取率较低的原因之二。
正交试验的直观分析法存在一定的局限性,不能估计试验过程及试验结果测定中必然存在的误差,因而不能区分某因素各水平所对应的试验结果的差异究竟是由于水平的改变所引起的,还是由试验误差所引起的。因此,我们通过SPSS 16.0软件对正交试验结果进行了方差分析,并得出结果:超声功率和提取时间对高温脱脂豆粕蛋白提取率的影响极为显著,其他因素影响不显著。各因素影响大小顺序依次是:提取时间>超声功率>水料比>超声时间>粉碎细度>提取温度>pH。
4 结论
①在一定范围内,高温脱脂豆粕的蛋白提取率随着各因素设置水平的提高而提高。
②各因素对大豆蛋白提取率影响依次是:提取时间>超声功率>水料比>超声时间>粉碎细度>提取温度>pH。
③从节约、提高蛋白提取率及尽可能减少或避免有毒物质生成等角度出发,高温脱脂豆粕蛋白提取的最优条件组合为:提取时间45 min,超声功率 500 W,水料比 25∶1(mL/g),超声时间15 min,粉碎细度60目,提取温度45℃,pH 9.0。
[1]陈姿含,管骁,李景军.响应面法优化低温豆粕大豆分离蛋白提取工艺[J].生物加工过程,2012,10(3):39-44.
[2]钟瑜,周欢,陈礼刚.大豆蛋白提取工艺初探[J].轻工科技,2012(5):4-7.
[3]张杰,王振斌,王世清,等.超声辅助碱提大豆蛋白工艺研究[J].大豆科学,2010,29(3):498-501.
[4]刘玉兰,汪学德,丁莉.利用高温豆粕生产醇洗大豆浓缩蛋白的研究[J].中国油脂,2007,32(11):36-39.
[5]刘芳,王遂.酶法提取变性脱脂豆粕中蛋白质的研究[J].食品科学,2004,25(3):89-92.
[6]李宝山,王际英,张利民,等.超声波对大豆分离蛋白提取率及性质的影响[J].饲料研究,2008(5):1-3.
[7]杨晓泉,熊犍,陈中,等.低频超声对豆粕蛋白浸出率及SPI功能特性的影响[J].华南理工大学学报:自然科学版,2003,31(11):30-32,36.
[8]张丽英.饲料分析及饲料质量检测技术[M].北京:中国农业出版社,2002.
[9]李宝山,王际英,张利民,等.不同处理对大豆浓缩蛋白(SPC)粗蛋白含量及提取率的影响[J].饲料与畜牧,2009(3):25-27.
[10]郑田要,杨晓泉.热压法提取高温大豆粕中的大豆蛋白[J].食品与发酵工业,2009,35(8):175-178.
[11]车康,谢微,汪春,等.利用高温脱脂豆粕制备脱脂豆浆工艺的研究[J].食品工业科技,2012,33(17):204-207.
[12]韩国军,孙艳娟,韩丽娟.超声波对豆粕的影响[J].长春师范学院学报,2002,21(2):55-56.
[13]PIVA G,MOSCHINI M,FIORENTINI L,et al.Effect of temperature,pressure and alkaline treatments on meat meal quality[J].Animal Feed Science and Technology,2001,89(1/2):59-68.
[14]WOODARD J C,SHORT D D.Renal toxicity of nε-(DL-2-amino-2-carboxyethyl)-L-lysine (lysinoalanine)in rats[J].Food and Cosmetics Toxicology,1977,15(2):117-119.
[15]MARMOT M,ATINMO T,BYERS T,et al.Food,nutrition,physical activity,and the prevention of cancer:a global perspective[R].Washington,D.C.:World Cancer Research Fund and American Institute for Cancer Research,2007.

