芒果皮提取物合成纳米银及抑菌性研究
杨宁,郝林,杨鹏
(山西农业大学 食品科学与工程学院,山西 太谷030801)
纳米银是将粒径做到纳米级的金属银单质。纳米银的合成包括物理方法、化学方法和生物学方法[1~3]。利用物理方法制备的纳米银纯度高、活性高,但是产物粒度分布比较宽,容易发生团聚。利用化学方法制备的纳米银具有较好的分散性,粒径分布窄,形貌比较均匀,但是材料表面往往有杂质。化学还原法通常涉及外部还原剂和有机溶剂。已报道的纳米银的合成方法中,使用较多的还原剂有肼、硼氢化钠、二甲基甲酰胺等,使用的溶剂大部分为有机溶剂,这些化合物毒性强,污染严重,对环境和生物会产生潜在的危害。而生物制备纳米银的方法所选原料为纯天然,制备方法简单,无污染。生物合成法采用的原料有微生物、酶和一些植物等。与微生物和酶相比,利用植物合成纳米银的方法省去了培养细胞的环节,制备过程相对简单,更适合于大规模的纳米金属粒子的合成。已经发现的可合成纳米银的植物有樟脑树叶[4]、天竺葵[5]、银杏树叶和木兰[6]等。
芒果是漆树科(Anacardiaceae)芒果属(Mangifera L.)的一种热带常青树产果实,其外形和果皮颜色多样,肉质细嫩、香甜、有特殊风味,集热带水果精华于一身,被誉为“热带水果之王”,是热带、亚热带地区的重要经济作物,是世界第二大热带水果。芒果除鲜食外,主要被加工成芒果饮料、芒果干、芒果罐头、果冻等。据估计,芒果皮占鲜果重的7%~24%,芒果皮作为芒果工业化加工生产中产生的加工副产物,一般被抛弃,既造成资源的巨大浪费,又污染环境。据研究,芒果皮中含有大量黄酮化合物、多酚化合物和多糖,都是很好的还原剂。实验研究了以食品工业下脚料芒果皮作为还原剂和分散剂,合成分散性很好的纳米银,探讨了制备过程中影响纳米粒径的因素,并用透射电镜观察纳米粒子的形貌。这些合成的纳米粒子可以用于水体、土壤污染的治理,食品行业抑菌材料等等。这对提高芒果的附加值和利用率,避免资源浪费和环境污染,具有十分重要的意义。
1 材料与方法
1.1 材料
1.1.1 材料
芒果皮(市售),硝酸银(分析纯,购自天津试剂一厂)
1.1.2 菌种
菌种:大肠杆菌 (Escherichia coli),葡萄球菌(Staphylococcus aureus)和枯草芽孢杆菌(Bacillus substilus)均为微生物实验室保藏。
1.1.3 主要仪器设备
高速电动离心机,常州市华普达教学仪器有限公司
紫外可见分光光度计,日本岛津 UV-visible2400系列
透射电镜,Jeol JEM100SX
X射线衍射仪(XRD),德国布鲁克(D8ADVANCE)
1.2 方法
1.2.1 芒果皮提取物的制备
新鲜芒果皮用双蒸水清洗后,称取100g,添加250mL双蒸水,榨成汁。4℃保存备用。
1.2.2 pH值对纳米银合成的影响
将3mL芒果皮提取物与27mL 1mM的硝酸银溶液混合。80℃水浴15min。分别调节硝酸银溶液的pH 值为2.0,3.0,5.0,7.0,9.0,11.0。
1.2.3 芒果皮提取物不同添加量对纳米银合成的影响
分别取芒果皮提取物0.1mL,0.4mL,0.7 mL,1mL和3mL,加1mM的硝酸银溶液定容至30mL。pH值选取上一步得出的纳米银粒径最小时的pH值。
1.2.4 不同硝酸银浓度对纳米银合成的影响
配置浓度为0.5,1.0,2.0和4.0mM 的硝酸银溶液。分别取其与芒果皮提取物混合。芒果皮的添加量和pH值选取上步得出的纳米银粒径最小时的芒果皮添加量和pH值。
1.2.5 检测
将1.2.2、1.2.3、1.2.4的试样,用紫外可见分光光度计检测是否有合成纳米银。用透射电镜(TEM)观察合成纳米银的粒径。用X射线衍射仪(XRD)对合成的纳米银进行表征。
1.2.6 抑菌试验
选取3种代表性菌种:大肠杆菌 (Escherichia coli)(革兰氏阴性菌),葡萄球菌(Staphylococcus aureus)(革兰氏阳性菌)和枯草芽孢杆菌(Bacillus substilus)(芽孢菌),采用牛津杯法进行抑菌试验。用牛肉膏蛋白胨培养基将供试菌种分别接种到装有培养基的试管内,在37℃培养24h,进行扩大培养。取活化好的菌种斜面,用生理盐水配制成每毫升含106~107CFU的菌悬液,备用。将已灭菌的肉汤培养基加热到完全融化,倒在培养皿内,每皿约20mL,凝固。用生理盐水洗下试管内的菌苔并稀释。吸取1mL菌液倒入平板表面,用涂布器将菌液涂布均匀。放置牛津杯,加入合成的纳米银溶液。放入37℃培养箱中培养24h,用游标卡尺测量抑菌圈直径。用芒果皮提取液作对照。操作同上。
2 结果与分析
2.1 pH值对纳米银合成的影响
在利用芒果皮提取物合成纳米银的过程中,pH值是一个重要的影响因素。文献表明[7,8],纳米银在400~440nm之间有吸收峰。通过紫外-可见分光光度法对反应后的溶液进行检测,检测到溶液pH 2.0时没有吸收峰,当溶液pH 为3.0,5.0,7.0,9.0和11.0时,吸收峰的位置分别在434.0,426.5,422.5,418.5和412.0nm 处。如图1可见,随着pH值的升高,吸收峰变得尖而窄。这是由于合成纳米银的粒径和数量发生了变化。
采用透射电镜(TEM)表征溶液pH值分别为3.0和11.0下合成的纳米银。如图2所示,所有合成的纳米银粒子为近似球形。在高pH值下,纳米银粒子的形态更规则,更分散不容易团聚。合成的纳米银粒子在pH 3.0和11.0下的粒径分别为27(±22%)nm和15(±28%)nm。这可能是由于随着反应溶液pH值的升高,参与还原反应的官能团的去质子化的能力增强。去质子化的官能团可以携带更多的负电荷,而这些负电荷可以把Ag+还原为单质Ag。另外,纳米银颗粒在高pH值条件下更稳定是由于静电排斥作用,这种作用可以使纳米银颗粒更分散不易团聚[9]。这与紫外可见吸收光谱是一致的,即随着pH值的增加,吸收峰出现了蓝移。

图1 不同pH值条件下合成纳米银的紫外可见吸收光谱图Fig.1 A UV-vis spectra of the silver nanoparticles synthesized at different pH values

图2 在pH3.0和pH11.0条件下合成纳米银的TEM照片Fig.2 TEM images of the silver nanoparticles prepared at pH 3.0and 11.0
在溶液pH 2的条件下没有纳米银合成,可能是因为在这样的强酸条件下,抑制了芒果皮提取物中还原基团的活性。所以,pH值为11.0时,合成的纳米银形态最稳定,粒径最小。
2.2 芒果皮提取物不同添加量对纳米银合成的影响
芒果皮不同添加量对纳米银合成的影响如图3。不同添加量下的吸收峰值见表1。

表1 芒果皮提取物不同添加量下的吸收峰值Table 1 Effects of the content of mango peel extract on the peak absorbance
随着芒果皮提取物的添加量从0.1mL增加到3.0mL,紫外可见吸收峰值向长波长迁移,且峰变宽。这表明纳米银颗粒粒径变大。通过TEM显微照片(图4)观察纳米银颗粒为近似球形,其粒径介于9nm(±24%)(0.1mL提取物)到15nm(±28%)(3.0mL提取物)之间。而相对应的紫外可见吸收光谱的吸收峰值介于400nm到412nm之间。也就是说吸收峰的位置随粒径的增大而向长波移动。这种红移现象与纳米银和其周围介质的介电常数的差值E有关,|E|越大,红移越大。对于球形纳米银粒子,可以用球形势阱模型从理论上解释,由相邻能级间隔公式△E=-h2(X2n,1)/2μa2(a为球形纳米银粒子的半径),可知能量差与粒子的半径平方成反比,说明粒子的半径越大,能级间隔越小,其对应的吸收峰中心波长越长。[10]

图3 芒果皮提取物不同添加量下合成的纳米银的紫外可见吸收光谱图Fig.3 A UV-vis spectra of the silver nanoparticles synthesized at different mango peel extract content(mL)

图4 芒果皮提取物添加量分别为0.1mL和3.0mL时合成的纳米银的TEM照片Fig.4 TEM images of the silver nanoparticles prepared at mango peel extract content of 0.1mL and 3.0mL
Song和Kim[6]在研究木兰叶提取物合成纳米银时,也得到相似的结论,即纳米银的粒径随着提取物添加量的增加而变大。这种现象可能是因为较多的还原基团聚集在形成的原子核表面,这使得银原子核表面的银离子继续被还原,纳米银的合成率增加,导致纳米银形成大粒径粒子。另一方面,太多的还原物质可以加强形成纳米粒子间的桥联效应,这导致了纳米粒子的团聚。所以,为合成小粒径的纳米银,应选取最低芒果皮提取物添加量(0.1mL)。这证明芒果皮提取物的添加量也是决定纳米粒子合成及合成粒径的一个重要因素。
2.3 不同硝酸银浓度对纳米银合成的影响
由图5可见,随着纳米银浓度从0.5mM增到4.0mM,吸收峰增高并且向长波长移动(表2)。

表2 不同硝酸银浓度下的吸收峰值Table 2 Effects of silver nitrate concentration on the peak absorbance
硝酸银浓度分别为0.5mM和4mM时合成的纳米银的TEM照片显示(图6),纳米银的粒径介于7nm(±23%)(0.5mM)和21nm(±17%)(4.0mM)之间。这可能是因为太多的纳米银离子会富集在合成的原子核表面,在其表面又发生二次还原反应,合成新的原子核,从而导致了大粒径纳米粒子的形成。所以,为了合成小粒径的纳米银,需选取最适硝酸银溶液浓度为0.5mM。

图5 不同硝酸银浓度下合成的纳米银的紫外可见吸收光谱图Fig.5 A UV-vis spectra of the silver nanoparticles synthesized at different silver nitrate concentration

图6 硝酸银浓度分别为0.5mM and 4mM时合成的纳米银的TEM照片Fig.6 TEM images of the silver nanoparticles prepared at silver nitrate concentration of 0.5mM and 4mM
2.4 纳米粒子稳定性测定
配置浓度为0.5mM的硝酸银溶液。取29.9 mL与芒果皮提取物0.1mL混合,反应温度为80℃,时间为15min,pH 11.0。反应生成纳米银后静置3个月,期间连续观察合成的纳米银粒子的紫外可见吸收峰,发现其吸收峰值均在402nm处,期间无明显变化。说明合成的纳米银粒子具有很好的稳定性。
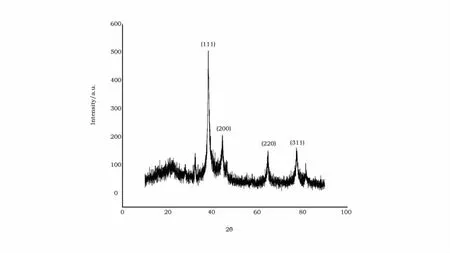
图7 纳米银的X-射线图谱Fig.7 XRD pattern of silver nanoparticles
2.5 纳米银的XRD表征
表征得到的纳米银的X射线衍射(XRD)图谱峰位置与JCPDS卡上数据一致(JCPDS NO14-0781),特征值见图7。图中出现4个明显的峰值,说明纳米银晶体有4个晶面,衍射图谱由4个不同半径的同心圆环组成,对应的晶面指数由里到外依次为(111)、(200)、(220)、(311)。经比较 X射线衍射图谱与Satishkumar和Bar[11,12]的研究一致。
2.6 纳米银的抑菌性
抑菌试验测得的抑菌圈直径如表3所示,对照为芒果皮提取物,如表可见对照没有抑菌性,而合成的纳米银溶液有明显的抑菌圈,这说明抑菌性来自于合成的纳米银溶液。由表可见大肠杆菌、葡萄球菌及枯草芽孢杆菌的抑菌圈直径分别为13.0 mm,14.5mm,11.0mm,这是因为每种菌对纳米粒子的感受性不同。就纳米银的抗菌机制而言主要有两种:一种是接触反应,纳米银颗粒直接进入菌体与氧代谢酶结合使菌体窒息而死。另一种是光催化反应,在光的作用下,银能起到催化活性中心的作用,激活水和空气中的氧,产生羟基自由基和活性氧离子,活性氧离子具有很强的氧化能力,能在短时间内破坏细菌的增殖能力而使细胞死亡[13]。

表3 纳米银的抑菌圈直径Table 3 The results of antibacterial activity with zone of inhibition
3 结论与讨论
采用芒果皮可以快速合成球形纳米银粒子。pH值、芒果皮提取物的添加量及硝酸银溶液的浓度均是影响纳米银粒径的重要因素。研究表明,pH值为11,芒果皮提取物的添加量为0.1mL,硝酸银溶液浓度为0.5mM,反应条件为80℃,水浴15min时,经紫外可见分光光度法和TEM表征合成的纳米银的粒径最小,为7nm(±23%)。稳定性研究表明,生物法合成的纳米银粒子三个月内均稳定。XRD表征图谱与已报道的纳米银图谱一致。
本实验用生物法合成的纳米银具有良好的抑菌性。纳米银是一种广谱、高效的抑菌剂,在食品行业中有较为广泛的应用前景,而生物法合成的纳米银清洁、无毒、环境友好、可持续发展,并且反应条件温和是值得扩大使用的抗菌产品。但是,纳米银的抑菌效果还受到食品组分、介质等其他因素的影响,因此需要进一步将其应用到食品中试验其抑菌性能。
[1]Kannadhasan M,Sankar babu V R,Naresh R,et al.A sunlight-induced rapid synthesis of silver nanoparticles using sodium salt of N-cholyl amino acids and its antimicrobial applications[J].Colloids and Surfaces.B,Biointerfaces,2012,96:14-21.
[2]Abbasi A R,Kalantary H,Yousefi M,et al.Synthesis and Characterization of Ag Nanoparticles Polyethylene fibers under Ultrasound irradiation[J].Ultrasonics Sonochemistry,2012,19:853-857.
[3]Vijayaraghavan K ,Nalini S P K,Prakash N U,et al.Biomimetic synthesis of silver nanoparticles by aqueous extract of Syzygium aromaticum[J].Materials Letters,2012,75:33-35.
[4]Huang Jiale,Li Qingbiao,Sun Daohua.Biosynthesis of silver and gold nanoparticles by novel sundriedcinnamomum camphoraleaf[J].Nano Technology,2007,18(10):105104-105111.
[5]Shankar S,Ahmad Absar,Sastry M.Geranium leaf assisted biosynthesis of silver nanoparticles[J].Biotechnology Progress,2003,19(6):1627-163.
[6]Song Jae Yong,Kim Bom soo.Rapid biological synthesis of silver nanoparticles using plant leaf extracts[J].Bioprocess Biosyst Eng,2009,32(1):79-84.
[7]Pastoriza-Santos I,Liz-Marzain L M.Formation and stabilization of silver nanoparticles through reduction by N,N-dimethylformamide[J].Langmuir,1999,15:948-951.
[8]Pastoriza-Santos I,Liz-Marzan L M.Synthesis of silver nanoprisms in DMF[J].Nano Letters,2002,2:903-905.
[9]Sadowski Z,Maliszewska I H,Grochowalska B,et al.Synthesis of silver nanoparticles using microorganisms[J].Materials Science-Poland,2008,26(2):419-424.
[10]熊金钰,徐国财.纳米银的制备及表征[J].金属功能材料,2004(2):38-42.
[11]Satish Kumar M,Sneha K Won S W,et al.Cinnamon zeylanicum bark extract and powder mediated green synthesis of nano-crystalline silver particles and its antibacterial activity[J].Colloids Surf B:Biointerface,2009,73:332-338.
[12]Bar H,Bhui D K,Sahoo G P,et al,Green syntheis of silver nanoparticles using seed extract of Jatropha curcas[J].Colloids Surf.A:Physicochem.Eng.Aspects,2009,348:212-216.
[13]刘吉平,郝向阳.纳米科学与技术[M].北京:科学出版社,2002:67-69.

