2人30天受控生态生保系统物质流调控技术研究
郭双生,董文平,艾为党,冯红旗,唐永康,黄志德,沈韫赜,任 锦,秦利锋,曾 固,张立红
(1.中国航天员科研训练中心人因工程重点实验室,北京100094;2中国航天员科研训练中心,北京100094;3.西北工业大学生命学院,西安710072)
1 引言
长时间、远距离和多乘员的载人飞行任务,必须依靠受控生态生保系统(controlled ecological life support system,CELSS)。CELSS的主要特点是可实现系统中物质的完全闭合循环。20世纪50年代载人航天未开启之前,美俄等国就开始了受控生态生保技术研究。俄罗斯70~80年代相继开展了2~3人、120~180 d受控生态生保集成技术试验,实现了物质较高程度的闭合循环。90年代后期,NASA约翰逊航天中心组织实施高级生保系统计划(Advanced Life Support Project,ALS),建成了大型整合生保系统实验装置(Integrating Life Support System Test Facility,ILSSTF),在其中进行了4人90 d生物与物化相结合的集成技术试验研究,证明种植面积为10 m2的小麦能够保障一个人的呼吸用O2需求,并能满足1/4人的食品需求(小麦制成面包);生物不可食生物量(包括干枯的根、茎、叶等)的80%通过微生物反应器技术转化成植物营养液而被植物再利用[1-6]。
我国开展受控生态生保技术研究已有近20年的历史,在植物培育和废物循环利用等关键技术领域取得重要突破。利用受控生态系统集成实验平台,开展了2人30天受控生态生保系统集成技术试验研究,重点探究密闭系统中人与植物间大气和水的交换特性及其动态平衡调控技术和机制,从而为下一步设计乘员更多、时间更长和闭合程度更高的大型受控生态生保整合试验奠定基础。
2 方法
2.1 乘员组成及其基础代谢量测试
本次试验共有两名乘员参加,基本情况如下:乘员01号,男,38岁,身高170 cm,体重72 kg,博士学历,环控生保专业;乘员02号,男,32岁,身高173 cm,体重62.5 kg,硕士学历,医学专业。两名乘员身体健康,无心脑血管疾病、运动系统疾病,无不良嗜好,心理相容性好。
在前期乘员代谢测试中,对两名乘员每人每天的O2吸收量及CO2呼出量进行了测定。测定方法为:该实验的边界设定条件与正式进人实验的完全相同;在为期3 d的基础代谢测试试验中,乘员按照正式实验的作息制度模拟操作步骤,记录每天始末的舱内O2和CO2浓度,并根据每天的浓度差计算每人每天吸收O2及呼出CO2的平均值。计算公式为:
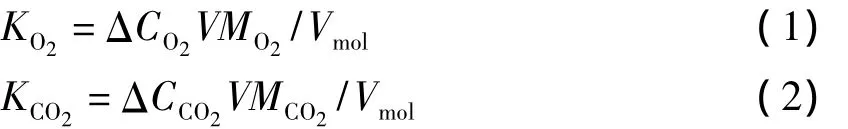
式中:KO2为每人每天消耗的O2量,g;KCO2为每人每天呼出的CO2质量,g;ΔCO2为测试期间24 h O2浓度始末差值,%;ΔCCO2为测试期间24 h CO2浓度始末差值,%;V为试验舱容积,301m3;MO2为O2分子量,32 g/mol;MCO2为 CO2分子量,44 g/mol;Vmol为舱内气体摩尔体积,24.5 L/mol。
2.2 实验设备
参试设备为中国航天员中心研制的CELSS集成实验平台。该平台主要包括植物舱、乘员舱、温湿度与通风控制等12个分系统。该平台总容积308 m3;植物舱容积为224 m3(长8 m×宽8 m×高3.5 m),主要用于培养4类植物;乘员舱容积为84 m3(长8 m×宽3 m×高3.5 m),主要是乘员生活、工作和进行相关科学试验研究的场所。平台如图1所示。
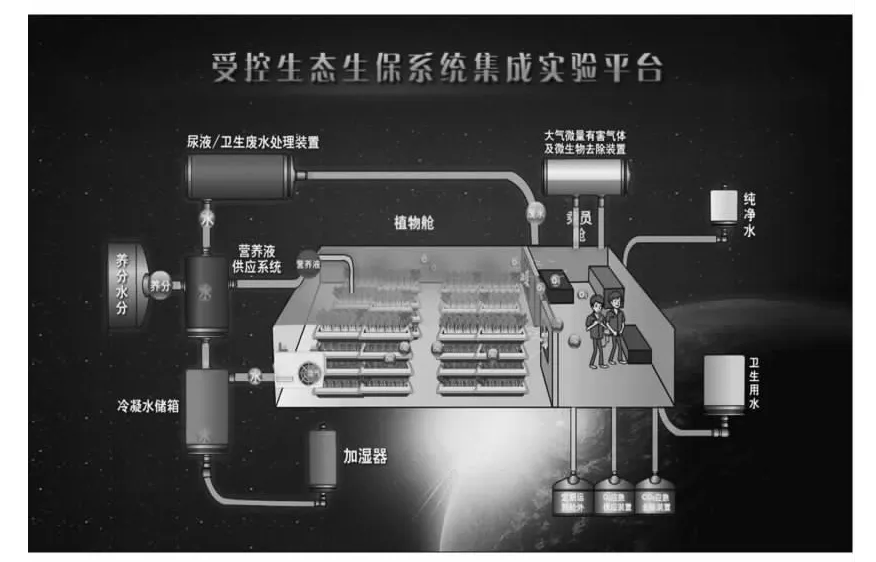
图1 受控生态生保系统集成实验平台结构示意图Fig.1 Inside structure of the CELSS Integration Experiment Platform
2.3 供试植物
供试植物根据前期植物筛选试验结果[7-9],选择4种色拉型蔬菜,即:生菜(Lactuca sativa L var.Dasusheng)、油麦菜(Lactuca sativa L var.Youmaicai)、苦菊(Cichorium endivia L)和紫背天葵(Gynura bicolor)。
2.4 植物培养与管理
4种植物的培养面积分别是:生菜16.5 m2,油麦菜16.5 m2,苦菊1.5 m2,紫背天葵1.5 m2。植物培养采用液培法,所用营养液为改良Hoagland营养液,电导率控制范围为(2000±50)μS·cm-1,pH值控制范围为6.3±0.15。光源为90%红光+10%蓝光的LED光源,光合有效辐射为500 μmol·m-2·s-1(灯板正下方30 cm 处),24 h光照。营养液注入培养盘内,上覆泡沫板,种子用海绵固定于泡沫板上的小孔内,直接萌发。
植物培养第21 d时,乘员进舱,舱门封闭。之后由舱内乘员及舱外人员共同对植物进行管理与测试。植物的管理测试包括营养液电导率及pH控制、光源控制、植物生长状态观察、光合速率测定、荧光动力学测定等。试验期间,每3 d进行一次光合速率和荧光动力学测试。第40 d时对植物采样进行一次营养品质测试。植物培养第51 d,乘员出舱后进行样品采收[10-12]。
2.5 大气环境控制及泄漏率测试
2.5.1 大气环境参数控制
试验过程中对舱内大气环境进行严格控制,各参数设定值如表1所示。
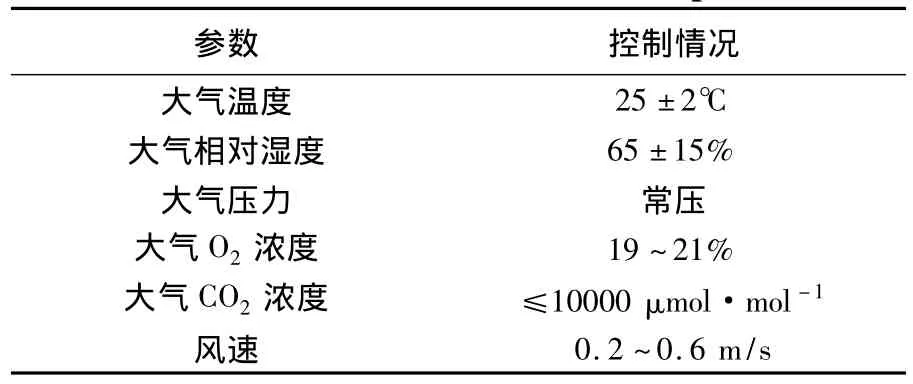
表1 大气环境参数设定值Table 1 Set values of air environment parameters
2.5.2 大气泄漏率测试
试验前期需进行气体泄漏率测试,以掌握平台舱体密闭情况,主要对CO2及O2的泄漏率情况进行测定。
CO2泄漏率测试方法:将舱门关闭,各法兰、接口及传递窗均处于封闭状态,大气温湿度、压力调至试验标准状态,CO2浓度升至 2000 μmol·mo-1,系统自动记录浓度动态变化。24 h后,根据CO2最终浓度计算以上状态下的大气CO2泄漏率。利用同样方法测定 5000 μmol·mol-1、8000 μmol· mol-1和 10000 μmol·mol-1时的大气CO2泄漏率。
O2泄漏率测试方法:与CO2类似,即舱体进入封闭状态后,大气温湿度、压力调至试验状态,利用充氮气的方法将舱内O2浓度降至19%。24 h后,根据O2浓度上升值计算O2泄漏率。
气体泄漏率计算公式为:

式中:ΔC为气体浓度始末差值;C为气体初始浓度;T为时间,单位h;100为百分数转化系数。
2.6 大气和水平衡调控
2.6.1 大气监测与调控
试验期间对大气环境参数进行实时监控。CO2浓度控制范围为 2000 ~10000 μmol·mol-1,若超过上限,CO2应急去除装置自动开启,CO2浓度降至 2000 μmol·mol-1时,去除装置关闭;若CO2浓度在2000 μmol·mol-1以下时乘员与植物之间建立起稳定的大气交换平衡,不人为增加CO2浓度。O2浓度控制范围为19% ~21%,低于下限时,O2应急补充装置自动开启,O2浓度升至21%时,补充装置关闭;若因植物产O2能力强导致O2浓度超过21%时不人为降低O2浓度。
乘员进舱后第24d开始进行植物照光面积与人之间的气体交换调控试验。通过关闭一定面积的灯板来调整植物面积(指进行光合作用的植物面积),考核该面积的植物与乘员之间的代谢平衡情况。若O2浓度持续下降而CO2浓度持续上升,则证明该面积下植物产O2能力低于乘员耗O2量,需增加植物面积;若O2浓度持续上升而CO2浓度持续下降,则证明该面积下植物产O2能力超过乘员耗O2量,需减少植物面积;若CO2浓度和O2浓度达到新的动态平衡,则证明该面积下植物与乘员之间达到大气交换平衡。
2.6.2 水的监测与调控
试验期间对用水量和排水量进行监控,包括乘员饮水量、排尿量、洗漱用水等的计量、舱外收集废水尿液量的计量、尿液净化量与回收量的计量、冷凝水量计量、营养液用水量计量等。乘员生活用水及尿液通过管路于舱外收集,每天通过微生物废水处理装置进行处理,处理后经检测合格后,部分回收进入植物营养液。收集的冷凝水定量进入植物营养液,直接参与水循环。
2.7 食物供应及固体废物收集
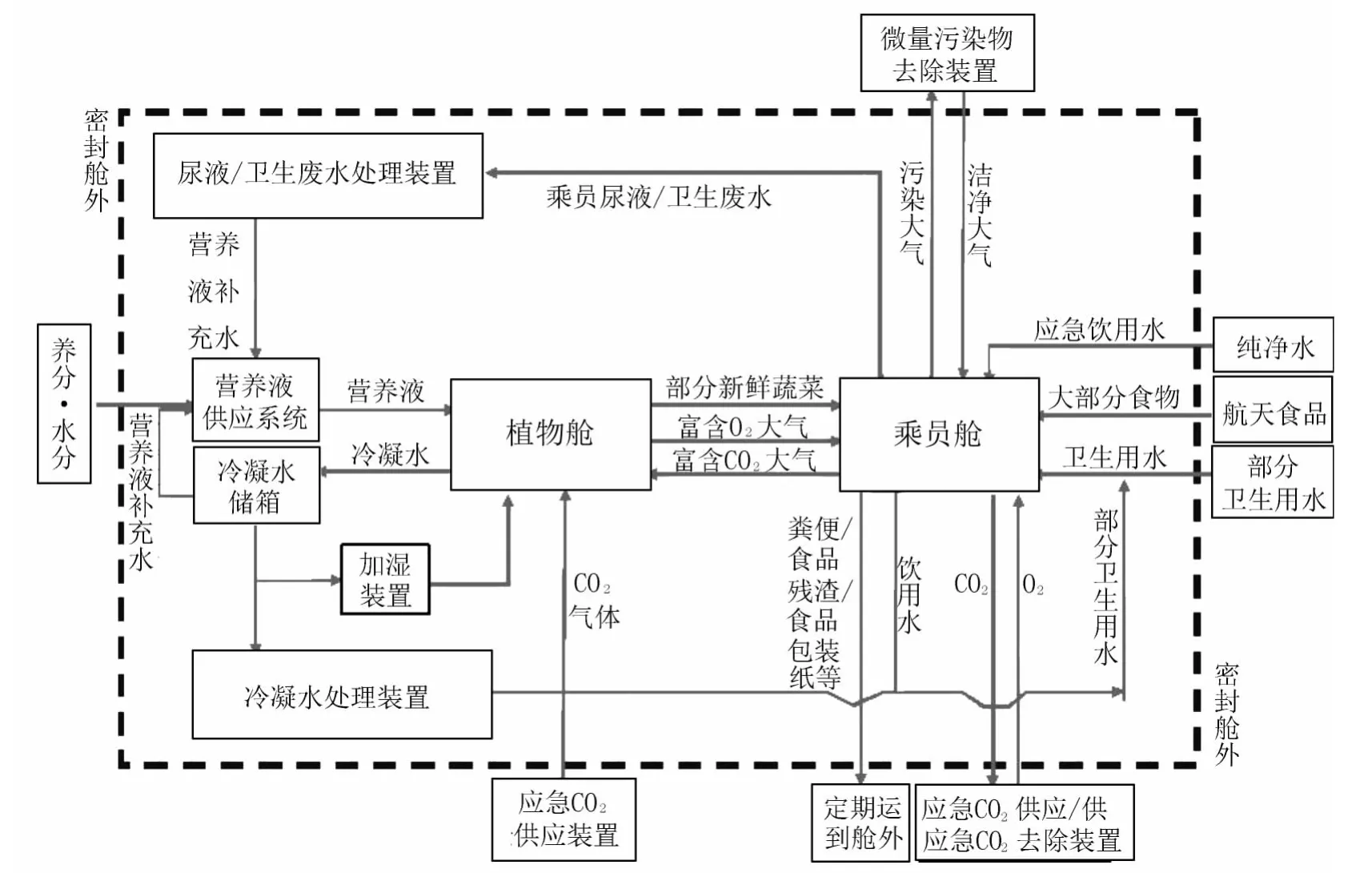
图2 受控生态生保系统2人30天集成试验物质流程总图Fig.2 Material flow of the CELSS system
乘员在舱内以航天食品作为主要食物,以植物舱生产的新鲜蔬菜作为补充。乘员中餐及晚餐分别定量食用两种不同品种的蔬菜。试验期间,对乘员大便及生活垃圾均进行收集和计量,此后进行专门的无害化处理。
2.8 系统整体性能评价
系统试验中物质流程如图2所示。
受控生态生保系统整体性能评价指标主要有大气闭合度、水闭合度、水循环利用率、系统能效比等,用于衡量系统的物质闭合程度、物质再生能力及能源利用效率等。计算公式如下:

3 结果与分析
3.1 乘员基础代谢量测试结果
2人3天的乘员基础代谢量测试结果具体如表2所示。
将表2所示代谢测试数据代入公式1和公式2计算得每人每天消耗的O2为755.0 g,每人每天呼出的CO2为843.0 g。
3.2 大气环境参数控制及泄漏率测试结果
3.2.1 大气泄漏率测试结果
根据泄漏率测试数据,计算得CO2浓度为2000 μmol·mol-1时,CO2泄漏率为 0.004%/h;O2浓度为19%时,O2泄漏率为0.01%/h。实际试验时,CO2浓度低于 2000 μmol·mol-1,O2浓度高于19%,即二者舱内外浓度差小于泄漏率测试的舱内外浓度差,泄漏率应比气体泄漏率测试结果更小。因此,CO2及O2泄漏率对于大气平衡调控的影响可忽略不计。
3.2.2 O2和CO2浓度变化规律
大气温湿度等环境参数控制结果见表3。
试验过程中,舱内CO2和O2浓度随着乘员作息制度出现规律性变化,并处于动态平衡。乘员晚间休息时,CO2浓度下降,O2浓度上升;白天活动时,CO2浓度上升,O2浓度下降。其中,每天下午乘员进行体育锻炼时,CO2浓度达到一天内的最高值,O2浓度达到一天内的最低值,这是由乘员代谢速率变化造成的。24 d后,改变植物照光面积,CO2浓度和O2浓度出现波动,但最终达到新的平衡。CO2浓度与O2浓度变化趋势呈现出良好的对应关系,如图3所示。
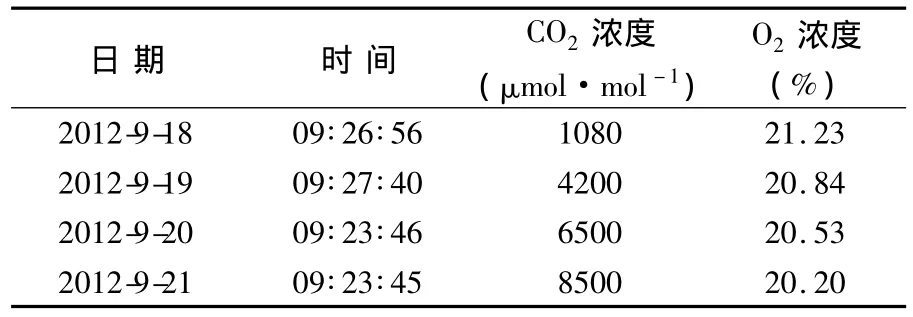
表2 试验期间每天始末O2与CO2浓度Table 2 O2concentration and CO2concentration at the beginning and the end of everyday
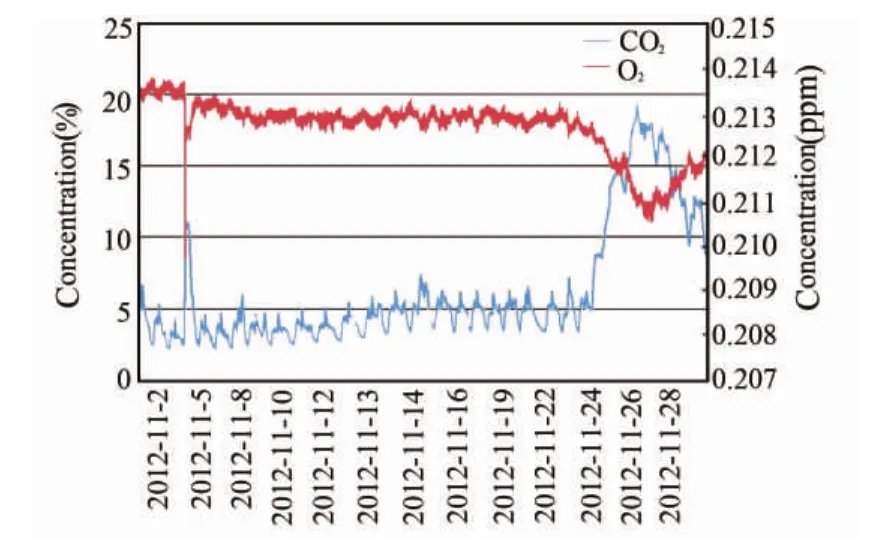
图3 大气CO2浓度与O2变化趋势对比图Fig.3 Comparison between O2and CO2concentration

表3 植物舱大气环境参数控制要求及控制结果Table 3 Set value and real value of air environment parameters
舱内O2浓度与CO2浓度随着乘员作息制度及植物面积调整而迅速达到平衡并呈现规律性变化,且CO2与O2呈现出良好的对应关系,表明该系统具有良好的密闭性和稳定性。
3.2.3 大气微量有害气体监控
乘员代谢试验及正式试验均开启微量有害气体净化装置,并对舱内微量有害气体进行监控。
由于正式试验与乘员代谢试验微量有害气体净化装置均开启,因此微量有害气体浓度差异可认为是植物及封舱时间的影响。其中,2人3天代谢测试中检测出甲苯、己烷、乙酰胺等气体而在正式试验中未检出;正式试验中乙苯、甲醛、氨等气体浓度相对于2人3天代谢测试明显降低,说明植物对这些气体有良好的净化作用。另外,正式试验检出了环戊烷,而在2人3天代谢测试期间中未检出,这可能是由于试验的封舱时间较长导致,其可能的来源为人体或舱内设施;试验中检出植物释放的乙烯,其浓度在不断升高,这对植物有一定促进衰老的作用。
3.3 植物生长状态
试验期间,4种植物生长基本正常,长势良好。生长状态见图4。植物生长第28 d开始,部分叶片叶缘出现枯黄现象。第33 d,通过手动测量营养液电导率,发现其实际值比示数偏高。后降低营养液电导率至控制范围内,叶缘枯黄现象逐渐缓解[13]。苦菊抽薹现象较为明显,叶片长势较弱,但由于苦菊所占比例较小,未对植物产O2能力产生显著影响。
3.4 大气平衡调控
乘员进舱后不久即达到人与植物的气体交换平衡,但CO2浓度始终维持在较低水平(0.028%~0.08%),证明植物的CO2净化能力未充分发挥出来,具有进一步提高的可能。因此从封闭试验第24 d开始进行植物照光面积与气体平衡交换的动态调控试验,具体过程如表4所示。
该试验证明,种植面积为27m2的植物可满足两名乘员的O2需求,并有效净化两名乘员产生的CO2,即每13.5m2栽培面积的植物可以满足1人的气体代谢需求。
根据舱内O2浓度变化及乘员代谢测试结果,计算出植物每天产生O2的能力,由式7计算得。

式中,QO2为每平米植物每天释放的O2量;KO2为每人每天消耗的O2量,755 g;Vmol为舱内气体摩尔体积,24.5 L/mol(25℃条件下);MO2为O2分子量,32;C'O2为第二天9:00的O2浓度;CO2为当天9:00的O2浓度。S为实际光照面积。
根据舱内CO2浓度变化及乘员代谢测试结果,计算出植物每天吸收CO2的能力,由公式8计算得到。


图4 四种植物生长状况(左上:生菜;右上:油麦菜;左下:紫背天葵;右下:苦菊)Fig.4 Plant growing conditions(upper left:Lactuca sativa L var.Dasusheng;upper right:Lactuca sativa L var.Youmaicai;lower left:Gynura bicolor;lower right:Cichorium endivia L)

表4 大气平衡调控试验过程Table 4 The process of gas balance regulation test
式中,PCO2为每平米植物每天吸收的CO2量;KCO2为每人每天呼出的CO2质量,843 g;Vmol为舱内气体摩尔体积,24.5 L/mol;MCO2为 CO2的分子量;C'CO2为第二天9:00的CO2浓度;CCO2为当天9:00的CO2浓度;S为实际光照面积。
植物每天产O2量及吸收CO2量见图5。
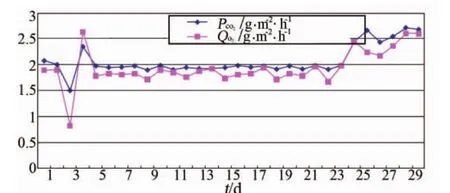
图5 植物产O2量及吸收CO2量曲线Fig.5 Curve of O2generation and CO2consumption
从图5可以看出,大气平衡调控开始后,植物O2生产能力和CO2吸收能力都有明显增强。分析其原因,主要是植物培养面积减少后,CO2浓度上升,O2浓度下降,改变了植物光合作用的化学平衡状态,促使平衡向右进行:CO2+H2O→O2+CH2O。
根据每天的O2产量及CO2净化量,计算得:试验期间植物共净化CO250.4 kg,其中,前24天灯板全开阶段共净化40.3 kg,平均每天净化1.68 kg;后6天大气调控期间共净化10.1 kg,平均每天净化1.68 kg;试验期间植物产生O2共44.7 kg,其中,前24天灯板全开阶段共产生35.8 kg,平均每天产生1.49 kg;后6天大气调控期间共产生8.9 kg,平均每天产生1.50 kg。
大气平衡调控是多个因素共同作用的结果。该试验在前期植物培养试验结果的基础上,对光照强度、营养液电导率以及不同植物面积配比等已做出优化,并有效提高了植物的光合效率以及产O2和净化CO2的能力。在本试验过程中,通过进一步调节植物光照面积及改变蔬菜进食量等措施,形成了一套有效的“人-植物”O2和CO2交换动态平衡调控方法,实现了人与植物之间较高的气体交换能力。
3.5 水循环调控
营养液系统起初共加入5000 L纯净水,整个试验过程中乘员共饮用纯净水105 L,使用卫生用水525 L。试验期间,冷凝水日均收集量为190 L,收集的冷凝水全部进入营养液回收利用。尿液与生活废水日均收集量分别为5.5 L和17.5 L,日均回收量分别为1.2 L和3.3 L。所收集的冷凝水以及处理回收后的尿液与生活废水进入营养液循环利用,分别根据公式4和公式5计算水闭合度和水循环利用率,由此计算出水闭合度达到84.5%。
尿液和生活废水收集后进入微生物废水处理装置进行处理。根据处理后液体的测试结果可知,该装置处理效果良好,TOC、COD、铵态氮、硝态氮、尿素等测试指标见表5。

表5 尿液废水微生物处理结果(mg/L)Table 5 Cleaning results of urine and effluent(mg/L)
3.6 蔬菜供应能力
试验过程中,两名乘员共食用新鲜蔬菜7380 g,平均每天食用246.0 g。乘员食用感受表明,蔬菜口感良好,对航天食品起到了很好的补充作用,因此对乘员的身体、心理及工作状态起到了很好的调节作用。
食物闭合度通过公式9进行计算:

航天食品总食用量为45.73 kg。根据公式计算得系统食物闭合度达到9.3%。
在试验期间,蔬菜食用量为预先设定,相对于蔬菜总量来说食用量较小。根据后期观察结果,在不影响植物供O2能力的前提下,蔬菜取用量可以增加,因此食物闭合度仍有一定的提高空间。
3.7 能效比计算
根据植物培养面积为27 m2时人与植物达到大气平衡对应的植物产氧能力,可根据公式6计算系统的能效比。
该系统能效比为59.56 g/(kW·m2·d),高于美国类似系统的能效比28.82 g/(kW·m2·d),这显示了红蓝LED光照的优越性。对于植物来说,全光中多数辐射对于植物来说都是无法吸收的,而采用单色光则有效地减少了这种能耗,从而提高了能效。虽然在该平台中,每13.5 m2植物可以满足1人的气体代谢需求,低于美国类似试验中10.0 m2植物即可满足1人的气体代谢需求的水平,但由于太空环境下能源十分珍贵,该系统因能效比较高而更能适应这种环境[17]。
4 结论
试验期间,乘员舱和植物舱内大气O2浓度、CO2浓度、大气压力以及温湿度等参数控制结果良好,微量有害气体得到有效净化,保证了乘员生活环境的稳定性和舒适性。植物生长状况良好,可食生物量产量高,为乘员提供了可口和较高营养品质的新鲜蔬菜。
通过大气平衡调控实验,证明了种植面积为27 m2的植物可满足两名乘员的呼吸需氧量,并有效净化两名乘员产生的CO2,即每13.5 m2植物可以满足1人的气体代谢需求,获取了人与植物之间O2和CO2动态变化的基本特点。在能源利用效率方面,该系统能效比较高,每平米灯板能耗为1 kW,系统能效比为59.56 g/(kW*m2*天),显示了红蓝LED光照系统的优越性,这对于在能源极度宝贵的太空环境下构建受控生态生保系统是非常有价值的。
结合前期密闭系统植物培养实验结果,通过对植物养分供应、光照强度、植物光照面积及不同植物种植面积搭配的探索和调控,最终实现了较高的CO2吸收能力和O2生产能力,满足了2人的气体代谢需求。根据一系列调控技术的使用及其结果,形成了一套“人-植物”O2和CO2交换动态平衡调控方法,对于后续的集成试验研究具有重要的指导意义。
[1] Albiol J,Gòdia F,Montesinos JL,et.al.Biological life support system demonstration facility:the MELISSA pilot plant[R].SAE Technical Paper Series:2000,1:2365-2379.
[2] Galayda YV,Pechurkin NS,Shirobokova IM,et al.Kinetic characteristics of the theoretical ecosystems with different extent of openness[J].Adv.Space Res:2005.35(2005):1516-1520.
[3] Somova LA,Pechurkin NS.Management and control of microbial populations’development in LSS of missions of different durations[J].Adv.Space Res:2004.35(2005):1621-1625.
[4] Czupalla M,Horneck G,Blome HJ.The conceptual design of a hybrid life support system based on the evaluation and comparison of terrestrial testbeds[J].Adv.Space Res:2005,35(2005):1609-1620.
[5] Alexander B,Vladimir Z.Constructions of photo-bioreactors for Micro-algal cultivation in CELSS[J].SAE Technical Paper Series 1996:1349-1361.
[6] Berkovich YA,Krivobok NM,Sinyak YE.Project of Conveyer-type space greenhouse for cosmonauts’supply with vitamin greenery[J].Adv.Space Res:1998,22(10):1401-1405.
[7] Hoff JE,Howe JM,Mitchell CA.Development of selection criteria and their application in evaluation of CELSS candidate species[C]//Moore B et al.(eds),Controlled Ecological Life Support System:First Principal Investigator Meeting Washington,DC:NASA-CP-2247.
[8] Hoff JE,Howe JM,Mitchell CA.Nutritional and cultural aspects of plant species selection for a regenerative life support system[R].Report to NASA Ames Research Center,NSG2401 and NSG2404,1982.
[9] Salisbury FB,Clark MA.Choosing plant to be grown in a controlled ecological life support system(CELSS)based upon attractive vegetarian diets[J].Life support and Biosphere Science,1996,2(2):169179.
[10] Brechignac F,Wolf L.Symbiose-a test bed for studies of closed ecosystems[J].Preparing for the future,1994,4(1):10-11.
[11] Barta DJ,Henninger DJ.Johnson’s Space Center’s regenerative life support system test bed[J].Adv.Space Res,1996,18(4/5):215-222.
[12] Cogne G,Lasseur Ch,Cornet JF,et.al.Growth monitoring of a photosynthetic micro-organism(Spirulina platensis)by pressure measurement[J].Biotech.Letters,2001,23:1309-1314.
[13] Marvin Pitts,Alan Drysdale.Modeling nutrient mineral transport in advanced life support systems[J].SAE Technical Paper Series,1998.
[14] Guo SS,Tang YK,Ai WD.Study on the growing characteristics of lettuce(var.Youmaicai)cultivated at elevated CO2concentrations in controlled environment[J].SAE Technical Paper Series,2009,01-2566.
[15] Barta D,Henderson K.Performance of wheat for air revitalization and food production during the Lunar-Mars Life Support Test Project phase III Test[J].SAE Technical Paper Series,1998:1704.

