利用拉曼光谱分析马海毛纤维的二级结构
周安杰,刘洪玲,苏 红,于伟东,CARR C M
(1.东华大学 纺织学院,上海201620;2.Textiles &Paper,The University of Manchester,U.K.)
利用拉曼光谱分析马海毛纤维的二级结构
周安杰1,刘洪玲1,苏 红1,于伟东1,CARR C M2
(1.东华大学 纺织学院,上海201620;2.Textiles &Paper,The University of Manchester,U.K.)
拉伸细化技术可使纤维的微结构发生转变.利用拉曼光谱技术研究经亚硫酸盐预处理、不同拉伸率下(0,20%,40%,60%)马海毛纤维二级结构的转变.通过对马海毛纤维酰胺Ⅰ带的拟合分峰分析可以得出,拉伸使马海毛纤维大分子的二级结构由α-螺旋向β-折叠结构转变,且随着拉伸率的增加,α→β结构的转变幅度明显降低,高拉伸率下主要发生纤维微结构的滑移;通过对酰胺Ⅲ带和C—C骨架振动的分析同样表明,拉伸过程中α-螺旋转变为β-折叠结构;马海毛纤维被明显细化.
拉伸细化;拉曼光谱;拉伸率;马海毛;二级结构;滑移
马海毛又称安哥拉山羊毛,是珍贵的毛纺原料,具有光泽亮丽、强伸度大,同质性好,手感柔软滑爽等特性,一般用于高档纺织制品.随着穿着轻薄化、舒适化和功能化的转变,对细支(18~21μm)和超细支(15~18μm)毛纤维的需求增多.马海毛的直径随年龄增长变化很大,一般情况下,育成羊毛纤维直径比羔羊毛粗25%~30%,成年羊毛纤维直径比羔羊毛粗30%~35%.羔羊毛纤细、柔软、价格高,但产量低[1].因此,对马海毛进行细化处理,对充分利用成年马海毛纤维,提高产品的附加值具有重要意义.
目前多种测量技术已被运用于蛋白质分子结构的定量研究,主要有X射线衍射法、差示扫描量热(DSC)法、拉曼光谱法和红外光谱法等.文献[2]采用X射线衍射法发现羊毛纤维在拉伸率为5%左右时就发生了结构转变,并且温湿度对这种转变有较大的影响;文献[3]利用傅里叶变换拉曼光谱对拉伸前后羊毛纤维进行研究,发现α-螺旋向β-折叠结构的转变主要发生在拉伸的初始阶段;文献[4]对羊毛纤维进行了拉伸率30%~110% 的研究发现,在拉伸过程中不仅发生了α-螺旋结构向β-折叠结构的转变,还发生了纤维基质、原纤等之间的滑移.
拉曼光谱与红外光谱互补,用于测量分子振动光谱,测量时无损样品且不受水溶液的干扰,从拉曼光谱的图谱中可得到4个参数:频率、强度、偏振特性及峰形.因此,拉曼技术能够提供高质量的角朊图谱,从这些图谱上可以看出氨基酸的构成和二级结构的信息.本文采用文献[5]中的羊毛纤维拉伸细化技术的工艺和原理制得细化毛条,并采用显微拉曼光谱技术测量不同拉伸率下马海毛纤维蛋白质大分子的振动光谱,研究蛋白质大分子二级结构的变化情况,并进行定量表征,总结马海毛纤维拉伸细化机理.
1 试验部分
1.1 试验原料
成年马海毛纤维(直径为35.35μm、长度为128.7mm),课题组自制的拉伸溶液,酒精及石油醚.
1.2 试验步骤
将马海毛纤维梳理成一端整齐后,剪取一定长度的毛条试样,两端用胶带固定,夹于试样夹上,夹持长度为6cm.将制取的毛条放在预处理液(恒温80℃)中浸渍5min,然后放在装有蒸汽罩的拉伸仪上固定并保持自然伸直状态,在80℃的蒸汽环境下以20mm/min拉伸,当拉伸到预定的牵伸率时停止.将拉伸过的毛条在保持张力情况下,放到一次定形液中浸渍3min,取出后用水冲洗3min;再放到二次定形液中浸渍3min,水洗3min;最后在预定温度(80℃)下干燥30min,再在130℃下烘焙3min,这样便制得细化马海毛纤维.
1.3 测试方法
采用复旦大学分析测试中心提供的LabRam-1B型显微拉曼光谱仪,该仪器采用氦-氖激光光源(632.8nm),功率为4.3MW.光谱范围:450~1 050nm;分辨率:约1.2cm-1;波数精度:1.2 cm-1.测量拉曼光谱前分别用酒精和石油醚清洗马海毛纤维3次,在室温下晾干.
2 结果与讨论
2.1 拉曼光谱的基本特征
蛋白质主链结构的拉曼光谱复杂多样,它们主要是由肽键、C—C骨架和C—N引起的.马海毛与羊毛有相似的氨基酸组分[6],对其拉曼光谱的研究主要集中在酰胺Ⅰ带、酰胺Ⅲ带和C—C骨架模式.其中酰胺Ⅰ带(~1 670cm-1)和酰胺Ⅲ带(~1 270 cm-1)是缩氨酸主链结构变化的敏感区域,表1和2分别描述了酰胺Ⅰ和酰胺Ⅲ谱带的位置[3]及综合描述了各酰胺谱带的波数范围和指定[7-8].图1为马海毛原毛与不同拉伸率下的拉曼光谱图,为了便于详细的定量分析,对所获得的拉曼图谱数据进行了归一化处理.数据处理以1 450cm-1附近的峰作为标准峰,这是由于在拉曼光谱中1 450cm-1处的谱带主要是由CH2和CH3的弯曲振动引起的,该官能团与氨基酸侧链相关,不受肽链主链结构变化的影响.各个特征谱带已标于图1中,可以看出,经过不同拉伸处理,马海毛纤维的拉曼光谱发生了一定的变化,且马海毛的拉曼光谱图比羊毛的复杂得多.
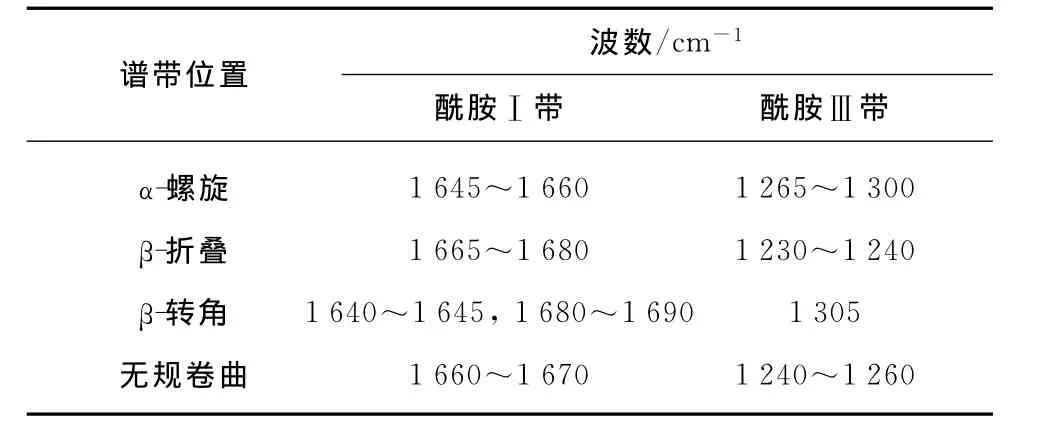
表1 酰胺Ⅰ和酰胺Ⅲ谱带的位置Table 1 Location of amideⅠand amideⅢ
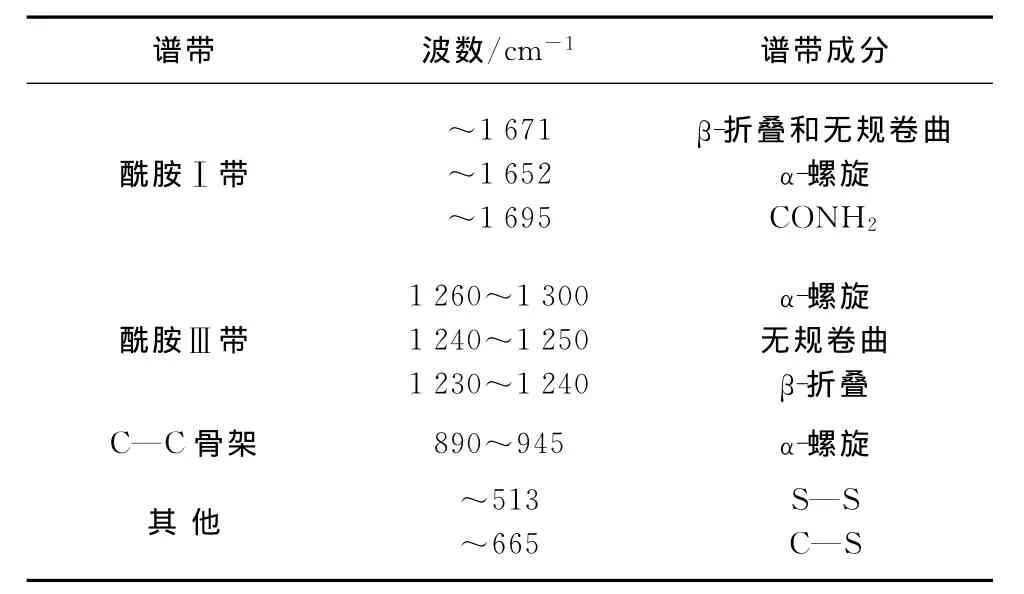
表2 拉曼特征谱带和指定Table 2 Raman characteristic bands and their assignments
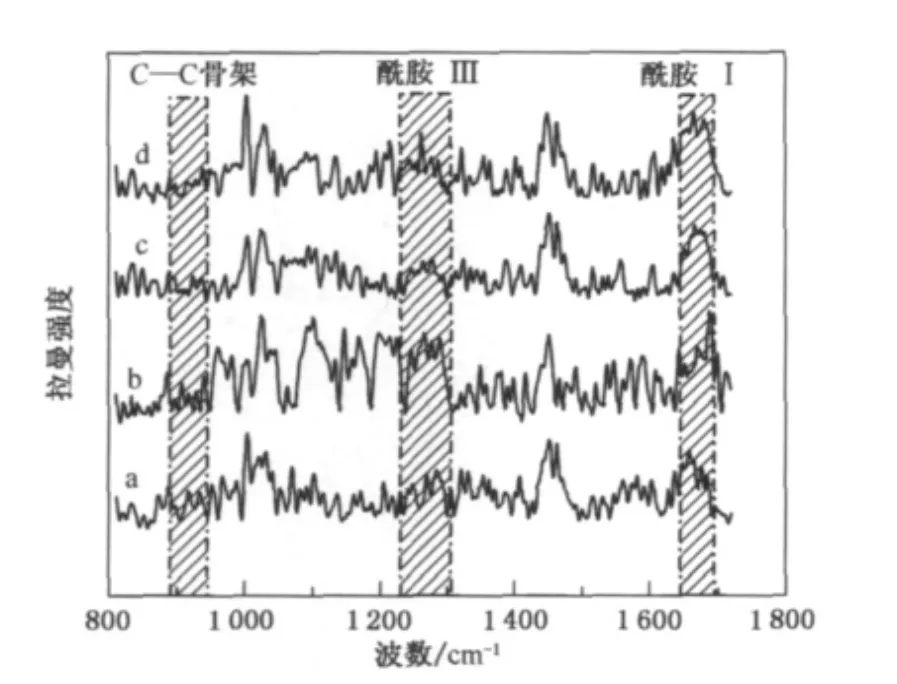
图1 不同拉伸率下马海毛纤维的拉曼光谱图Fig.1 Raman spectra of mohair fibers with different stretching ratios
2.2 马海毛纤维拉曼光谱中酰胺Ⅰ带结构分析
拉曼光谱中的酰胺Ⅰ带对于表征蛋白质纤维二级结构转变特别敏感,尤其是对于纤维微结构转变相 联 系 的 谱 带[9].酰 胺 Ⅰ 带 出 现 在1 650~1 680cm-1处,主要是由羰基的振动和少量的C—N—H平面弯曲和C—N的拉伸振动组成,其中1 645~ 1 660cm-1处谱带归属于 α-螺旋结构;1 665~1 680cm-1处谱带归属于β-折叠结构;另外还包括无规卷曲结构等,主要分布在1 660~1 670cm-1处.图2为不同拉伸率下马海毛纤维酰胺Ⅰ带拉曼光谱图,可以看出该区域谱带形状相当复杂,除了有酰胺Ⅰ带的振动,还有氨基酸侧链的作用,如羧酸、氨基及酪氨酸等都活跃在这一区域.马海毛原毛在1 657cm-1处峰形归属于α-螺旋结构,随着拉伸率的增加该处的峰值变小,峰形逐渐趋于平坦,并伴随着峰形向高波数转移.对于拉细马海毛,在1 667 cm-1附近逐渐形成较强的峰值,归属于β-折叠结构,这表明拉伸使得马海毛纤维大分子的二级结构发生了α-螺旋向β-折叠结构的转变.另外,可以发现当拉伸率为20%和40% 时,1 657cm-1处的峰值变化并不大,由此得出这种结构转变主要发生在拉伸初期,随着拉伸率增加,这种转变幅度并没有多大变化,这与文献[3]的研究结果相符,即在拉伸率为20%时,从α-螺旋向β-折叠结构的转变速度较快,且转变量呈1∶1的关系.根据文献[4]对拉细羊毛的研究表明,在拉伸过程中,不仅发生了从α-螺旋向β-折叠结构的转变,还发生了纤维基质、原纤等之间的滑移,即“滑移细化理论”.马海毛原毛在1 695cm-1处有一个较弱的峰值,该处归属于C—N—H平面弯曲,在拉伸率为20%时该处峰值明显减小,几乎消失,但是随着拉伸率的增加该处峰值又开始增加,关于其转变理论还不清楚.
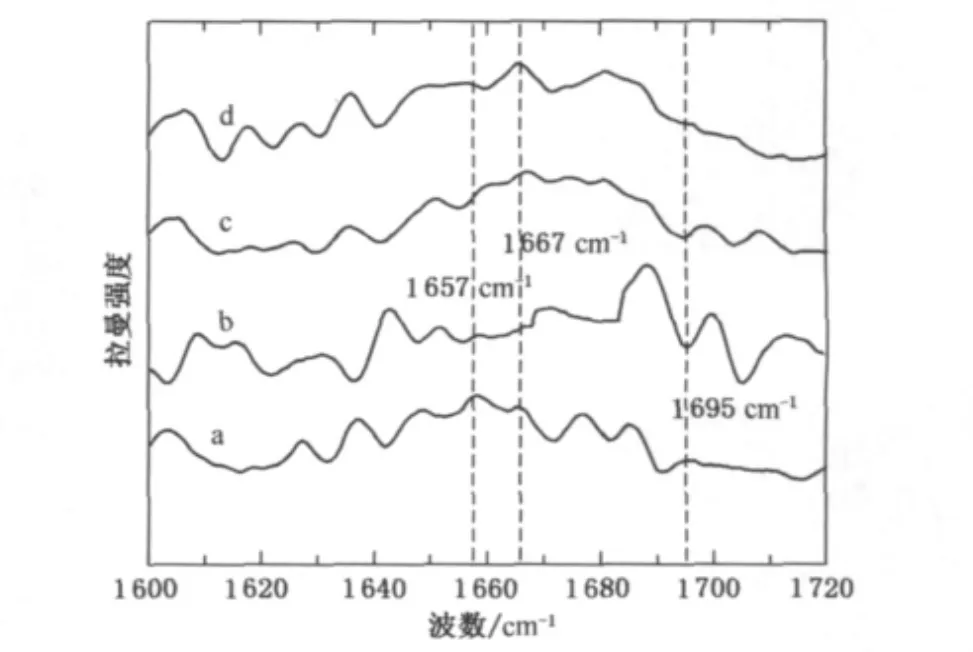
图2 不同拉伸率下马海毛纤维酰胺Ⅰ带拉曼光谱图Fig.2 Raman spectra of the amideⅠregion of mohair fibers with different stretching ratios
运用Origin绘图软件,采用高斯函数对未拉伸和拉伸处理的马海毛纤维的酰胺Ⅰ带进行拟合分峰.各结构在酰胺Ⅰ带中的分峰结果如3图所示,并将拟合后的子峰的峰位进行归属,表3对不同拉伸率下马海毛纤维酰胺Ⅰ带中各结构参数进行了汇总.
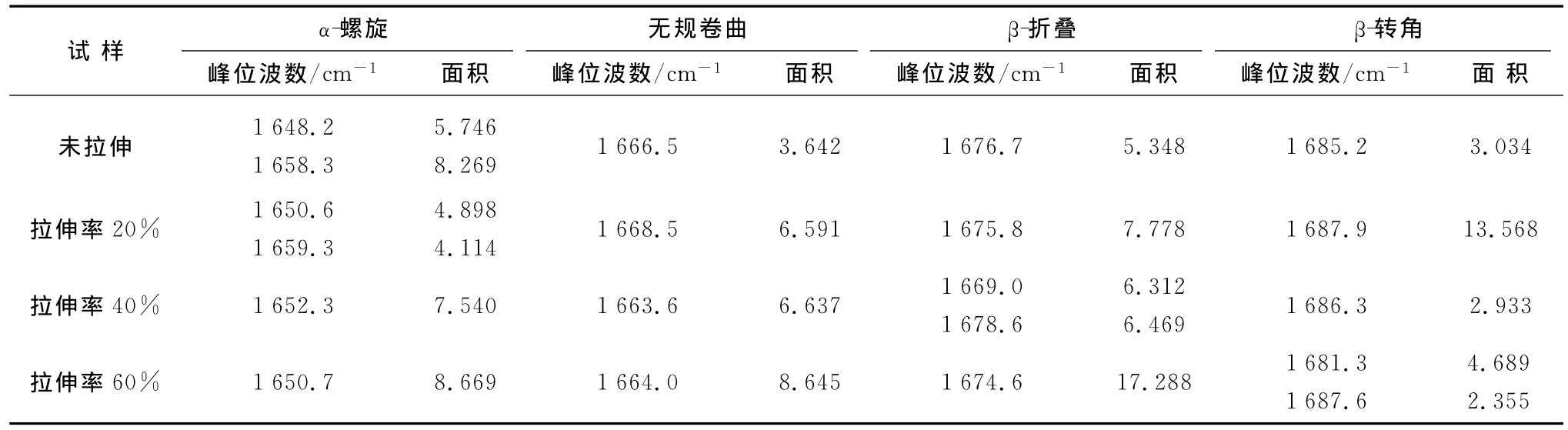
表3 不同拉伸率下马海毛纤维的分峰结果Table 3 Results of deconvolution of the mohair fibers with different stretching ratios
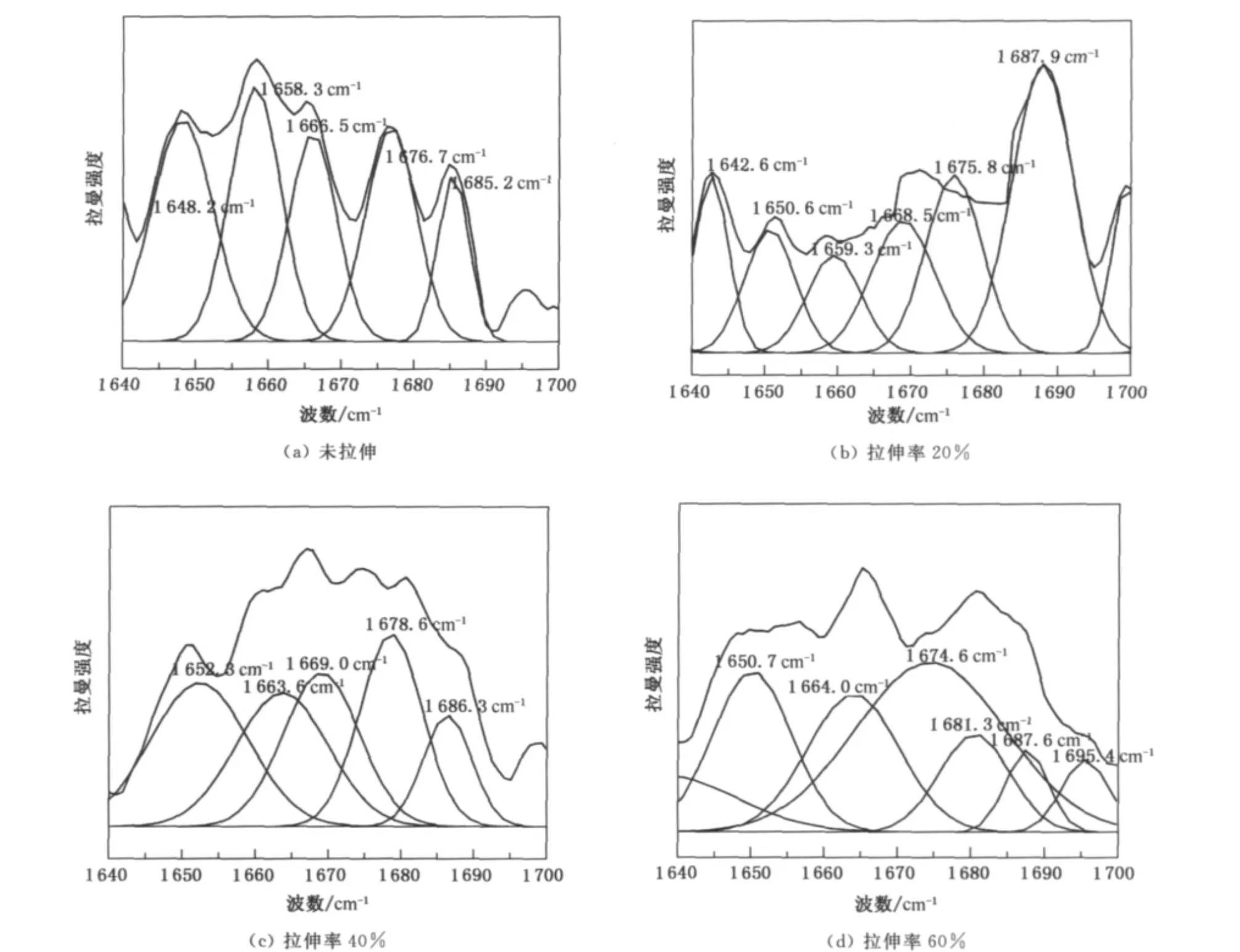
图3 不同拉伸率下马海毛纤维酰胺Ⅰ带的拟合分峰Fig.3 Deconvolution of the amideⅠregion of the Raman spectra of the mohair fibers with different stretching ratios
由图3可以看出,拉伸使酰胺Ⅰ带各特征峰面积发生了很大的变化,尤其是α和β结构的峰面积.将经拟合分峰处理的酰胺Ⅰ带进行归属后,根据各特征峰的参数,依据文献[4]的方法,这4个归属峰的面积百分率之和为100%,可定量地估算出这4种结构分别所占的含量百分率.拟合分峰后α-螺旋结构的含量百分率计算式为

其中:P螺旋为α-螺旋结构的含量百分率;S螺旋,S无规,S折叠,S转角分别为α-螺旋结构、无规卷曲、β-折叠结构和β-转角的面积.不同拉伸率下马海毛纤维酰胺I带拟合分峰后各二级结构的含量百分率如表4所示.
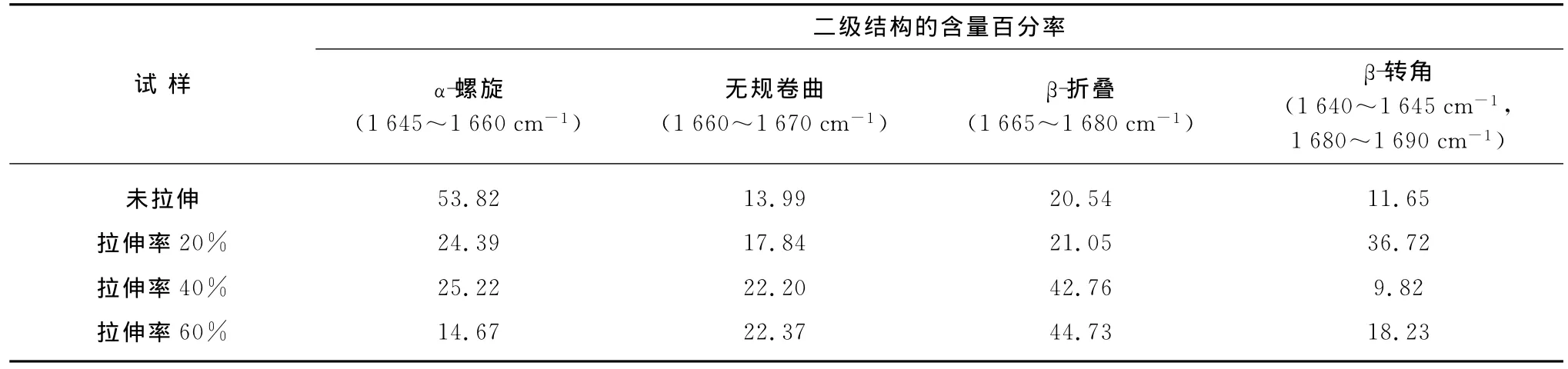
表4 不同拉伸率下马海毛纤维二级结构的含量百分率Table 4 Percentage of secondary structure of moahir fibers with different stretching ratios %
由图3及表4可以看出,马海毛原毛纤维以α-螺旋结构为主,还含有较多β-折叠结构.当拉伸率达到20%时,部分α-螺旋结构转变为β-转角,而β-折叠结构几乎保持不变;当拉伸率继续增加到40%时,α-螺旋结构没有进一步的变化,此时β-转角转变为β-折叠结构;当拉伸率达到60%时,又发生了由α-螺旋结构转变为β-转角的转变,而此时β-折叠结构继续增加.从这里可以看出,β-转角是α-螺旋结构向β-折叠结构转变的一种过渡结构.根据文献[9]对不同拉伸率下羊毛的研究发现,当拉伸率达80%时这种二级结构转变几乎停止,随后拉伸的增加将不会影响α-螺旋结构向β-折叠结构转变,在此过程中主要是纤维微结构的滑移.文献[10]对四川马海毛的氨基酸分析中发现,马海毛的胱氨酸含量为6.32%,比不同类型羊毛胱氨酸含量要高出1.1%~1.8%,而胱氨酸对毛纤维的弹性和强力有重大影响,胱氨酸键(即二硫键)可使多肽链形成网型结构,网型结构的存在,使得α-螺旋结构向β-折叠结构转变过程变得缓慢,需经过一种过渡结构才能完成.对于无规卷曲结构,当拉伸率较小时,随着拉伸率的增加而逐渐增加,这可能由于部分α-螺旋结构和β-转角转变为无规卷曲结构,而当拉伸率增加到60%时,由于各种结构转变在拉伸的初始阶段已基本完成,所以无规结构含量与40%拉伸率相比几乎没有发生变化.
2.3 马海毛拉曼光谱中酰胺Ⅲ带结构分析
酰胺Ⅲ带出现在1 230~1 300cm-1,主要是由C—N—H平面弯曲和C—N拉伸模式组成,其中1 230~1 240cm-1表示β-折叠结构的特征谱线,1 240~1 260cm-1表示无规卷曲结构的特征谱线,1 260~1 300cm-1为α-螺旋结构的特征谱线.不同拉伸率下马海毛纤维酰胺Ⅲ带的拉曼光谱图如图4所示.图4中1 230cm-1附近归属于β-折叠结构,但马海毛原毛此处的拉曼强度很低,谱形为下凹形;随着拉伸率的增加,该处的拉曼强度略有所增加,拉曼光谱中各结构的峰面积或高度直接与结构含量成正比[3],这说明拉伸过程中形成了β-折叠结构.马海毛原毛在1 249cm-1处出现较强的拉曼谱线,归属于无规卷曲结构,从图4可以看出,随着拉伸率的增加,无规卷曲结构的特征峰向高波数发生转移且整体的峰面积也在逐渐增加,当拉伸率达到60%时,在1 260cm-1附近形成强的肩峰,这说明在拉伸过程中有无规结构形成.而马海毛原毛在1 269cm-1处出现较强的拉曼谱线,归属于α-螺旋结构,可以看出,经60%拉伸率处理后,该处α-螺旋结构的谱带强度很弱,表明经拉伸后蛋白质大分子的结构从α-螺旋转变为β-折叠结构,拉伸后马海毛纤维的拉曼谱线上不存在α-螺旋结构,这并不表明拉伸过程中α-螺旋结构完全转化为β-折叠构.

图4 不同拉伸率下马海毛纤维酰胺Ⅲ带拉曼光谱图Fig.4 Raman spectra of the amideⅢregion of mohair fibers with different stretching ratios
2.4 马海毛拉曼光谱中C—C骨架振动区结构分析
C—C骨架振动区出现在890~960cm-1,主要是C—C骨架的拉伸振动,其中α-螺旋结构的特征谱线主要出现在890~945cm-1,无规卷曲结构在945~960cm-1.不同拉伸率下马海毛纤维C—C骨架振动拉曼光谱图如图5所示,可以看出,马海毛原毛在α-螺旋结构的特征谱带范围内出现了较强的宽峰,当拉伸率达到20%时,这些峰的强度和峰宽弱化,变成许多中等强度的肩峰,当拉伸率继续增加至40%和60%时,α-螺旋结构总的含量明显减少,表现为该范围内的谱线强度明显减弱,没有明显的特征峰.这说明在较高拉伸率作用下,C—C骨架振动区中大部分的α-螺旋结构转变为β-折叠结构.
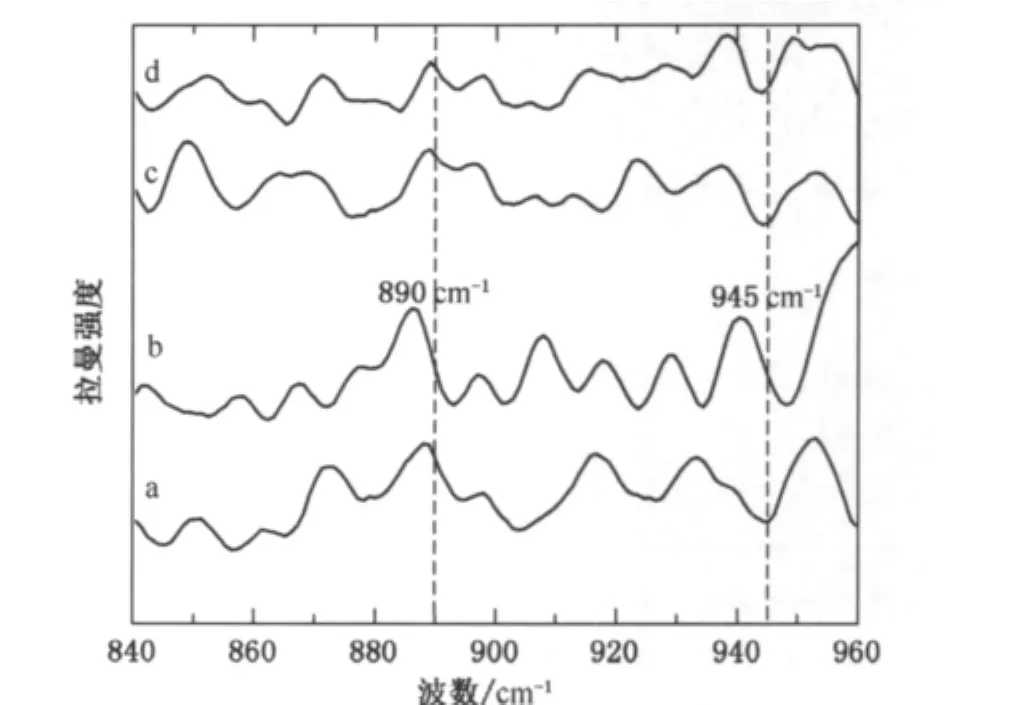
图5 不同拉伸率下马海毛纤维C—C骨架振动区拉曼光谱图Fig.5 Raman spectra of the C—C backbone vibration region of mohair fibers with different stretching ratios
3 结 语
本文采用拉曼光谱技术研究了经亚硫酸盐预处理及不同拉伸率下马海毛纤维微结构的转变情况.通过对不同拉伸率马海毛纤维酰胺Ⅰ带的分析表明,在拉伸细化过程中,马海毛纤维二级结构发生了由α-螺旋向β-折叠结构的转变.由于马海毛纤维存在网型结构,使得α-螺旋向β-折叠结构转变过程变得缓慢,需经过一种过渡结构(即β-转角)才能完成,且α→β结构转变主要发生在拉伸的初级阶段,当拉伸率大于40%时,主要发生纤维微结构的滑移,对于无规卷曲结构,在拉伸初始阶段略有增加.通过对酰胺Ⅲ带和C—C骨架振动的分析表明,随着拉伸率的增大,α-螺旋结构转变为β-折叠结构,但同样会发生纤维微结构的滑移.
参 考 文 献
[1]张东孤.安哥拉山羊与马海毛[J].毛纺科技,1989(1):63-64.
[2]BENDIT E G.A quantitative X-ray diffraction study of the alpha-beta transformation in wool keratin[J].Textile Reaearch Joural,1960,30(8):547-555.
[3]CHURCH J S,CORINO G L,WOODHEAD A L.The effects of stretching on wool fibers as monitored by FT-Raman spetroscopy[J].Journal of Molecular Structure,1998,440(1):15-23.
[4]唐芙菊.拉伸细化羊毛二级结构的分析与表征[D].上海:东华大学纺织学院,2006:89.
[5]于伟东,刘洪玲,章悦庭.羊毛细化与定形的基本理论[J].纺织学报,2005,26(1):7-9.
[6]WARD W H,BINKLEY C H.Amino acid composition of normal wools,wool fractions,mohair,feather,and feather fractions[J].Textile Research Journal,1955,25(4):314-325.
[7]KOGAJ.KAWAGUCHI K,NISHIO E,et al.FTIR study on structural transformation of keratin filmsinduced by stretching[J].Journal of Applied Polymner Science,1989,37(8):2131-2140.
[8]FRUSHOUR B G,GLARK R J H,HESTER R E,et al.Advances in infrared and Raman spectroscopy[M].London:Heydne,1975:35-97.
[9]LIU H L,YU W D.Study of the structure transformation of wool fibers with Raman speetroscopy[J].Journal of Applied Polymer Science,2007,103(1):1-7.
[10]李一,王杰,李文杰,等.四川马海毛的氨基酸分析[J].西南民族学院学报,2002,28(3):324-326.
Secondary Structure Analysis of Stretched Mohair Fibers by Raman Spectroscopy
ZHOUAn-jie1,LIUHong-ling1,SUHong1,YUWei-dong1,CARRCM2
(1.College of Textiles,Donghua University,Shanghai 201620,China;2.Textiles &Paper,The University of Manchester,U.K.)
The essence of slenderization technology is to make fiber microstructure transformed to achieve refinement.Raman spectroscopy was used to investigate the secondary structure changes of sulphite pretreated mohair fibers with stretching ratios at 0,20%,40%and 60%.Through the curve-fitting method of the amide Ⅰ region implied that the secondary structure of stretched mohair fibers was mainly transformed from α-helical structure toβ-pleated-sheet structure during the stretching process,when increased the stretching ratios,the range ofα→βtransformation significantly decreased,when at high stretching ratios,the mechanism of stretching mainly relied on the slippage of the fiber micro-structure.Analysis of the amideⅢband and the C—C skeletal vibration region also revealed thatα-helical structure converted toβ-pleated-sheet structure during the stretching process.Mohair fibers were obviously refinement.
slenderization;Raman spectroscopy;stretching ratio;mohair;secondary structure;slippage
TS 102.3
A
1671-0444(2013)01-0031-06
2011-11-26
周安杰(1986—),女,河南南阳人,硕士研究生,研究方向为动物毛发的拉伸细化.E-mail:zhaj860@126.com
刘洪玲(联系人),女,教授,E-mail:hlliu@dhu.edu.cn

