KH 添加对Na-Al-H 配位氢化物可逆放氢性能的影响
王顺葵 李志杰 肖学章,* 范修林 陈志文 李寿权葛红卫 陈立新,*
(1浙江大学材料科学与工程学系,浙江省电池新材料与应用技术研究重点实验室,杭州310027;2甘肃工业职业技术学院,甘肃天水741025)
1 引 言
高效、清洁的能源体系是人类社会可持续发展的基础,发展以氢作为二次能源载体的清洁可再生能源已成为全球的共识,而开发温和条件下具有高可逆储氢容量的材料已被许多国家列为重点研究课题.11997年,Bogdanović等2,3报道了 NaAlH4配位氢化物中引入2%(x)Ti(OBun)4后可在160°C下实现可逆储氢过程:

这一研究结果激发了人们对以NaAlH4为代表的配位氢化物储氢材料的研究兴趣.4-8近十年来,有关NaAlH4体系可逆储氢性能的优化研究取得了很大进展.Wang等研究报道了掺加金属Ti粉来催化增强NaAlH4体系的可逆储氢容量,9并通过Ti-K共掺改善了NaAlH4特别是Na3AlH6的放氢性能.10Xiao等11通过Ti-Zr共掺杂研究,改善了NaAlH4体系的吸放氢反应动力学性能,并降低了体系的放氢温度.Liu等12研究报道了NaAlH4的一种新型添加剂,K2TiF6,通过Ti、F和K的协同作用显著提高了体系的储氢性能.2006年,Bogdanović等13发现掺杂了CeCl3的 NaAlH4比掺杂 TiCl3的 NaAlH4有更好的储氢性能,但掺杂CeCl3的NaAlH4体系仍存在吸放氢动力学较慢、吸放氢温度较高等问题.为进一步提高NaAlH4体系的综合储氢性能,本工作采用NaH粉和Al粉为合成原料,分别以CeCl3和CeCl3/yKH(y=0.02,0.04)为催化添加剂,在氢气气氛下通过机械反应球磨法制备了(NaH/Al+CeCl3)和(NaH/Al+CeCl3/yKH)(y=0.02,0.04)复合物,着重研究了KH添加剂对(NaH/Al+CeCl3)复合体系可逆吸放氢性能的影响及其作用机制.
2 实验部分
2.1 实验原料
NaH粉末,纯度≥97%(80%(w)分布于植物油中,通过正己烷清洗提取),粒径为5-50 μm;分析纯Al粉,纯度≥99.9%,粒径为1-2 μm;CeCl3粉末,纯度≥99.5%;KH(30%(w)分布于植物油中,通过正己烷清洗提取),所有原料均为Aladdin公司产品.NaH/Al/CeCl3/KH分别按1:1:0.02:0,0.98:1:0.02:0.02和0.96:1:0.02:0.04摩尔比进行混合,混合均匀后放入两个球磨罐中(下文统称为(NaH/Al+CeCl3),(NaH/Al+CeCl3/0.02KH)和(NaH/Al+CeCl3/0.04KH)复合物).球磨前,先对球磨罐抽真空,再充入3.0 MPa的高纯氢气.球磨机为南京大学仪器厂生产的QM-1SP(2L)行星式球磨机,球料比为40:1,球磨机转速为350 r·min-1,球磨时间为120 h.球磨后取约400 mg复合物粉末试样装入不锈钢反应器.整个制备过程在充有高纯氩气(纯度99.999%)的手套箱里进行.
2.2 样品的测试
样品的储氢特性测试在自制的Sievertʹs MH115型吸放氢性能测试装置上进行.样品的吸氢温度为120和100°C,初始氢压为12 MPa,每次放氢前吸氢6 h;样品对真空放氢,放氢温度为170和140°C;程序升温脱附(TPD)曲线测试,温度由室温升至170°C,升温速率为1°C·min-1;恒温放氢(ITD)曲线测试,温度为170°C.计算储氢容量时将催化剂的质量包括在内.X射线衍射(XRD)测试,在日本Rigaka公司的ARLXʹTRA射线衍射仪上以Cu Kα为衍射束进行,λ=0.154 nm,管电流为40 mA,管电压为40 kV.为了防止样品与氧气或者水蒸气接触,样品在运送过程中放在特制的密封装置中.复合物的差示扫描量热法(DSC)测试,是在德国Netzsch STA 449F3分析仪上进行,氩气流速为40 mL·min-1.
3 结果与讨论
图1为(NaH/Al+CeCl3)和(NaH/Al+CeCl3/0.02KH)复合物在不同吸放氢状态时的XRD图谱.由图1可见,经过反应球磨制备后,两种复合物的主相均为NaAlH4,并含有微量的Na3AlH6中间氢化物相和未反应完的Al相,这表明在室温下通过机械反应球磨可直接制备出纯度较高的NaAlH4配位氢化物.复合物放氢后的主相转变为NaH和Al,而再吸氢后的主相又可逆转变为NaAlH4,由此证实了上述分别添加CeCl3和CeCl3/KH的Na-Al-H复合体系具有良好的可逆储氢特性.由图1还可看出,(NaH/Al+CeCl3)和(NaH/Al+CeCl3/0.02KH)复合物在球磨后均有CeH2和NaCl的存在,这是由于CeCl3与NaH发生化学反应而生成,14其反应式如下:值得注意的是,在NaH/Al+CeCl3/KH)复合物XRD图谱中没有发现含K元素的XRD衍射峰(如K2NaAlH6).12我们进一步将Na-Al-H复合体系中KH与NaH的摩尔比提高到0.10:0.90时,相同制备条件下样品的XRD图谱中仍未发现有K2NaAlH6等含K相存在,由此我们推断出K元素可能是以其它形式存在于Na-Al-H复合体系中,下面将进一步分析.
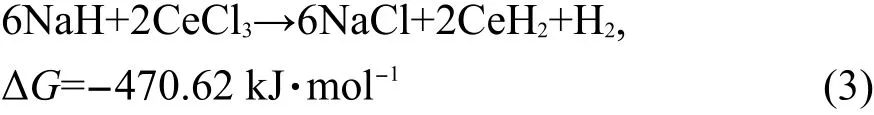
图1 (NaH/Al+CeCl3)复合物(a)和(NaH/Al+CeCl3/0.02KH)复合物(b)在不同吸放氢状态时的XRD图谱Fig.1 X-ray diffraction(XRD)patterns of(a)(NaH/Al+CeCl3)and(b)(NaH/Al+CeCl3/0.02KH)composites at different de-/hydrogenation states
图2为(NaH/Al+CeCl3)、(NaH/Al+CeCl3/0.02KH)和(NaH/Al+CeCl3/0.04KH)复合物在1 °C·min-1的升温速率下的TPD曲线以及循环ITD曲线.由图2的TPD曲线可见,(NaH/Al+CeCl3)和(NaH/Al+CeCl3/0.02KH)复合物的第一步放氢动力学性能相似,约从87°C开始放氢,在137°C左右完成第一步放氢反应(NaAlH4→Na3AlH6+Al+H2),放氢量约为2.7%(w);而在第二步放氢(Na3AlH6→NaH+Al+H2)过程中,(NaH/Al+CeCl3/0.02KH)则比(NaH/Al+CeCl3)表现出更快的放氢动力学性能.同时我们发现当KH的含量由2%增加至4%时,一方面Na-Al-H体系的放氢动力学改善程度不明显;另一方面因KH本身难以可逆吸放氢,Na-Al-H体系的实际放氢量随KH的添加量的增加而有所下降,故本论文随后集中研究了(NaH/Al+CeCl3/0.02KH)复合物的放氢性能及其改善机制.由TPD可知,KH的加入更有利于改善NaAlH4的第二步放氢特性,而图2的ITD曲线中两种复合物在170°C时的恒温放氢曲线也验证了这一结论.由图可见,两种复合物在前5 min的第一步放氢反应过程基本相似,放氢量约为2.7%(w),这与TPD中第一步放氢量对应.而在第一步放氢结束之后,(NaH/Al+CeCl3/0.02KH)复合物的第二步放氢过程显示出更为优异的动力学特性,且其在20 min内已基本完成两步放氢过程.此外,两种复合物在前三次放氢循环中均表现出较好的放氢动力学和循环稳定性.

图2 (NaH/Al+CeCl3)复合物(a)、(NaH/Al+CeCl3/0.02KH)复合物(b)和(NaH/Al+CeCl3/0.04KH)复合物(c)的TPD曲线以及循环ITD曲线Fig.2 Temperature programmed desorption(TPD)curves and cycling isothermal temperature desorption(ITD)curves of(NaH/Al+CeCl3)(a),and(NaH/Al+CeCl3/0.02KH)(b),and(NaH/Al+CeCl3/0.04KH)(c)composites
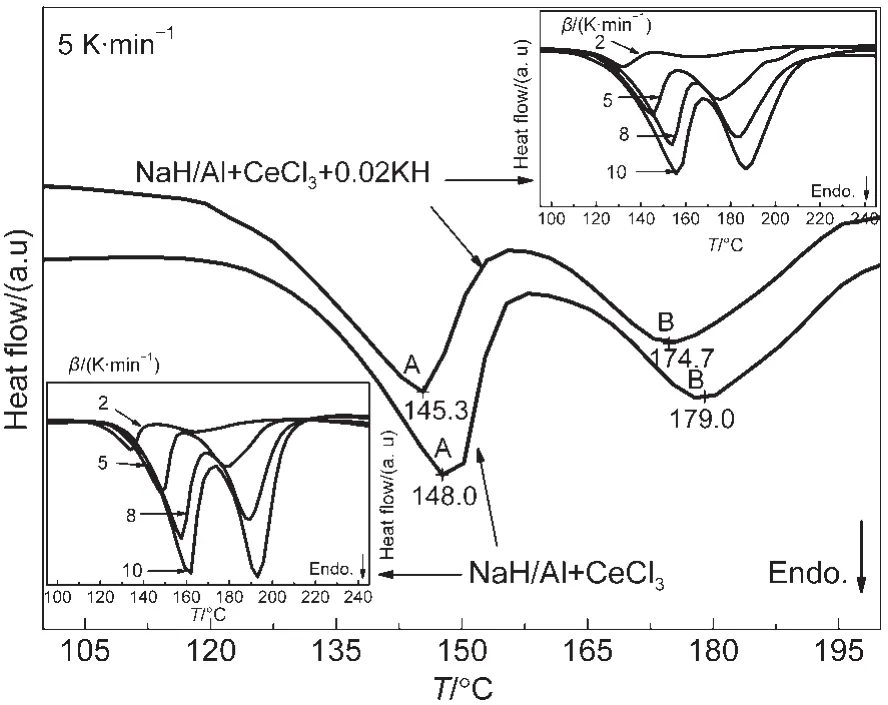
图3 (NaH/Al+CeCl3)和(NaH/Al+CeCl3/0.02KH)复合物在不同升温速率(β)下的DSC曲线Fig.3 Differential scanning calorimetry(DSC)profiles of(NaH/Al+CeCl3)and(NaH/Al+CeCl3/0.02KH)composites at different heating rates(β)
图3 为(NaH/Al+CeCl3)和(NaH/Al+CeCl3/0.02KH)球磨合成样品在不同升温速率下的DSC曲线.图中吸热峰A和B分别对应NaAlH4的两步放氢反应.由图3可以看出,与(NaH/Al+CeCl3)复合物相比,(NaH/Al+CeCl3/0.02KH)复合物的两步放氢反应峰值温度都向低温偏移,而第二步放氢反应的峰值温度偏移量更大.为了进一步研究添加KH对NaAlH4第二步放氢反应的改善作用,本文通过Kissinger方程15拟合计算了两种复合物中两步反应的表观活化能:

式中β为升温速率,Tp为不同升温速率(2,5,8,10 K·min-1)下DSC曲线的峰值温度,Ea为活化能,R为气体常数,A为指前因子.图3中插图所示(NaH/Al+Ce-Cl3)和(NaH/Al+CeCl3/0.02KH)复合物在不同升温速率下的DSC曲线,随着升温速率增大,峰值温度逐渐增大.利用图4的ln(β/Tp2)与1/Tp的关系函数,可通过(NaH/Al+CeCl3)复合物的直线斜率计算出其第一步和第二步放氢反应的表观活化能分别为81.88和87.08 kJ·mol-1,如表1所示.按相同方法计算出(NaH/Al+CeCl3/0.02KH)复合物的第一步和第二步放氢反应的活化能分别为81.55和84.32 kJ·mol-1.这表明KH的加入能有效降低Na-Al-H复合体系第二步脱氢反应的表观活化能.
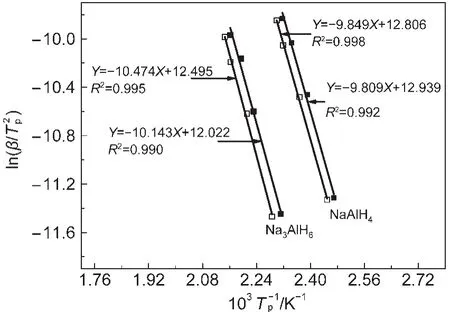
图4 (NaH/Al+CeCl3)(实心符号)和(NaH/Al+CeCl3/0.02KH)(空心符号)复合物放氢的Kissinger方法拟合直线Fig.4 Kissingerʹs plots of(NaH/Al+CeCl3)(solid symbols)and(NaH/Al+CeCl3/0.02 KH)(hollow symbols)composites
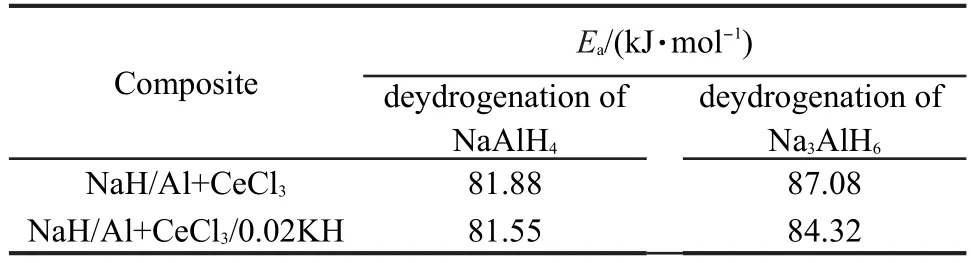
表1 Kissinger方法处理两种复合物两步放氢反应的表观活化能(Ea)Table 1 Experimental activation energy(Ea)calculated using a Kissinger analysis
由上述研究结果可知,KH添加剂对于Na-Al-H体系的第二步放氢反应有明显的改善作用,这表明KH可能参与了Na-Al-H体系的吸放氢循环过程中.为了验证这一推断,进一步对(NaH/Al+CeCl3)和(NaH/Al+CeCl3/0.02KH)样品循环过程中的Na3AlH6相进行XRD精细扫描并拟合计算出Na3AlH6的晶格常数.为了得到纯度较高的Na3AlH6,待样品放氢结束之后,向反应器中充入2.5 MPa左右氢气,恒温吸氢6 h以获得主相为Na3AlH6的样品.16,17图5为(NaH/Al+CeCl3)和(NaH/Al+CeCl3/0.02KH)样品吸氢后主相为Na3AlH6的XRD图谱,表2中列出了计算得到的Na3AlH6晶格常数.由此可知,KH的添加使Na3AlH6晶胞的a和b增大,c减小,综合作用使Na3AlH6的晶胞体积由0.23885 nm3膨胀到0.23967 nm3.考虑到K+(0.133 nm)和Na+(0.097 nm)的离子半径,18分析认为上述晶体体积膨胀的原因是由于K+部分取代了Na-Al-H体系中的Na+而形成Na3-xKxAlH6(x≤0.06)所造成的.此外,在图5中没有发现含K元素的单一新相产生,这也与图1中XRD图谱结果相一致.这进一步表明,在添加KH的Na-Al-H体系中,并未生成K2NaAlH6等严格计量比的新相,而是通过K+对Na+的部分取代以形成了Na3-xKxAlH6固溶体.
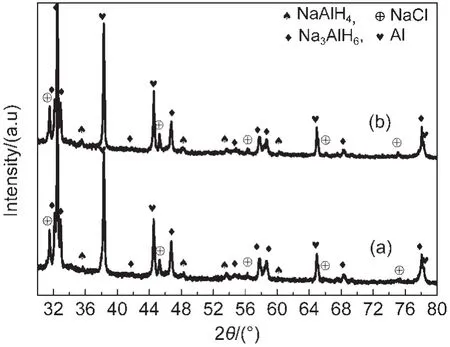
图5 (NaH/Al+CeCl3)复合物(a)和(NaH/Al+CeCl3/0.02KH)复合物(b)放氢产物在2.5 MPa氢压下再吸氢6 h后的XRD图谱Fig.5 XRD patterns of(NaH/Al+CeCl3)(a)and(NaH/Al+CeCl3/0.02KH)(b)samples after rehydriding at a pressure of 2.5 MPa for 6 h
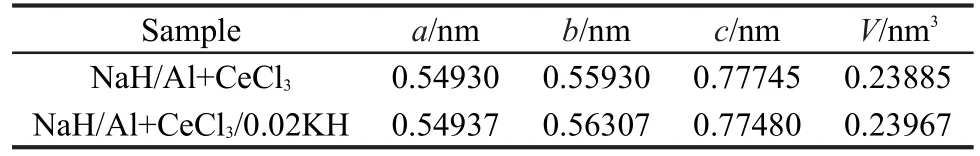
表2 两种样品中Na3AlH6的晶格常数Table 2 Lattice parameters of Na3AlH6in two samples
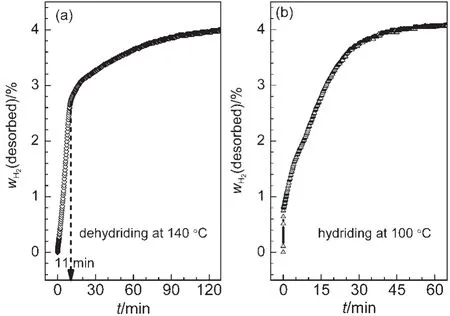
图6 (NaH/Al+CeCl3/0.02KH)复合物的恒温吸放氢曲线Fig.6 Isothermal de/rehydriding curves of(NaH/Al+CeCl3/0.02KH)composite
我们进一步研究了(NaH/Al+CeCl3/0.02KH)复合物在较低温度下的可逆吸放氢行为.图6(a)为(NaH/Al+CeCl3/0.02KH)复合物的140°C恒温放氢曲线.由图可见,(NaH/Al+CeCl3/0.02KH)复合物在140°C时仍有较好的放氢性能,约11 min完成第一步放氢反应,放氢量为2.7%(w);随后约2 h完成了第二步放氢反应.而由图6(b)的100°C恒温吸氢曲线可见,(NaH/Al+CeCl3/0.02KH)复合物在45 min内基本吸氢饱和,其吸氢动力学优于Bogdanovic等13报道的相同条件下的研究结果.
4 结论
以NaH粉和Al粉为原料,分别采用CeCl3和CeCl3/KH为催化添加剂,通过反应球磨(NaH/Al+CeCl3)和(NaH/Al+CeCl3/KH)复合物成功制备出Na-Al-H配位氢化物.研究发现,添加KH能有效提高Na-Al-H体系的第二步放氢性动力学性能,且在较低温度(100-140°C)下具有良好的可逆吸放氢性能.分析表明,Na-Al-H体系中添加少量KH可使部分K+取代了体系中Na+的位置而形成Na3-xKxAlH6,这有效降低了Na-Al-H体系的第二步脱氢反应的表观活化能,进而提高了体系的放氢动力学性能.
(1) Schlapbach,L.;Züttel,A.Nature 2001,414,353.doi:10.1038/35104634
(2) Bogdanović,B.;Schwickardi,M.Journal of Alloys and Compounds 1997,253,1.
(3) Bogdanović,B.;Eberle,U.;Felderhoff,M.;Schüth,F.Scripta Materialia 2007,56,813.doi:10.1016/j.scriptamat.2007.01.004(4)Xiao,X.;Chen,L.;Wang,X.;Li,S.;Wang,Q.;Chen,C.International Journal of Hydrogen Energy 2007,32,3954.doi:10.1016/j.ijhydene.2007.05.015
(5)Xiao,X.;Chen,L.;Wang,X.;Wang,Q.;Chen,C.International Journal of Hydrogen Energy 2007,32,2475.doi:10.1016/j.ijhydene.2006.11.002
(6)Xiao,X.;Chen,L.;Wang,X.;Li,S.;Chen,C.;Wang,Q.International Journal of Hydrogen Energy 2008,33,64.doi:10.1016/j.ijhydene.2007.09.015
(7)Fan,X.;Xiao,X.;Chen,L.;Yu,K.;Wu,Z.;Li,S.;Wang,Q.Chemical Communications 2009,6857.
(8)Xiao,X.Z.;Fan,X.L.;Yu,K.R.;Li,S.Q.;Chen,C.P.;Wang,Q.D.;Chen,L.X.J.Phys.Chem.C 2009,113,20745.doi:10.1021/jp907258p
(9)Wang,P.;Jensen,C.M.J.Phys.Chem.B 2004,108,15827.doi:10.1021/jp047002g
(10)Wang,P.;Kang,X.D.;Cheng,H.M.Journal of Applied Physics 2005,98,074905.doi:10.1063/1.2084308
(11)Xiao,X.Z.;Chen,L.X.;Fan,X.L.;Ge,H.W.;Li,S.Q.;Ying,Y.;Wang,X.H.;Chen,C.P.Acta Phys.-Chim.Sin.2008,24,423.[肖学章,陈立新,范修林,葛红卫,李寿权,应 窕,王新华,陈长聘.物理化学学报,2008,24,423.]doi:10.3866/PKU.WHXB20080312
(12)Liu,Y.;Liang,C.;Zhou,H.;Gao,M.;Pan,H.;Wang,Q.Chemical Communications 2011,47,1740.doi:10.1039/c0cc03264f
(13) Bogdanović,B.;Felderhoff,M.;Pommerin,A.;Schueth,F.;Spielkamp,N.Advanced Materials 2006,18,1198.
(14) Hu,J.;Ren,S.;Witter,R.;Fichtner,M.Advanced Energy Materials 2012,2,560.doi:10.1002/aenm.201100724
(15) Kissinger,H.E.Anal.Chem.1957,29,1702.doi:10.1021/ac60131a045
(16)Fan,X.;Xiao,X.;Chen,L.;Han,L.;Li,S.;Ge,H.;Wang,Q.International Journal of Hydrogen Energy 2011,36,10861.doi:10.1016/j.ijhydene.2011.05.140
(17) Fan,X.;Xiao,X.;Chen,L.;Li,S.;Ge,H.;Wang,Q.J.Phys.Chem.C 2011,115,2537.doi:10.1021/jp1089382
(18) Chung,S.C.;Morioka,H.Journal of Alloys and Compounds 2004,372,92.doi:10.1016/j.jallcom.2003.09.130

