纳米材料修饰电极上吸附态葡萄糖氧化酶的酶活性和电活性的比较
杨大威 陈 超 谢青季 姚守拙
(湖南师范大学化学化工学院,化学生物学及中药分析教育部重点实验室,长沙410081)
1 引言
葡萄糖氧化酶(GOx)常被用作安培酶电极领域的模型酶加以研究,也直接服务于糖尿病人血糖检测和监测的巨大临床需求.1-6GOx是一种同型二聚体蛋白质分子,有两个黄素腺嘌呤二核苷酸(FAD)氧化态活性中心,可高选择性地快速催化葡萄糖的氧化.在这个酶催化反应中,酶的氧化态活性中心FAD被葡萄糖还原成其还原态FADH2.显然,需要额外的氧化剂(媒介体)将FADH2重新氧化(翻转)为FAD,从而实现酶催化反应的循环过程.根据所选用的媒介体氧化剂的不同,可将葡萄糖安培酶电极分为以下三代.
第一代GOx安培酶电极利用溶液中的溶解O2这一天然电子媒介体实现从还原态FADH2到氧化态FAD的“翻转”:
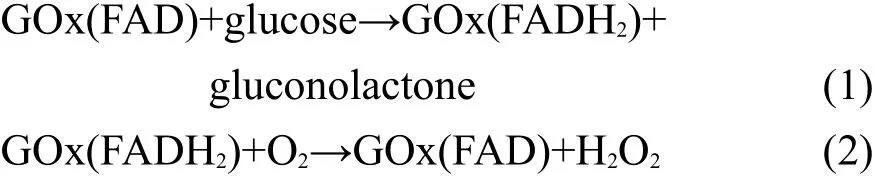
通过安培检测O2的还原,或者酶生H2O2的氧化或还原,可间接检测葡萄糖.第二代葡萄糖安培酶电极使用二茂铁衍生物、苯醌等作为人工媒介体代替第一代中的天然媒介体O2;而第三代葡萄糖安培酶电极是指酶与电极间直接发生电子转移,即直接以电极为电子媒介体,实现翻转酶还原态到其氧化态的传感类型.
GOx安培酶电极的研究一直很活跃,近年来采用各种纳米材料(如纳米金、7,8碳纳米管、8-10石墨烯11)作为酶固定载体的研究已成为该领域的前沿课题之一.然而,纳米材料上GOx的生物活性保持及其与直接电化学行为相关性的定量研究似乎依然不多,尽管相关研究对于第三代安培酶电极研究具有重要意义.3
石英晶体微天平(QCM)是基于压电石英晶体的逆压电效应的声波传感器,是动态研究电极/溶液界面的重要表征手段,可监测电极表面纳克级的质量变化,也对电极表面及其附近溶液的粘弹性变化等参数有灵敏响应.12-14同时进行QCM和电化学实验的装置称为电化学石英晶体微天平(EQCM),是实时监测电化学过程的有力手段.15当刚性薄膜在QCM的一个电极表面上均匀地沉积或溶出时(纯粹的质量效应),可用如下Sauerbrey方程来描述QCM谐振频率改变(Δf0)和电极表面质量改变(Δm)间的关系:16,17

式中f0g为压电石英晶体在气相中的基频;A为QCM电极的压电活性面积;ρq=2.648 g·cm-3,为石英晶体密度;μq=2.947×1011g·cm-1·s-2,为晶体剪切模量.
对于液体粘密度效应,Kanazawa和Gordon17建立了相应的数学模型:
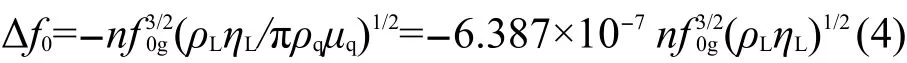
式中ρL为液体密度;ηL为液体粘度;n为石英晶体的触液面数.
本文采用QCM技术,监测了GOx在裸金电极(Au)、电沉积纳米金的电极(Aued/Au)、多壁碳纳米管修饰的金电极(MWCNTs/Au)以及镀金后的MWCNTs/Au电极(Aued/MWCNTs/Au)上GOx的吸附过程,并比较性地定量研究了各吸附态GOx(GOxi)的质量比生物活性(MSBAi)和电活性百分数(EAPi),旨在为纳米材料固定酶及其安培酶电极的研究提供基础物理化学数据.
2 实验部分
2.1 仪器和试剂
所有电化学实验均在CHI660C电化学工作站(上海辰华仪器公司)上进行,采用三电极系统,饱和甘汞电极(SCE)为参比电极(本文电位均相对于SCE),自制的铅笔芯电极为对电极;AT切9-MHz压电石英晶体表面金电极(北京晨晶电子有限公司)为工作电极(WE).晶体单面触液,晶体直径12.5 mm,电极直径6 mm.扫描电子显微镜(SEM)图片采自QUANTA FEG 250场发射扫描电子显微镜(美国FEI公司).QCM和EQCM实验采用计算机控制的HP4395A阻抗/网络/频谱分析仪.12,13
GOx(EC 1.1.3.4;黑曲霉来源,II型,活性约为150 kU·g-1,U为酶活性国际标准单位)购自Sigma公司并直接使用.葡萄糖(上海化学试剂公司)配制成1.00 mol·L-1水溶液,在使用前至少放置24 h使达光学异构体平衡.多壁碳纳米管(MWCNTs,直径20-40 nm,纯度大于95%)购自深圳市纳米港有限公司,氯金酸购自国药集团化学试剂有限公司.文中所用缓冲溶液为pH 7.0的磷酸盐缓冲液(PBS,30 mmol·L-1K2HPO4-KH2PO4+0.10 mol·L-1K2SO4).所有其它试剂均为分析纯或优级纯,且使用前未进一步处理.实验用水为Milli-Q超纯水(Millipore,≥18 MΩ·cm).所有实验在室温(约25 °C)进行.
2.2 实验步骤
2.2.1 Au、Aued/Au、MWCNTs/Au和Aued/MWCNTs/Au电极的制备
Au电极制备:用704硅橡胶将一压电石英晶片密封在聚氯乙烯(PVC)管的一端,使电极单面触液.为去除电极表面可能的杂质,在电极表面滴加浓硝酸后静置约10 s,然后用超纯水洗净,并用氮气吹干,如此重复三次.而后将电极置于0.20 mol·L-1HClO4中进行多圈的循环伏安(CV)实验,直至得到可重现的循环伏安图.这里,因为长时间的H2SO4处理对封制电极的704硅橡胶有一定的腐蚀作用,故选择HClO4.图1为新QCM电极第一次电化学处理时的CV曲线及频率响应.在第一圈中当电位从0 V往正扫描时,明显观察到在金氧化电位区间(1.0-1.5 V)内,出现较大的氧化电流和频率上升,表明厂家喷镀的电极表面有一些附着不牢固的金颗粒易于阳极溶出.本实验室10多年来一直能重复观察到这种QCM新鲜金电极的阳极溶出现象,本文为首次报道此现象.电位阴极回扫时,约0.8 V处有金氧化物还原的阴极峰,随后在0.6 V处有另一个较小的阴极峰,这是由于溶出的Au(III)在电极表面被还原.第二圈时电极表面不牢固的金原子的溶出电流明显降低,溶出的Au(III)在电极表面被还原的阴极电流也减少.约经过3圈CV扫描后,这些附着不牢固的表面金原子溶出殆尽,从而可观察到重现的CV曲线和QCM响应.13然后,将电极置于2.0 mmol·L-1K4Fe(CN)6+0.10 mol·L-1Na2SO4水溶液中进行电位环扫,氧化还原峰峰电位宽一般在85 mV以内(图2a),表明Au电极已处理干净.
Aued/Au电极制备:将处理好的Au电极置于含1.00 mmol·L-1氯金酸的0.10 mol·L-1H2SO4水溶液中,采用多电位阶跃法在初始电位0.8 V下运行2 s,阶跃至-0.3 V运行200 s进行电沉积.测量电沉积前后石英晶体的干频,根据频率差计算出电沉积Au的总质量(见表1).经扫描电镜表征(图3)表明所沉积的金为纳米颗粒(NP),分散较好.电沉积纳米金前后分别将电极置于2.0 mmol·L-1K4Fe(CN)6+0.10 mol·L-1Na2SO4水溶液中,在-0.1-0.5 V(vsSCE)电位区间环扫,镀金前后电极的电活性基本不变(图2a).
MWCNTs/Au电极制备:将1.00 mg MWCNTs超声分散于1.00 mL水中,得到均匀的黑色悬浊液,准确移取10.0 μL MWCNTs悬浊液滴干到Au电极表面,实时监测电极干燥过程的频率变化,室温下静置待水分挥发后充分水洗,MWCNTs可牢固附着在Au表面形成MWCNTs/Au.测量该电极滴加MWCNTs前后的干频和在2.0 mmol·L-1K4Fe(CN)6+0.10 mol·L-1Na2SO4水溶液中的循环伏安图(图2a),根据频率差计算附着的MWCNTs的质量(见表1).
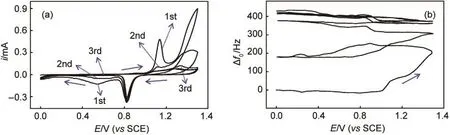
图1 QCM新电极在0.20 mol·L-1HClO4溶液中进行循环伏安处理的电流(i)(a)和频率(Δf0)(b)响应Fig.1 Current(i)(a)and frequency(Δf0)(b)responses during cyclic voltammetric treatment of a new QCM electrode in 0.20 mol·L-1HClO4aqueous solution

图2 四种电极(a)及它们的酶电极(b)在2.0 mmol·L-1K4Fe(CN)6+0.10 mol·L-1Na2SO4水溶液中的循环伏安图Fig.2 Cyclic voltammograms of four electrodes(a)and enzyme electrodes(b)in 2.0 mmol·L-1K4Fe(CN)6+0.10 mol·L-1 Na2SO4aqueous solution

表1 几种酶吸附电极的MSBAi,ERA和EAPi*Table 1 MSBAi,ERA,and EAPifor several GOx-adsorbed electrodes
Aued/MWCNTs/Au电极制备:MWCNTs/Au电极电沉积金的实验操作同前.经扫描电镜表征(图3),所镀金亦为纳米颗粒.测量压电石英晶体电极的干频,根据频率差分别计算滴干的MWCNTs、电沉积Au的质量和总质量变化(见表1).在2.0 mmol·L-1K4Fe(CN)6+0.10 mol·L-1Na2SO4水溶液中进行循环伏安实验(图2a).
用 SEM 表征了 Au、Aued/Au、MWCNTs/Au和Aued/MWCNTs/Au电极表面的形貌,如图3所示.Au电极表面相对光滑,而Aued/Au电极表面有白色的金纳米颗粒,平均尺寸约45 nm.MWCNTs/Au电极表面存在外壁光滑的MWCNTs;而Aued/MWCNTs/Au表面则可观察到MWCNTs上附有许多平均尺寸约30 nm的金纳米颗粒.
2.2.2 GOx的吸附
将Au、Aued/Au、MWCNTs/Au和Aued/MWCNTs/Au电极置于2.0 mL PBS(pH 7.0)溶液中,搅拌溶液待谐振频率稳定后,加入PBS配制的3.0 mg·mL-1GOx溶液1 mL使最终GOx浓度为1.0 mg·mL-1,继续实时记录QCM频率响应参数.待频率相对稳定,取出电极,充分水洗并在空气中风干,测量吸附前后QCM的干频之差,即别为吸附前后QCM的干频.据干频之差代入公式(3)计算吸附的GOx质量Δm.将酶电极置于2.0 mmol·L-1K4Fe(CN)6+0.10 mol·L-1Na2SO4水溶液中于-0.1-0.5 V间进行电位环扫(图2b).
由图2a可见,氧化还原峰的峰-峰电位宽满足Aued/MWCNTs/Au>MWCNTs/Au≥Aued/Au≥Au 的 顺序,峰 电 流 满 足 Aued/MWCNTs/Au>Au≥Aued/Au>MWCNTs/Au的顺序,两者的变化幅度都不大.峰电位变化幅度不大主要说明各纳米材料的导电性均很好;而峰电流变化幅度不大,是因为这里用到的电化学探针为可逆的电对,电对在电极表面的吸附效应也很小,其CV实验中得到的电解电流应该是扩散电流占绝对优势,故CV峰电流(应扣除背景电流)主要跟电极的几何面积成正比关系,而与这里有限的纳米材料修饰所带来的电极真实面积增大并无明显相关性.电容电流与电极的真实表面积成正比,而较明显的电容电流增大出现在Aued/MWCNTs/Au电极上,这表明先修饰MWCNTs再电沉积纳米Aued可相对更明显地增大电极的真实面积.由图2b可见,氧化还原峰的峰-峰电位宽满足GOx/MWCNTs/Au>GOx/Aued/MWCNTs/Au>GOx/Aued/Au>GOx/Au的顺序,而峰电流满足 GOx/Au>GOx/Aued/MWCNTs/Au>GOx/Aued/Au>GOx/MWCNTs/Au的顺序,这里的变化幅度明显大于无酶修饰的电极,且各电极经不导电的酶分子修饰后,峰电流都下降、峰峰电位宽都增加.以上结果表明各修饰步骤已完成.

图3 Au(a),Aued/Au(b),MWCNTs/Au(c)和Aued/MWCNTs/Au(d)电极表面的SEM图Fig.3 SEM images ofAu(a),Aued/Au(b),MWCNTs/Au(c),andAued/MWCNTs/Au(d)electrode surfaces
2.2.3 吸附态GOx用于催化氧化葡萄糖及其MSBAi和 EAPi的测量
将吸附GOx的电极置于10.0 mL PBS(pH 7.0)溶液中,搅拌,酶电极的安培检测以恒电位下底物加入前后稳态电流的变化作为响应电流.待电流达稳态后,加入不同浓度的葡萄糖(MSBAi测试采用20.0 mmol·L-1葡萄糖),在优化电位0.7 V下检测酶生H2O2的氧化电流.
将吸附GOx的电极置于10.0 mL PBS(除氧,pH 7.0)溶液中,在-0.7--0.2 V区间内进行电位环扫,得到各酶电极的直接电化学CV曲线图.由CV图的阳极峰电量和吸附酶的总质量,根据法拉第定律求算具有电活性的酶质量和吸附酶的电活性百分数.
3 结果与讨论
3.1 GOx的吸附动力学研究
描述蛋白质吸附动力学过程最简单的方法是考虑在电极/溶液界面发生的如下串联过程:18,其中第一个过程为直接吸附(速率常数和时间常数分别为k1和τ1);第二个过程为吸附层中分子结构重组或后续第二层吸附(速率常数和时间常数分别为k2和τ2),故蛋白质在电极表面吸附的频率响应(Δf0)可用2个指数函数之和来表示,19即
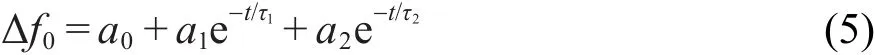
把 a0、a1、a2、τ1和τ2当作待估参数,采用作图软件 SigmaPlot®Scientific Graphing Software Version 10.0的非线性最小二乘拟合算法,拟合Δf0响应.为表征非线性拟合的质量,定义相对残差平方和qr如下:19

式中Δf0fit和Δf0exp分别代表拟合值和实验值,N代表响应信号的点数.
我们研究了GOx在Au、MWCNTs/Au、Aued/Au和Aued/MWCNTs/Au电极上的吸附情况,如图4所示.拟合结果(实线)与实验的频率响应(圆圈)非常一致,所得拟合参数列于表2.GOx吸附过程的动态电阻响应均不大,即使在MWCNTs上吸附后的-Δf0/ΔR1亦达123 Hz·Ω-1,明显大于纯粘密度效应的理论值(-Δf0/ΔR1=10 Hz·Ω-1),12表明频率响应主要为质量效应.
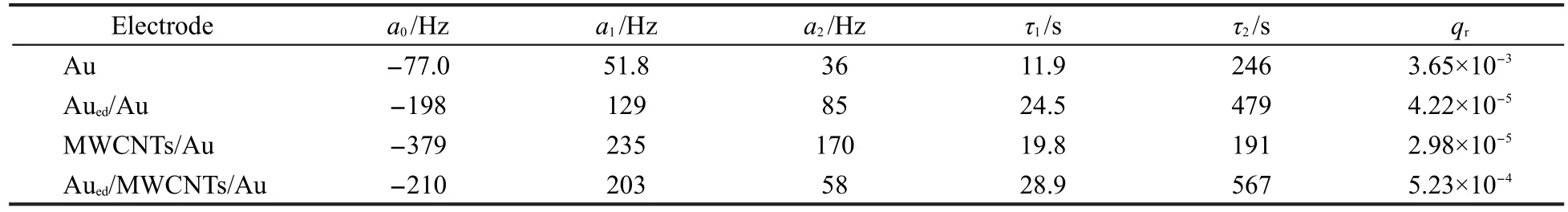
表2 按式(5)拟合图4实验中Δf0响应所得参数Table 2 Parameters obtained by fitting the experimental Δf0responses given in Fig.4 to Eq.(5)
a0为当吸附时间趋于∞时的频移(对应于吸附量),GOx在MWCNTs/Au电极上吸附量最大,Aued/MWCNTs/Au和Aued/Au电极上次之,Au电极上最少.电极表面积、憎水性和荷电性质等因素可影响GOx在电极表面的吸附.因MWCNTs修饰和电沉积金均增大了电极表面积,而MWCNTs与GOx之间有疏水作用,有利于蛋白质吸附,18故不难解释上述实验现象.
3.2 吸附态GOx的MSBAi和EAPi的比较考察
3.2.1 吸附态GOx的MSBAi
MSBAi定义为每克固定酶的酶活性,即在60.0 s内产生1.00 μmol H2O2对应的酶活性,由H2O2氧化电量评估.采用EQCM技术,微量固定酶的MSBAi,游离酶活性(MSBAn)和相对比活性(ERA)可如下计算:18

式中nH2O2为葡萄糖浓度足够大的饱和状态下、60.0 s酶反应生成的H2O2量,单位为μmol,ΔmGOx为吸附GOx的质量,单位为g,z为H2O2氧化过程中电子转移数(此处z=2),F为法拉第常数(96485.33 C·mol-1).ΔmGOx可据式(3)和干频移计算.
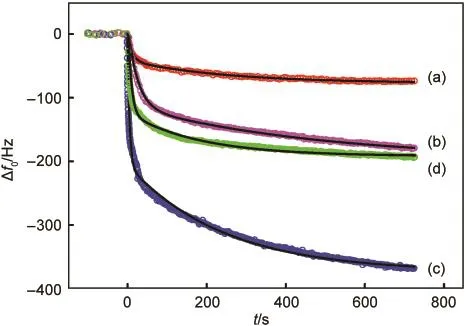
图4 四种电极表面对GOx吸附的Δf0响应Fig.4 Time courses of simultaneous Δf0responses to the GOx adsorption on four electrode surfaces
溶液中游离酶的比活性(MSBAn)求算如下.配制一系列不同浓度的H2O2溶液,在溶液搅拌条件下监测在0.7 V条件下Au电极上H2O2的氧化电流,绘制出工作曲线,求得线性回归方程为iH2O2=acH2O2+b;在10.0 mL PBS(pH 7.0)溶液中加入能使酶反应饱和的葡萄糖溶液,待电流稳定后加入10.0 mg GOx,在搅拌的条件下记录60.0 s时的电流响应为iH2O2(e).MSBAn可计算如下:

本文测得a=0.109,b=0.182,Vs=10.0 mL,iH2O2=4.3 mA,ΔmGOx=10.0 mg,由此可估算出MSBAn为37.7 kU·g-1.
GOx的酶相对比活性(ERA)定义如下:


图5 四种酶电极在PBS中对葡萄糖浓度的安培响应工作曲线Fig.5 Current responses of four enzyme electrodes as functions of glucose concentration in PBS
本文还考察了四种酶电极对葡萄糖响应的工作曲线(图5),并求得它们的灵敏度(S),检测下限(LOD,S/N=3)和线性检测范围(LDR).S满足GOx/MWCNTs/Au(2.94 mA ·mmol-1·L)>GOx/Aued/MWCNTs/Au(1.94 mA·mmol-1·L)>GOx/Aued/Au(1.75 mA·mmol-1·L)>GOx/Au(0.83 mA·mmol-1·L)的顺序;它们的LOD分别为GOx/Au:25 μmol·L-1,GOx/Aued/Au:13 μmol· L-1,GOx/MWCNTs/Au:14 μmol· L-1,GOx/Aued/MWCNTs/Au:9.8 μmol· L-1;LDR分别为GOx/Au:0.02-4.3 mmol·L-1,GOx/Aued/Au:0.02-3.1 mmol·L-1,GOx/MWCNTs/Au:0.02-2 mmol· L-1,GOx/Aued/MWCNTs/Au:0.02-2 mmol·L-1.吸附酶MSBAi受酶负载量、总酶活性(TEA,TEA=MSBAi×ΔmGOx)和电极表面传质影响.20本文为电极表面单层级吸附酶,电极表面传质好,故传质不会显著影响酶反应的进行.因此,本文中预期实验中的灵敏度应与吸附酶的总酶活性有正相关关系.根据表1算得总酶活性满足如下顺序:GOx/MWCNTs/Au(TEA=1.68 kU)>GOx/Aued/MWCNTs/Au(TEA=1.36 kU)>GOx/Aued/Au(TEA=1.2 kU)>GOx/Au(TEA=0.588 kU),该顺序与各酶电极的安培响应灵敏度的顺序一致,从而验证了预期的规律.
3.2.2 吸附态GOx的EAPi
吸附态酶的电活性百分数(EAPi)定义为具有电活性的酶质量(Δme,GOx)占吸附酶总质量(Δmt,GOx)的百分比,通过QCM监测酶饱和吸附的质量和CV法研究酶电极在PBS(除氧,pH 7.0)溶液中的直接电化学(图6),EAPi可如下计算:
EPAi=Δme,GOx/Δmt,GOx=(QGOxMGOx)/(zFΔmGOx)(10)式中QGOx为酶电极循环伏安图的阳极峰电量(μC),MGOx为酶的分子量(154000 g·mol-1),z为GOx氧化还原过程中的电子转移数(此处z=4).结果列于表1.

图6 四种酶电极在PBS溶液(除氧)中的循环伏安图Fig.6 Cyclic voltammograms of four enzyme electrodes in PBS(deoxygenated)
上述实验结果讨论如下:(1)金电极上修饰1.48 μg MWCNTs后,酶吸附质量由裸金电极上的0.124 μg 增加到了 0.608 μg,但 MSBAi由裸金电极的4.70 kU·g-1降低到2.76 kU·g-1,其ERA也从12.5%降到7.30%,但安培响应电流增大(图5(c)),因总酶活性增加的缘故;同时其EAPi和裸金电极相比有所增大(图6).这说明MWCNTs与GOx发生了某种作用(比如疏水作用),使吸附酶比活性降低,而其电活性的增大说明GOx在MWCNTs表面吸附后,可能发生一定的构象变化,使得深埋于酶分子内的电活性位点暴露出来;(2)QCM金电极上电沉积2.26µg金后,酶吸附量由裸金电极上的0.124 mg增加到了0.288 mg,吸附酶的MSBAi(4.20 kU·g-1)与裸金电极(4.70 kU·g-1)相比有所下降,其ERA也如此;同时其电活性百分数也稍有下降.这说明吸附在微/纳金颗粒上的GOx的酶比活性和酶构象变化较小,故电活性也变化不大;(3)金电极上修饰1.43 mg MWCNTs后再镀金2.15 mg后,酶吸附量和裸金电极相比有所增大,吸附酶的MSBAi增大到4.26 kU·g-1,也和Aued/Au电极基本一致;同时因MWCNTs的存在,吸附酶的电活性也变得较为明显.
4 结论
采用QCM技术监测了GOx在Au、Aued/Au、MWCNTs/Au和Aued/MWCNTs/Au电极上的吸附过程;测算了吸附酶的比活性和电活性.结果表明,GOx在各电极表面上均可快速吸附,且吸附态GOx均有一定的酶活性.四种酶电极上吸附酶的质量和安培响应满足GOx/MWCNTs/Au>GOx/Aued/MWCNTs/Au>GOx/Aued/Au>GOx/Au的顺序;MSBAi满足GOx/Au>GOx/Aued/MWCNTs/Au≥GOx/Aued/Au>>GOx/MWCNTs/Au的顺序;而 EAPi满足 GOx/MWCNTs/Au>GOx/Aued/MWCNTs/Au>>GOx/Au≥GOx/Aued/Au.根据酶和纳米材料的亲疏水作用以及酶的吸附量对实验结果进行了合理解释,也定量验证了电极上吸附酶分子的总生物活性与酶电极的安培响应呈正相关关系.以上结果表明,多壁碳纳米管在构建高性能葡萄糖生物传感器中能大大增加酶吸附量和电化学活性,但其具有不利于酶生物活性的特性,值得研究者特别注意.而镀金处理的电极能在一定程度上增大酶负载量,且对酶活性和电化学活性影响不大.我们认为,金和碳纳米材料的组合是比较好的酶固定纳米材料,本文工作将有助于纳米材料固定酶及其安培酶电极的研究.
(1) Wang,J.Electroanalysis 2001,13,983.
(2)Ianniello,R.M.;Yacynych,A.M.Anal.Chem.1981,53,2090.doi:10.1021/ac00236a033
(3)Chen,C.;Xie,Q.J.;Yang,D.W.;Xiao,H.L.;Fu,Y.C.;Tan,Y.M.;Yao,S.Z.RSC Adv.2013,3,4473.doi:10.1039/c2ra22351a
(4)Wang,J.Chem.Rev.2008,108,815.
(5)Alex,H.H.T.;Fabio,L.;Simone,R.S.;Gilberto,M.J.Phys.Chem.C 2012,116,18857.doi:10.1021/jp305633v
(6)Yang,C.;Xu,C.X.;Wang,X.M.Langmuir 2012,28,4580.doi:10.1021/la2044202
(7) Tellechea,E.;Wilson,K.J.;Bravo,E.;Schifferli,K.H.Langmuir 2012,28,5190.doi:10.1021/la2050866
(8)Jeong,B.;Akter,R.;Han,O.H.;Rhee,C.K.;Rahman,M.A.Anal.Chem.2013,85,1784.doi:10.1021/ac303142e
(9) Goran,J.M.;Mantilla,S.M.;Stevenson,K.J.Anal.Chem.2013,85,1571.doi:10.1021/ac3028036
(10)Wang,T.;Fu,Y.C.;Bu,L.J.;Qin,C.;Meng,Y.;Chen,C.;Ma,M.;Xie,Q.J.;Yao,S.Z.J.Phys.Chem.C.2012,116,20908.doi:10.1021/jp306492a
(11)Alwarappan,S.;Boyapalle,S.;Kumar,A.;Li,C.Z.;Mohaparea,S.S.J.Phys.Chem.C 2012,116,6556.doi:10.1021/jp211201b
(12) Xie,Q.J.;Wang,J.;Zhou,A.;Zhang,Y.Y.;Liu,H.;Xu,Z.;Yuan,Y.;Deng,M.;Yao,S.Z.Anal.Chem.1999,71,4649.doi:10.1021/ac981390z
(13) Xie,Q.J.;Xiang,C.;Yuan,Y.;Zhang,Y.;Nie,L.;Yao,S.Z.J.Colloid Interface Sci.2003,262,107.doi:10.1016/S0021-9797(03)00196-6
(14) Marx,K.A.Biomacromolecules 2003,4,1099.doi:10.1021/bm020116i
(15)Buttry,D.A.;Ward,M.D.Chem.Rev.1992,92,1355.doi:10.1021/cr00014a006
(16) Sauerbrey,G.Z.Phys.1959,155,206.doi:10.1007/BF01337937
(17) Kanazawa,K.K.;Gordon,J.G.Anal.Chem.Acta 1985,175,99.doi:10.1016/S0003-2670(00)82721-X
(18)Chen,X.;Zhang,Q.L.;Su,Y.H.;Meng,W.H.;Xie,Q.J.;Yao,S.Z.Acta Phys.-Chim.Sin.2007,23,1201.[陈 昕,张漪丽,苏育华,孟文华,谢青季,姚守拙.物理化学学报,2007,23,1201.]doi:10.3866/PKU.WHXB20070812
(19) Xie,Q.J.;Zhang,Y.Y.;Xu,M.C.;Yao,S.Z.J.Electroanal.Chem.1999,478,1.
(20) Fu,Y.C.;Li,P.H.;Bu,L.J.;Wang,T.;Xie,Q.J.;Chen,J.H.;Yao,S.Z.Anal.Chem.2011,83,6511.doi:10.1021/ac200471v

