离子液体双水相体系及其在蛋白分离中的应用
刘晓庚 高 梅 陈梅梅
(南京财经大学食品科学与工程学院1,南京 210046)
(江苏省粮油品质控制及深加工技术重点实验室2,南京 210046)
(南京财经大学图书馆室3,南京 210046)
离子液体是近十年来迅速发展起来的一种全新绿色介质和功能材料。离子液体具有不易挥发、不可燃、稳定性高、溶解能力强、功能可调节等优点,其应用领域正不断地扩大,从开始的化学合成发展到今天的材料科学、环境科学、工程技术、分析测试、生物催化等领域,其独特的性质和广泛的应用前景使其迅速发展起来[1-3]。离子液体在萃取分离生物物质方面表现出优异的性能,已有不少文献报道了离子液体可形成双水相体系[4],这无疑会开拓一种新的绿色分离技术。离子液体具有一般离子溶液所没有的独特性能,如不挥发性、热力学稳定性和强溶解性等的特点,这些特点不仅拓宽了离子液体的应用范围,而且为寻找一种更为高效、绿色的生物分离技术提供了依据[5],使其在生物活性物质的分离上展现了十分诱人的应用前景。
1 离子液体双水相的研究
离子液体双水相体系(Ionic liquids aqueous two-phase system,ILATPS)一般是由亲水性离子液体、无机盐(如磷酸盐、碳酸盐、氢氧化物等)和水形成的双水相体系,它综合了离子液体和双水相体系的优点[6]。作为一种高效的新型绿色分离体系,与传统聚合物双水相体系相比,离子液体双水相具有黏度低、分相快、不易乳化、萃取率高、离子液体可以循环利用等优点,因此越来越受到学术界及产业界的重视[7]。
1.1 离子液体双水相体系的类型
ILATPS的形成是 2002年 Dupont等[8]在用 C4mimCl和KBF4合成离子液体C4mimBF4时首次发现由于盐析效应在KCl存在下使C4mimBF4和水形成两相的现象。Gutowski等[9]2003年首次提出了ILATPS的概念,并研究了亲水性离子液体[C4mim]Cl(氯化1-丁基-3-甲基咪唑)与K3PO4能够形成上相富集离子液体和下相富集磷酸钾的双水相体系,同时预言了该体系在萃取分离上有极好的应用前景。此后,离子液体形成双水相新体系及其应用的报道如雨后春笋层出不穷(表1),但仍以磷酸盐类的成相效果最好且应用最广。另外,陈玉焕等[10]发现亲水性离子液体[Bmim]BF4和糖也可以形成双水相体系。
1.2 几种典型离子液体双水相体系的特点及应用概况
双水相体系的主要类型有:高聚物/高聚物、高聚物/无机盐、亲水有机物/盐体系等[7]。近年来该技术又有了新的发展,出现了ILATPS。人们对该体系也做了相应的尝试性研究,其中研究比较多的是离子液体/盐体系。据与离子液体形成双水相体系的对象不同可以将其分为如表2所示的3种类型。

表1 离子液体/盐双水相体系的主要类型

表2 离子液体双水相主要类型及特点
离子液体-无机盐双水相体系的分相过程实质上是一个无机盐与离子液体竞争夺取水分子的过程,其分相能力与离子液体的水化能力和无机盐的盐析能力密切相关,离子液体的水化能力越大分相能力越差,而无机盐的盐析能力越大其分相能力越强[11]。
1.3 近年来离子液体双水相的文献统计分析与研究发展趋势
有关ILATPS的文献是在2012年2月分别在《中国知网》和《Elsevier》数据库中以“离子液体双水相”及“Ionic liquids aqueous two-phase”为题名检索所得。这些文献反映了国内外2012年以前ILATPS研究的主要成就,其内容包括综合论述、基础研究及萃取分离分析研究等。
离子液体双水相的研究主要是从近几年开始的,剔除非学术性论文,共收集2005年以来有关离子液体双水相的期刊文献共65篇,其中外文文献21篇,年平均文献量为10.8篇(表3)。国内外关于ILATPS的研究文献是从2005年才见报道,且2010年以来发展迅猛,共有35篇,占总文献的53.85%。ILATPS的文献主要研究方向为萃取分离分析,占总文献的73.85%。刊载ILATPS研究论文文献的刊物达50种,且以化学工业类刊物居多,占期刊总数的70%以上。

表3 离子液体双水相文献统计分布
由表3看出,分离分析研究在ILATPS研究中占据主要地位,且在整个检索的年段间,ILATPS研究内容也侧重于萃取分离分析研究。在萃取分离研究中,侧重于对蛋白质[19]、氨基酸[20]、糖类[15]等生物活性物质的萃取分离,尤其是对药物中的生物活性成分物质的萃取分离研究和药物活性成分的残留分析研究更为突出。原因是ILATPS具有分相时间短、黏度低、萃取过程不易乳化、萃取率高、分离条件温和、对生物活性物质钚破坏且离子体系可以且易回收利用等优点,因此,离子液体双水相这一新的萃取分离体系,开辟了生物分离工程的应用新天地。
2 离子液体双水相萃取分离蛋白质的研究
2.1 离子液体双水相体系的成相机理
离子液体双水相主要由离子液体、辅助盐和水3种组分构成。从相的组成及其相互作用的角度影响ILATPS形成的主要原因包括盐析效应、疏水相互作用、静电作用及氢键等。
2.1.1 盐析效应影响
作为双水相体系的重要组成部分,无机盐的性质对双水相体系的相平衡具有重要的影响。Gutowski等[9]和 Collins[21]认为这种现象是由于憎溶剂效应所致。辅助盐可能起着非特征性的盐析作用,以渗透压作用推动双水相的形成。Gutowski等[9]研究认为,形成离子液体双水相的主要原因是K3PO4的盐析效应。盐的水合自由能(ΔG水合)是控制离子液体和K3PO4的分相效率的主要因素,该研究小组将离子液体双水相的成相机理解释为:由于PO43-离子的存在,使其周围水分子处于电子压缩状态,这样就增强了富盐相中水分子之间的氢键网络结构。因此,要想形成较大的容纳离子液体阳离子[C4mim]+的水分子空腔就需要更大的能量,当PO43-的浓度达到一定程度时,体系就会出现较多的疏水性离子液体阳离子和较少的水合Cl-离子单独形成一相,这个机理和聚乙二醇-盐体系的成相机理一致[22]。Trindade等[23]通过研究无机盐 NaCl、Na2SO4和 Na3PO4与离子液体[C4mim]BF4的成相行为,结果表明这3种无机盐与离子液体均是通过盐析效应使体系形成互不相溶的两相,且无机盐盐析效应的能力取决于离子强度(I)及无机盐水合自由能(ΔG水合)的大小。
2.1.2 疏水相互作用
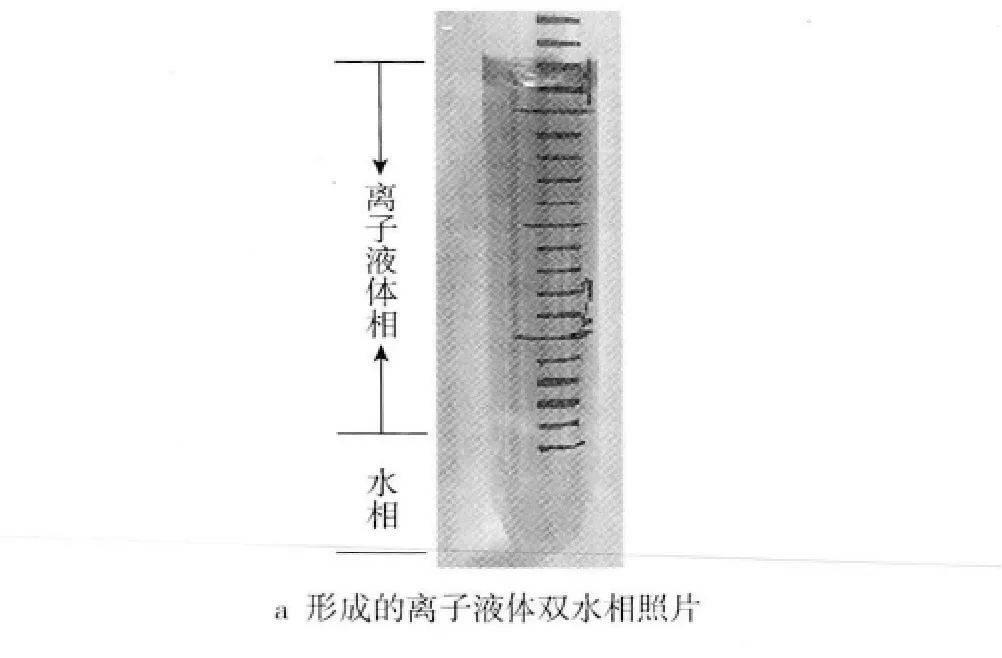
离子液体分子可看成是由疏水和亲水两部分组成。疏水部分在水溶液中聚集成核,亲水部分向外张开形成胶束。热力学研究表明,疏水相互作用是离子液体双水相体系形成的主要驱动力[24]。在离子液体与水的混合体系中,其主导的作用是阴离子与水分子之间的相互作用,在阴离子周围的水分子力学远大于阳离子周围的水分子,也就是说,对于离子液体和水的混合体系,阴离子与水之间的相互作用远大于阳离子与水之间的相互作用,即阴离子与水之间的相互作用占主导地位[25]。而由于离子液体中阳离子的体积较大,导致阴阳离子间的相互作用减弱,离子液体在水中主要以分隔离子对的形态存在,头部的疏水作用会改变阴离子与头部间的作用力,增加离子液体内部的凝聚性形成较大尺寸的胶束,从而引发相区分隔和有序分子聚集体的形成,进而形成双水相(图1)。聚集行为发生时,因疏水作用相结合的离子液体分子的脱落,导致了体系熵增加(ΔS>0),而自由能减小(ΔG <0),因而这成为聚集体形成的直接驱动力。

2.1.3 氢键作用
离子液体双水相形成的另一个重要的作用是氢键,离子液体中的氮杂环与水可以形成N-H…NH、N-H…O-H等氢键网络。这样一个在亲水极性区形成的网络结构可以增加离子液体阳离子头基的亲水性,使其在极性区稳定地存在,从而使离子液体具有合适的两亲性质,促进层状相溶致液晶的形成[26]。另外,由咪唑环引起的π-π相互作用也可以促进分子层状排列[27],有利于形成层状相溶致液晶。如咪唑环上的3个质子均能和水分子形成稳定的氢键作用,这些作用的相互结合与促进就导致了此体系在很宽的浓度范围内形成有序的层状相溶致液晶[25]。
2.1.4 热力学解释
另外,刘庆芬等[28]研究表明高温不利于短链离子液体双水相的形成。但高温有利于长链离子液体双水相的分离,这与离子表面活性剂盐溶液形成长条胶团的性质非常接近[29],说明长链离子液体主要依靠焓变(ΔH)来实现相分离。相分离发生的本质在于同组分间比不同组分间具有更强的引力相互作用,而该相互作用可通过某组分的相互作用焓变和相互作用熵变作出定性解释,相分离时相互作用熵变表现为吸引相互作用,是导致高温相分离的重要因素,而相互作用焓变则表现为斥力相互作用,它将导致体系具有很好的低温混溶效果[30]。
2.2 离子液体双水相萃取蛋白质机理
离子液体双水相萃取分离蛋白质属于液-液萃取,其原理与水-有机相萃取的原理相似。当蛋白质进入双水相体系后,由于表面性质、电荷作用和各种力(如憎水键、氢键和离子键等)的作用和溶液环境的影响,使其在上、下相中的浓度不同,即各成分在两相间的选择性分配,从而达到萃取分离的目的。蛋白质与离子液体作用,主要有盐析作用;与辅助萃取剂发生配位作用生成配合物,配合物被萃取到离子液体中;或者调节pH,使蛋白质的疏水基团暴露出来,从而萃取到离子液体中等。
Tani等[31]研究发现血红素蛋白(细胞色素C)在合适的辅助萃取剂存在下,生成的配合物可被萃取到离子液体中。用冠醚(DCH18C6)为萃取剂,以离子液体C2OHmimTf2N为溶剂,发现血红蛋白(细胞色素C)与DCH18C6发生配位作用,实现了离子液体对细胞色素C的萃取,从而实现了细胞色素C在合适辅助萃取剂下用离子液体双水相进行分离纯化的目标。由Du等[32]用离子液体BmimCl与KH2PO4组成的双水相体系对牛血清蛋白进行的进一步萃取分离研究,结果表明牛血清蛋白被萃取到离子液体相中的主要机理就是盐析效应,离子液体与蛋白质本身并没有发生化学作用。
通过热力学研究表明,虽然静电相互作用[33]和盐析作用是蛋白质在双水相中转移的力量,但疏水相互作用是其主要驱动力[34]。蛋白质中的疏水侧链残基一直被认为是蛋白质的活性位点,参与和其他分子的相互作用,这样而产生的疏水相互作用可以引起疏水链进入到离子液体的疏水区,水、离子液体和蛋白质的羧酸根在亲水区分别进行聚集,从而引发相区分隔和蛋白质分子的转移。程德红[35]研究表明在酸性条件下,细胞色素C构型发生转变,疏水性基团暴露出来,促使细胞色素C被萃取到离子液体中;当溶液pH<2时,细胞色素C中血红素基团的铁原子与甲硫氨酸的第6个配位键断裂,提供一个空的配位位置,与离子液体的咪唑阳离子发生配位作用,从而促使细胞色素C进入离子液体中。王键吉等[36]测定了[C4mim]Br/K2HPO4体系中氨基酸侧链上的亚甲基从富盐相到富离子液体相的转移自由能(ΔGCH2)。结果表明,此时,当ΔGCH2<0,说明富离子液体相的疏水性比富盐相要强。随着系线长度的增长,ΔGCH2值降低,所以当氨基酸在两相间分配时,更容易转移到富离子液体相,它的分配系数也逐渐增大。
另一个重要的作用是氢键相互作用,不仅离子液体中的氮杂环和蛋白质可以形成氢键,水与离子液体、蛋白质也均可以形成氢键网络。这样一个在亲水极性区形成的网络结构可以增加蛋白质的亲水性,使其在极性区稳定地存在,从而促进蛋白质在两相间的转移。
2.3 离子液体双水相萃取分离蛋白质的实例
离子液体/盐双水相萃取技术是双水相萃取技术一个新的分支,它具有传统双水相技术所不具备的诸多优点,如操作简单、无污染、分离效率高、可控制乳化、可循环使用离子液体等[37]。离子液体双水相萃取技术在蛋白质分离纯化领域研究和应用发展较快。现将近年来国内外离子液体双水相萃取分离蛋白质/酶的研究列于表4。
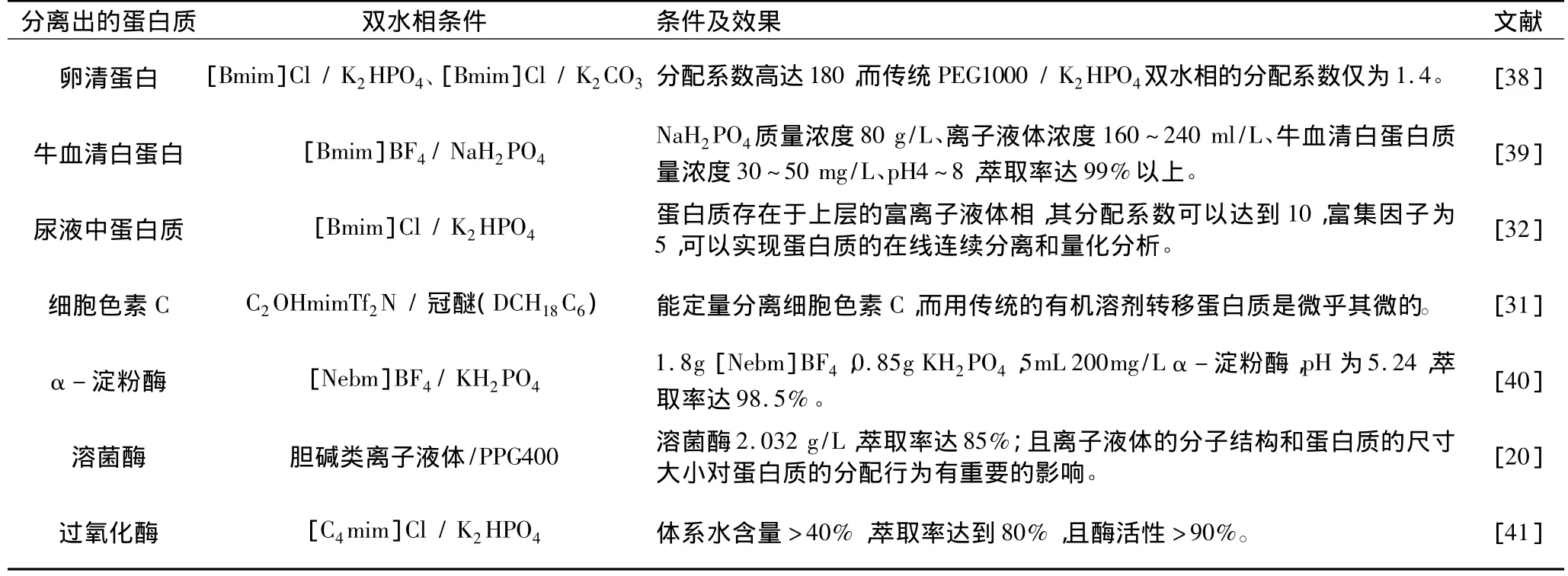
表4 离子液体双水相萃取分离蛋白质的几个应用实例
从表4的应用实例表明,离子液体双水相萃取在分离纯化蛋白质方面日新月异、日臻致善,发展迅速,而与其它方法相比,具有高效、环保且维持其生物活性的特强等优势,特别适合生物活性物质的分离,为分离纯化蛋白质开辟了一个崭新天地。
3 结束语
ILATPS用于萃取分离方面的研究还处于研究与工业应用的起步阶段,虽然目前已有一些研究应用的报道,但人们对分离体系中各组分在ILATPS中与离子液体的相互作用、各组分的分配情况及其机理的了解还不深入和全面,因此迫切需要对ILATPS萃取分离方面进行系统的理论和应用研究,使之形成完善的体系。同时,离子液体使用对环境和生态的安全性,以及残留测定及对人类的危害等安全性问题都有待深入研究;另外,开发出具有特殊功能的离子液体,提高和改善离子液体自身的性能以满足特定的分离技术要求,同时ILATPS中各组分的回收利用等问题也值得进一步完善。
以离子液体作为萃取溶剂进行萃取分离可以减少有机溶剂带来的环境污染及对操作人员的危害,因此,用离子液体替代传统的有机溶剂用于生命物质中DNA、蛋白质、酶等活性物质的分离是重点发展方向,同时,离子液体在分离技术环保和能源领域的煤炭脱硫、石油加工、新型锂电池的改进等方面都在发挥着异军突起的独到作用。相信随着离子液体研究的深入,离子液体的分离技术必将越来越成熟,也使ILATPS日渐改善,为社会主义建设发挥更大作用。
[1]Dyson P J,Geldbach T J.Metal catalysed reactions in ionic liquids[M].Netherlands:Springer,2005
[2]Wasserscheid P,Welton T.Ionic Liquids in Synthesis[M].Weinheim:Wiley-VCH,2003
[3]Ohno H.Electrochemical aspects of ionic liquids[M].Weinheim:Wiley-VCH,2005
[4]张锁江,吕兴梅.离子液体 -从基础研究到工业应用[M].北京:科学出版社,2006
[5]张英锋,李长江,包富山,等.离子液体的分类、合成与应用[J].化学教育,2005,26(2):7-12
[6]徐晓冬,丹媛媛,李欣欣,等.离子液体双水相体系及其在生物分离中的应用[J].生物技术通报,2008,(5):88-91
[7]刘培元,王国平.离子液体/盐双水相萃取技术的研究进展[J].化学工程与装备,2008,(3):113-118
[8]Dupont J,Consorti C S,Suarez P A Z,et al.In Organic Syntheses[M].Hegedus L S,Ed.John Wiley:Chichester,2002,79
[9]Gutowski K E,Broker G A,Willauer H D,et al.Controlling the aqueous miscibility of ionic liquids:aqueous biphasic systems of water-miscible ionic liquids and water-structuring salts for recycle,metathesis,and separations [J].J.Am.Chem.Soc.,2003,125:6632 -6633
[10]陈玉焕,张锁江,张建敏,等.新型的双水相体系:离子液体 -糖体系:中国,200410078283.[P].2006 -03 -29
[11]刘术军.离子液体-盐-水新型双水相体系的液液相平衡及其应用[D].沈阳:辽宁大学,2005
[12]Barrosse - Antle L E,Silvester D S,Compton R G,et al.Electroreduction of Sulfur Dioxide in Some Room-Temperature Ionic Liquids[J].Phys.Chem.C,2008,112:3398 -340
[13]Ana Soto,Alberto Arce,Mohammad K,et al.Partitioning of antibiotics in a two-liquid phase system formed by water and a room temperature ionic liquid [J].Separat.Technol.,2005,44:242 -246
[14]那吉,杨青海,董学畅,等.离子液体[BPy]BF4双水相萃取芦丁的研究[J].云南化工.2008,35(3):36 -37
[15]李志勇,王键吉,裴渊超,等.离子液体双水相用于糖和蛋白质的选择性分离[J].河南师范大学学报:自然科学版,2010,38,(2):187
[16]陈莉莉,邱祖民,黄金莲,等.PMBP 缩2 -ABT/TBP/离子液体双水相对稀土离子的协同萃取[J].稀土,2011,32(3):68-71
[17]Li SH,He CY,Liu H W,et al..Ionic liquid - based aqueous two-phase system,a sample pretreatment procedure prior to high-performance liquid chromatography of opium lkaloids[J].Chromatogr.B,2005,826:58 -62
[18]豆甲立,傅式洲,刘九强.等.离子液体和表面活性剂形成的双水相及其萃取性能[J].日用化学工业,2010,40(4):246-249
[19]邓凡政,郭东方.离子液体双水相体系萃取分离牛血清白蛋白[J].分析化学,2006,34(10):1451-1453
[20]李志勇.离子液体双水相对某些生物物质的萃取分离性能研究[D].新乡:河南师范大学,2010
[21]Collins K D.Stricky ion in biological systems[J].Proc.Natl.Acad.Sci.,1995,92:5553 -5557
[22]孙晨.双水相萃取技术在食品工业中应用[J].粮食与油脂,2011(9):6-8
[23]Trindade J R,Visak Z P,Blesic M,et al.Salting - out Effects in Aqueous Ionic Liquid Solutions:Cloud-Point Temperature Shifts[J].Phys.Chem.B,2007,111:4737 -4741
[24]裴渊超.离子液体的萃取分离性能及与溶质的相互作用研究[D].兰州:兰州大学,2008
[25]张胜梅.离子液体[Bmim]Cl在水中PMF的分子动力学模拟[D].北京:北京化工大学,2011
[26]马福明.基于质子化离子液体和氮杂环化合物的有序分子聚集体构建及性能研究[D].济南:山东大学大学,2010
[27]Wang Q M,Bruce D W.Control of intermolecular porphyrin pi-pi interactions:Low-melting liquid-crystal porphyrins with calamitic mesophases[J].Chem.Commun.1996,(22):2505-2506
[28]刘庆芬,夏寒松,余江,等.离子液体相行为(Ⅱ)双水相的成相规律[J].化工学报,2006,57(9):2149 -2151
[29]Nikas Y J,Liu CL,Srivastava T,et al.Protein partitioning in two - phase aqueous nonionic micellar solutions[J].Macromolecules,1992,25:4797 -4806
[30]王键吉,赵扬,卓克垒,等.室温离子液体混合物的相平衡研究进展[J].化学进展,2006,18(5):670-679
[31]Tani F,Naganawa H,Goto M,et al.Extractive solubilization,structural change,and functional conversion of Cytochromec in ionic liquids via crown ether complexation [J].Anal.Chem.,2006,78(22):7735 -7742
[32]Du Z,Yu YL,Wang JH.Extraction of Proteins from biological fluids by use of an ionic liquid/aqueous two-phase system [J],Chemistry - A European Journal,2007,13(7):2130-2137
[33]Luciana I N Tomé,Vítor R Catambas,Ana R R Teles,et al.Tryptophan extraction using hydrophobic ionic liquids[J].Sep.Purif.Technol.,,2010,72(2):167 - 173
[34]Pei Y C,Wang JJ,Wu K,et al.Ionic liquid - based aqueous two - phase extraction of selected proteins[J].Sep.Purif.Technol.,2009,64(3):288 -295.
[35]程德红.离子液体用于核酸和蛋白质萃取分离及富集研究[D].沈阳:东北大学,2008
[36]王键吉,李志勇,刘欣欣,等.离子液体双水相对氨基酸的萃取分离性能[C].成都:中国化学会第28届学术年会摘要集,2012
[37]Seddon K R,Stark A,Torres M J.Influence of chloride,water,and organic solvents on the physical properties of ionic liquids[J].Pure Appl.Chem.,2000,72(12):2275 -2280
[38]Ruiz - Angel M J,Pino V,Carda - Broch S,et al.Solvent systems for countercurrent chromatography:An aqueous two phase liquid system based on a room temperature ionic liquid[J].Chromatogr.A,2007,1151(1 -2):65 -73
[39]邓凡政,郭东方.离子液体双水相体系萃取分离牛血清百蛋白[J].分析化学,2006,34(10):1451-1453
[40]王军,张艳,时召俊,等.N-乙基-N-丁基吗啉离子液体双水相体系萃取分离蛋白质[J].应用化工,2009,38(1):70-72
[41]Cao Q,Quan L,He CY,et al.Partition of horseradish peroxidase with maintained activity in aqueous biphasic system based on ionic liquid[J].Talanta,2008,77(1):160 -165.

