不同类型树脂对4种丹参酚酸类成分的动态吸附研究
郑云枫, 黄 利, 魏娟花, 彭国平, 李贺敏, 程建明
(南京中医药大学药学院,江苏南京210029)
丹参为唇形科植物丹参Salvia miltiorrhiza Bge.的干燥根及根茎[1],是著名的活血化瘀中药,其水溶性活性成分主要包括丹参素、原儿茶醛、丹酚酸A、B、C、D等丹参酚酸类成分 (salvianolic acid),临床已用于冠心病等心血管疾病的治疗[2-3]。
传统丹参酚酸的精制分离常采用醇沉法或萃取法,近些年树脂吸附法因其高效、宜于工业化等优点而被广泛使用,但已有的研究大多集中于单一大孔树脂吸附[4-6],且评价指标往往采用单个成分或总酚酸 (分光光度法检测),缺乏系统性或专属性。
本实验选取了丹参中4种代表性丹酚酸类化合物:丹参素 (danshensu)、原儿茶醛 (protocate chualdehyde)、丹酚酸D(salvianolic acid D)和丹酚酸B(salvianolic acid B)为考察指标,采用高效液相色谱法,分别考察了大孔树脂、聚酰胺树脂及阴离子交换树脂对各丹酚酸类化合物的动态吸附分离特性,为建立不同类型树脂联用制备丹参酚酸的必要性和可行性提供依据。
1 仪器与材料
Agilent 1100高效液相色谱仪,Agilent色谱工作站 (美国安捷伦科技有限公司);TGL—16G高速离心机 (上海安亭科学仪器厂);1810—D型自动双重纯水蒸馏器 (上海申生科技有限公司);BT—220S电子天平 (赛多利斯科学仪器有限公司);玻璃色谱柱 (1.5 cm×40 cm,南京恩赐化玻有限公司)。
丹参提取物 (丹参滴注液中间体)由上海华源安徽锦辉制药提供,批号:05120209;对照品:丹参素钠 (批号:0855-200102)、原儿茶醛 (批号:110810-200205)、丹酚酸 B(批号:111562-200807)对照品购自中国生物药品检定所,供定量测定用,纯度>98%;丹酚酸D对照品 (实验室自制,纯度>98%)。树脂类型:大孔吸附树脂(AB-8,南开大学化工厂);聚酰胺树脂 (国药集团化学试剂有限公司);阴离子交换树脂 (201×7,沧州宝恩化工有限公司)。乙腈 (色谱纯,fisher有限公司);冰醋酸 (色谱纯,天津市北辰方正试剂厂);乙醇为分析纯;实验用水经自动双重纯水蒸馏器处理。
2 方法与结果
2.1 高效液相色谱条件[7]Kormasil C18色谱柱(250 mm×4.6 mm,5μm);流动相为乙腈 (A)和1%冰乙酸 (B)进行梯度洗脱,0~20 min,5% ~15%A,20~50 min由15% ~40%A;进样量10μL;柱温30℃;检测波长281 nm;体积流量1.0 mL/min。在此色谱条件下,各峰分离良好,见图1。
2.2 对照品溶液的配制及线性关系 精密称取丹参素钠(20.12 mg),原儿茶醛 (2.05 mg),丹酚酸D(15.16 mg),丹酚酸B(15.10 mg)对照品,20%乙腈水溶液定容至25 mL,备用。
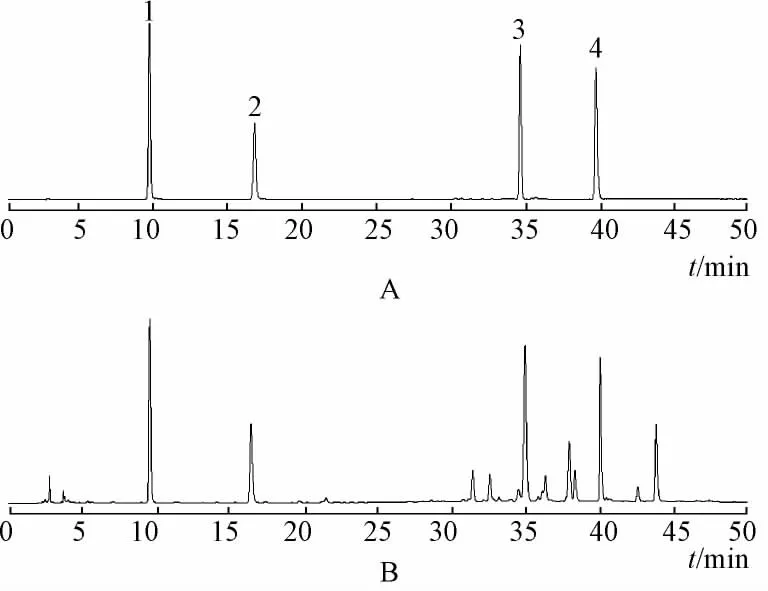
图1 对照品与供试品溶液的色谱图Fig.1 HPLC chromatograms of reference and samples
精密量取对照品溶液,采用倍比稀释法,分别制成系列质量浓度的溶液,吸取上述系列溶液各10μL,按2.1项下色谱条件进样分析,测定峰面积。以峰面积 (Y)为纵坐标,对照品质量浓度(X)为横坐标,进行线性回归,回归方程分别为丹参素钠:Y=6.456 8 X-6.234 1(R2=0.999 8);原儿茶醛:Y =44.246 3 X-9.146 9(R2=0.999 6);丹酚酸 D:Y=10.673 2 X-11.021 7(R2=0.999 6);丹酚酸B:Y=11.107 8 X-4.583 0(R2=0.999 7)。结果表明,丹参素钠、原儿茶醛、丹酚酸D、丹酚酸B分别在50.3~804.8μg/mL、5.1~82.0μg/mL、37.9~606.4 μg/mL、37.8~604.0μg/mL范围内与其峰面积积分值呈良好的线性关系。
2.3 供试品溶液的配制及定量测定结果 丹参提取物 (500 mL),加蒸馏水稀释至10 L,过滤,即得供试品溶液,4℃避光贮藏,备用。精密量取供试品溶液5.0 mL,置于10 mL量瓶中,用20%乙腈水溶液稀释至刻度,摇匀,0.45μm微孔滤膜滤过,取续滤液,HPLC分析,并以2.2项下回归方程计算质量浓度。结果显示供试品溶液中,丹参素质量浓度为0.462 mg/mL,原儿茶醛质量浓度为0.030 mg/mL,丹酚酸 D质量浓度为 0.335 mg/mL,丹酚酸B质量浓度为0.274 mg/mL。
2.4 树脂预处理 大孔吸附树脂:取大孔树脂先用2 BV(1 BV为1个柱床体积)2 mol/L的氢氧化钠溶液洗涤,以蒸馏水洗至中性;再用2 BV的2 mol/L的盐酸溶液洗涤,以蒸馏水洗至中性;再用95%乙醇洗涤,检查流出的乙醇液,至乙醇液与水混合 (1∶5)无白色浑浊为止,最后以蒸馏水洗至无醇味。
聚酰胺树脂:取聚酰胺树脂,用蒸馏水浸泡24 h,先用2 BV的2 mol/L的氢氧化钠溶液洗涤,以蒸馏水洗至中性;再用2 BV的2 mol/L的盐酸溶液洗涤,以蒸馏水洗至中性;再用95%乙醇洗涤,检查流出的乙醇液,至乙醇液与水混合 (1∶5)无白色浑浊为止,最后以洗至无醇味。
阴离子交换树脂:取阴离子交换树脂,用蒸馏水浸泡24 h,并用蒸馏水洗至水液澄清,倾去水后加1 mol/L的盐酸溶液浸泡24 h,水洗至中性,最后加入1 mol/L的氢氧化钠溶液浸泡24 h,并用水洗至中性。
2.5 丹参酚酸在不同类型树脂上的动态吸附研究
分别取25 mL处理好的大孔树脂 (干树脂量为6 g),聚酰胺树脂 (干树脂量为5 g)和阴离子交换树脂 (干树脂量为6 g),装柱 (1.5 cm×14 cm,1 BV=25 mL),水洗,另取供试品溶液500 mL 3份,以1 mL/min的体积流量通过以上3种树脂柱,流出液分份收集,每25 mL为1流份,HPLC测定流出液中各成分浓度,实验重复2次,取平均值,绘制3种树脂对4种丹参酚酸类化合物的动态泄漏曲线。见图2。从图中可以看出,大孔树脂和聚酰胺树脂对4种酚酸类成分的泄漏曲线较为相似:对丹参素几乎不吸附,对原儿茶醛的吸附效果也并不理想,且两者的泄漏速率较快;对丹酚酸D及丹酚酸B的吸附效果较好,泄漏速率相对平缓。而阴离子交换树脂的吸附特征与以上两种树脂不同,对丹参素及原儿茶醛的吸附效果明显强于极性较小的丹酚酸D及丹酚酸B。
饱和吸附量:以流出液中药物质量浓度超过供试品溶液中药物质量浓度的5%时,可认为树脂对于该药物成分的吸附已达到饱和[8],此时的上样体积也可称为泄漏体积。不同类型树脂对各成分的饱和吸附量可按以下公式计算。
饱和吸附量=(供试品药物质量浓度×泄漏体积)/干树脂质量。
结果见表1。从表中可以看出,丹酚酸D和丹酚酸B在大孔树脂上的饱和吸附量最高,为22.3 mg/mL和27.4 mg/mL,聚酰胺树脂与之相似,但阴离子交换树脂对这两种成分的吸附量较低,仅有大孔树脂的1/4~1/6;而丹参素和原儿茶醛在阴离子交换树脂上的饱和吸附量较高,分别达30.8 mg/g和3.2 mg/g,分别是另外两种树脂的6倍和3倍。
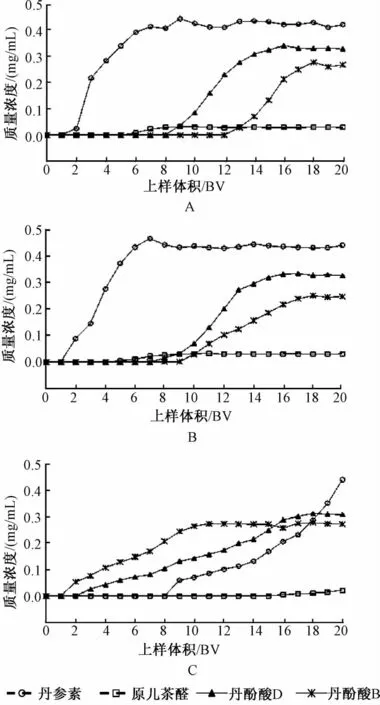
图2 4种丹参酚酸在不同类型树脂上的泄漏曲线Fig.2 Adsorption leaking curves of four salvianolic acids on different adsorbent resins
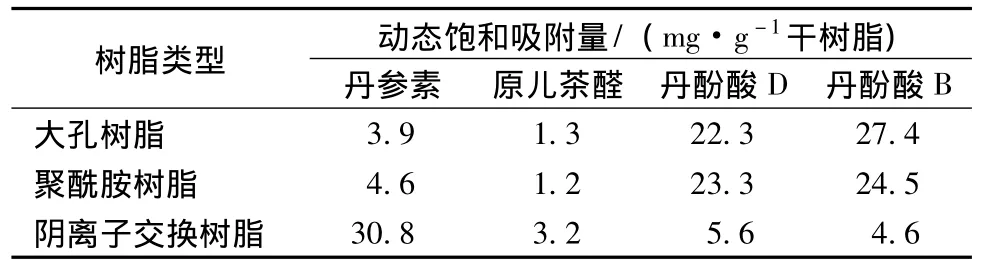
表1 不同类型树脂对4种丹参酚酸的动态饱和吸附量Tab.1 Dynam ic adsorption capacity of four salvianolic acids on different adsorbent resins
2.6 丹参酚酸在不同类型树脂上的动态解吸附研究 分别取25 mL体积处理好的大孔树脂 (干树脂量为6 g),聚酰胺树脂 (干树脂量为5 g)和阴离子交换树脂 (干树脂量为6 g),装柱 (1.5 cm×14 cm,1 BV=25 mL),水洗,另取供试品溶液150 mL(6 BV)三份,以1 mL/min的体积质量通过以上3种树脂柱。将吸附后的树脂,依次用水,10%、20%、40%、60%、80%乙醇 (各 3 BV),以1 mL/min体积流量洗脱,洗脱液分份收集,每25 mL(1 BV)为1流份,HPLC测定,实验重复2次,取平均值,绘制不同树脂对4种丹酚酸类化合物的动态解吸附曲线。见图3。并按以下公式计算未超过树脂饱和吸附量的化合物解吸附率。
解吸率 (%)=(洗脱液体积分数×洗脱液体积)/(供试品液体积分数×上样体积)×100%
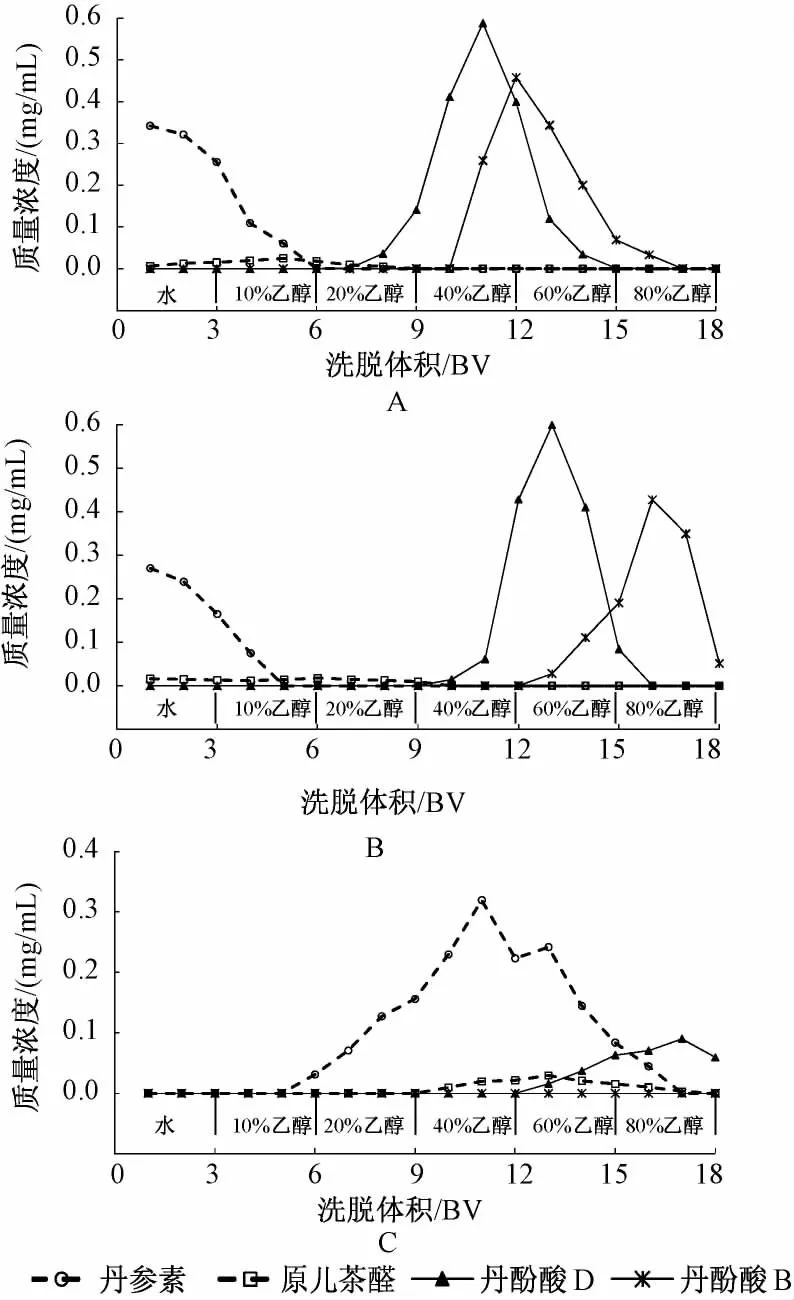
图3 4种丹参酚酸在不同类型树脂上的解吸附曲线Fig.3 Desorption curves of four salvianolic acids on different adsorbent resins
结果可以看出,丹参素和原儿茶醛在大孔树脂及聚酰胺树脂上容易被解吸附,水即可将这两种酚酸洗脱下来,与文献报道一致[9];丹酚酸D在以上两种树脂上的解吸附曲线相似,60%乙醇可将其洗脱完全,但丹酚酸D在大孔树脂上的解吸附率达86.1%,高于在聚酰胺树脂上79.4%的解吸附率;丹酚酸B在大孔树脂上适宜的洗脱剂为60%乙醇,其解吸附率达82.9%,均优于聚酰胺60%~80%乙醇洗脱剂和70.3%的解吸附率。而在离子交换树脂上,丹参素和原儿茶醛的解吸附过程较为缓慢,40%~60%乙醇可相对集中地将其洗脱下来,解吸附率分别为67.4%和72.8%,但丹酚酸D和丹酚酸B在离子交换树脂上解吸附较为困难,实验中发现80%乙醇洗脱液中仍未能有效洗脱下丹酚酸B。
可见,在丹参酚酸类成分的精制分离过程中,虽然大孔树脂和聚酰胺树脂对于总酚酸中丹酚酸D及丹酚酸B等成分的富集效果较好,但同时会导致丹参素及原儿茶醛成分的大量损失;相反,离子交换树脂对丹参素及原儿茶醛的吸附和解吸附效果较好,对另两种酚酸类成分富集效果却并不理想。
3 讨论
采用HPLC法同时检测了4种具有代表性结构的酚酸成分,与单一成分或紫外法测定总酚酸相比,具有受干扰小,评价更为全面、准确等优点。
大孔树脂具有吸附量大,解吸附率高,再生能力强等特点[10-11],与聚酰胺相比更适宜于富集丹酚酸B等结构为二聚体以上的酚酸类成分,其对丹酚酸D和丹酚酸B的饱和吸附量分别达22.3 mg/g和27.4 mg/g;而阴离子交换树脂对丹参素及原儿茶醛等成分的吸附效能较高,饱和吸附量分别为30.6 mg/g及3.2 mg/g;鉴于单一树脂的分离局限性以及不同树脂在分离上的互补性,在精制分离丹参总酚酸或单一成分时可采用大孔树脂与阴离子交换树脂联合使用,应能取得理想的效果。
依据文献[9,12-13]本实验仅选用了弱极性 AB-8型大孔树脂,60~100目规格聚酰胺以及强碱型201×7型阴离子交换树脂进行了研究,未对不同型号树脂的吸附特性进行考察,因而在后续进行树脂联用制备总酚酸或单一成分研究时,还需要进一步优选不同树脂的型号,考察其吸附及解吸附能力,提升精制分离的效果。
[1]国家药典委员会.中华人民共和国药典:2010版一部[S].北京:中国医药科技出版社,2010:70.
[2]周长新,罗厚蔚,丹羽正武.丹参水溶性化学成分的研究[J]. 中国药科大学学报,1999,30(6):411-416.
[3]Zeng G F,Xiao H B,Liu JX,et al.Identification of phenolic constituents in Radix Salvia miltiorrhizae by liquid chromatography/electrospray ionization mass spectrometry[J].Rapid Commun Mass Spectrom,2006,20(3):499-506.
[4]房信胜,谭晓梅,王建华.大孔吸附树脂纯化丹参总酚酸的工艺研究[J]. 中草药,2006,37(10):1502-1504.
[5]李 丹,宋洪涛,初 阳,等.大孔吸附树脂纯化丹参水溶性总酚酸工艺研究[J].中国药房,2009,20(15):1142-1145.
[6]张霄翔,邵胜男,周慧慧,等.大孔吸附树脂纯化丹参总酚酸的工艺研究[J]. 中成药,2007,29(9):1288-1291.
[7]丁 宁,郑云枫,程建明,等.RP-HPLC法分离丹参滴注液中的丹酚酸D及测定4种酚酸类的含量[J].中国药房,2012,23(8):744-746.
[8]Fu Y J,Zu Y G,Liu W,et al.Preparative separation of vitexin and isovitexin from pigeonpea extracts with macroporous resins[J].J Chromatogr A,2007,1139(2):206-213.
[9]王妍妍,朱靖博,李 琳,等.大孔树脂对丹参中5种丹酚酸类化合物的吸附分离特性[J].中国中药杂志,2008,33(9):1004-1007.
[10]宋丽军,赵文昌.HPLC双指标研究大孔树脂纯化甘草酸的优化工艺及图谱分析[J].中成药,2011,33(7):1252-1254
[11]魏冬青,陈绍民,苗建武.丹参总酚酸大孔树脂纯化工艺[J]. 中国实验方剂学杂志,2012,18(3):42-44.
[12]苗建武,陈绍民,王 超,等.聚酰胺树脂分离纯化丹参总酚酸的研究[J].中国实验方剂学杂志,2011,17(3):28-30.
[13]亢 炎,佟继铭.阴离子交换树脂分离纯化赤雹果中的总有机酸[J].承德医学院学报,2009,26(3):237-239.

