醒脑静注射液对急性脑梗死患者脑保护作用及白介素-6、白介素-8水平的影响
千玲玲, 贾 奎
(新乡医学院第一附属医院,河南卫辉453100)
脑梗死已成为严重威胁中老年患者的疾病之一,不仅发病率高,且其致残率及致死率均高,近年来,脑梗死的发病有年轻化的趋势[1]。对于大面积及影响患者活动的急性期脑梗死患者,其需要绝对的卧床休息配合治疗,因此增加了其继发感染的风险[2]。白细胞介素是人体白细胞产生的一系列的具有生物活性及生物功能的物质之一,是一种细胞因子[3]。其中白细胞介素-6(IL-6)及白细胞介素-8(IL-8)因其在炎性反应等过程中的作用,成为研究的热点。本研究旨在探讨醒脑静注射液对急性脑梗死患者脑保护作用及可能机制,为其临床研究提供依据。
1 对象和方法
1.1 一般资料 连续收集2011年1月—2012年10月入住我院的80例脑梗死患者,随机分为治疗组40例,对照组40例,均为发病24 h内入院,两组患者性别、年龄等基本资料比较差异无统计学意义 (P>0.05),具有可比性。参见表1。
表1 醒脑静注射液治疗急性脑卒中患者40例研究的性别、年龄等基线资料分析 (±s)Tab.1 Analyses of the age,gender,etc for Xingnaohing Injection treatment of 40 cases of patients with acute cerebral infarction(±s)

表1 醒脑静注射液治疗急性脑卒中患者40例研究的性别、年龄等基线资料分析 (±s)Tab.1 Analyses of the age,gender,etc for Xingnaohing Injection treatment of 40 cases of patients with acute cerebral infarction(±s)
注:经t检验,两组患者性别,年龄以及神经功能缺损评分乃至中医症候评分差异无显著性,P>0.05
组 别 例数性别/例男女年龄/岁 神经功能缺损积分 中医证候积分治疗组40 19 21 61.2±5.9 27.4±4.4 18.9±1.5对照组40 16 24 61.6±6.3 26.8±3.9 19.1±1.8
1.2 方法 对照组:常规给予脱水降颅压,改善脑循环以及活血化瘀,抗血小板聚集等基础治疗。医师可根据患者的病情及时调整治疗方案。治疗组:在对照组基础上加用醒脑静注射液 (国药准字:Z32020563,无锡济民可信山禾药业股份有限公司),静脉滴注,一次20 mL,一日1次。两组均为2周为一个疗程,应用1个疗程。
1.3 观察指标
1.3.1 神经功能缺损评分、中医症候量表 ①二者均采用尼莫地平法来计算减分率。计算公式:疗效指数=(治疗后得分-治疗前得分)/治疗前得分×100%。②根据治疗后神经功能缺损量表评分减分率来评定综合疗效,标准如下:基本痊愈:NIHSS量表评分减少≥90%;显著进步:NIHSS量表评分减少≥45%、<90%;进步:NIHSS量表评分减少≥18%、≤45%;无变化:NIHSS量表评分减少或增加<18%;恶化:NIHSS量表评分增加>18%。③中医证候疗效根据中医证候量表减分率进行评定。痊愈:治疗指数≥70%;显效:40%≤治疗指数≤69%;好转:20%≤治疗指数≤39%;无效:治疗指数<20%。
1.3.2 IL-6、IL-8水平均于本实验第2日清晨抽取空腹肘正中静脉血2 mL,3 000 r/min离心5 min,储存于-80℃冰箱待检。采用酶联免疫吸附法对所有受试者的血清样本检测IL-6、IL-8(试剂盒均购自武汉EIAab科技有限公司,产品编号:E1243h,D1334f),所有操作步骤均严格按照说明书进行。比较两组患者1 d、13 d的上述指标的变化。上述指标均在治疗前后各测量1次。
1.4 统计分析方法 采用SPSSl6.0统计软件。①检验水准采用α=0.05。②统计描述:符合正态分布的计量资料用均数±标准差 (±s)进行统计描述;不符合正态分布的计量资料用中位数±四分位数 (M±Q)进行统计描述。③参数估计:采用95%CI,如样本率估计总体率。④假设检验:计量指标符合用t检验条件,用t检验,不符合的条件,用Mann-WhitneyU检验;无序分类指标采用χ2检验,有序分类指标用Mann-WhitneyU检验。
2 结果
2.1 两组治疗前后总体疗效比较 见表2。
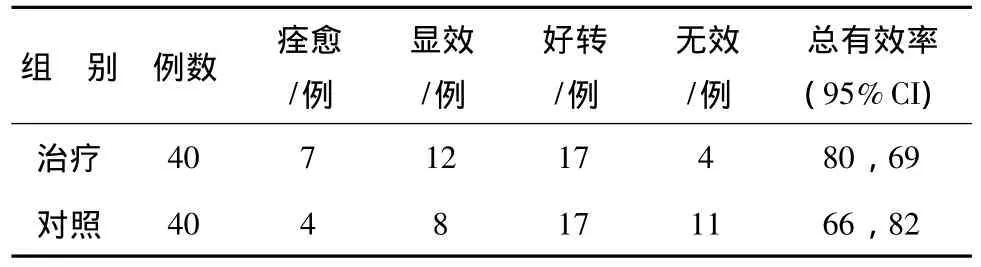
表2 醒脑静注射液对急性脑梗死患者治疗前后疗效比较Tab.2 Com parion of the curative effect for Xingnaojing Injection before and after treatment for patients with acute cerebral infarction
2.2 神经功能缺损以及中医证候评分 见表3。
表3 对急性脑梗死患者治疗前后神经功能缺损评分及中医证候评分比较 (±s)Tab.3 Com parion of the scores of TCM and the naural function before and after the treatment for patientswith acute cerebral infarction(±s)

表3 对急性脑梗死患者治疗前后神经功能缺损评分及中医证候评分比较 (±s)Tab.3 Com parion of the scores of TCM and the naural function before and after the treatment for patientswith acute cerebral infarction(±s)
注:经t检验,两组神经功能缺损评分以及中医症候评分均较治疗前明显改善*P<0.05,#P<0.05,组间比较治疗组明显优于对照组*P=0.012<0.05,#P=0.022<0.05
组 别 例数 神经功能缺损 中医证候积分治疗前 治疗后 治疗前 治疗后治疗组 40 27.4±4.4 8.82±2.9* 18.9±1.5 7.4±1.5#对照组 40 26.8±3.9 11.56±2.3* 19.1±1.8 12.3±2.1#
2.3 两组治疗前后中医症候因子评分结果 见表4。
两组治疗前后中医症候因子均有改善,与对照组比较,治疗组中医症候因子改善明显,有显著差异。
表4 对急性脑梗死患者治疗前后中医症候因子评分比较(±s)Tab.4 Comparion of the scores of TCM syndromes before and after treatment with Xingnaojing Injection for patients with acute cerebral infarction(±s)
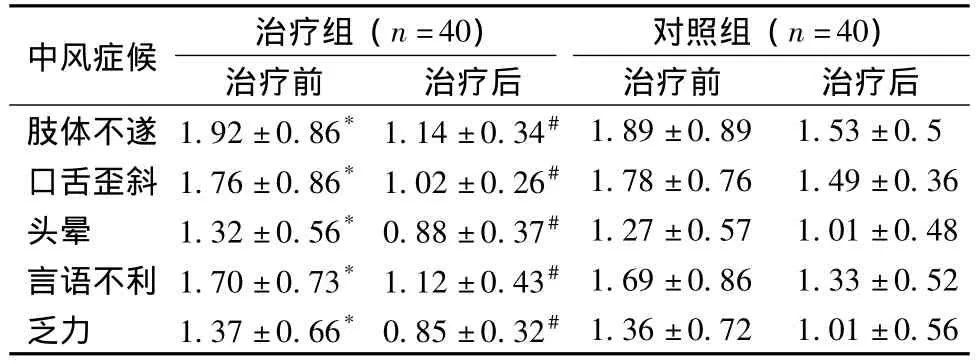
表4 对急性脑梗死患者治疗前后中医症候因子评分比较(±s)Tab.4 Comparion of the scores of TCM syndromes before and after treatment with Xingnaojing Injection for patients with acute cerebral infarction(±s)
注:经t检验,治疗组与对照组治疗前比较,*P>0.05,各组治疗前后比较,#P<0.05
中风症候 治疗组 (n=40)对照组 (n=40)治疗前 治疗后 治疗前 治疗后肢体不遂 1.92±0.86*1.14±0.34#1.89±0.89 1.53±0.5口舌歪斜 1.76±0.86*1.02±0.26# 1.78±0.76 1.49±0.36头晕 1.32±0.56*0.88±0.37# 1.27±0.57 1.01±0.48言语不利 1.70±0.73*1.12±0.43# 1.69±0.86 1.33±0.52乏力 1.37±0.66* 0.85±0.32#1.36±0.72 1.01±0.56
2.4 IL-6、IL-8治疗前后变化 2组治疗后IL-6、IL-8均有改善 (P<0.01);与对照组,治疗组IL-6、IL-8得到显著改善,差异有统计学意义 (P<0.01)。见表5。
表5 对急性脑梗死患者治疗前后IL-6、IL-8水平比较(±s)Tab.5 Comparion of the IL-6,IL-8 level before and after the tretment with Xingnaojing Injection for patients with acute cerebral in farction(±s)

表5 对急性脑梗死患者治疗前后IL-6、IL-8水平比较(±s)Tab.5 Comparion of the IL-6,IL-8 level before and after the tretment with Xingnaojing Injection for patients with acute cerebral in farction(±s)
注:经t检验,两组IL-6以及IL-8均较治疗前明显改善,*P<0.05,#P<0.05,组间比较治疗组明显优于对照组,*P=0.020<0.05,#P=0.013 <0.05
组别 例数 IL-6/(pg·mL-1) IL-8/(ng·mL-1)治疗前 治疗后 治疗前 治疗后治疗组 40 18.4±1.3 8.3±1.4* 0.64±0.17 0.31±0.14#对照组 40 19.8±1.2 11.9±1.8* 0.75±0.17 0.52±0.11#
治疗前IL-6水平经t检验,两组无显著性差异(P>0.05)。治疗后两组内经配对样本t检验,IL-6水平均较治疗前有显著性差异 (P<0.05);组间差值经过独立样本t检验,治疗组比对照组有下降明显 (P<0.05),差异有显著意义。
治疗前IL-8水平t检验,两组无显著性差异(P>0.05)。治疗后两组内经配对样本t检验,IL-8水平均较治疗前有显著性差异 (P<0.05);组间差值经过独立样本t检验,治疗组比对照组有下降明显 (P<0.05),差异有显著意义。
本观察发现醒脑静注射液对于急性脑梗死患者白介素6和白介素8水平改善理想,一方面说明脑梗死患者的发生与炎性介质关系密切,同时说明醒脑静注射液可以通过改善炎性介质水平改善患者神经功能缺损症状。
3 讨论
脑梗死是一种严重威胁人们健康的疾病之一,不仅表现为梗死部位的相应症状,且常常引起机体其他器官、组织发生功能的障碍,导致身体机能的下降[4]。当脑梗死患者并发肺部感染时,肺部感染又可以再次引起机体发生应激反应,进一步加重患者的病情,不仅不利于脑梗死的恢复,甚至危及患者的生命。
急性脑梗死患者血清IL-6、IL-8水平均有不同程度变化。IL-6[5]是由单核巨噬细胞、Th2细胞、血管内皮细胞、成纤维细胞等多种细胞分泌产生的一种多肽物质具有分化和促进生长作用的多种生物活性的细胞因子。是机体细胞因子网络中的重要成员,是参与机体各种调节的重要细胞因子,IL-6可以刺激活化B细胞增殖,分泌抗体,且可以刺激肝细胞合成急性期蛋白,参与炎症反应,在炎症反应中起核心调节作用,是炎症免疫反应的重要介质。具有促进B细胞成熟、T细胞活化和促进KC细胞增殖等多种作用[6]。IL-8的主要生物学活性是吸引和激活中性粒细胞,中性粒细胞与IL-8接触后发生形态变化,定向游走到反应部位并释放一系列活性产物,造成嗜中性细胞侵入炎症部位形成强烈炎症,达到杀菌和细胞损伤的目的[7]。脑梗死急性期人体处于应激状态,作为早期炎症因子IL-8则会显著升高;脑梗死面积越大,机体的应激反应程度越激烈,炎症反应也越强,IL-8水平就会越高;而IL-8具有促进炎症作用,其水平的升高又加重了脑损伤的程度。故血清中IL-6、IL-8水平的升高不仅是急性脑梗死后脑损伤的标志,还可预示脑梗死的面积及机体对脑梗死的应激反应程度。
醒脑静注射液由安宫牛黄丸剂方改制而成,为水溶性注射液,主要成分为麝香、栀子、冰片,郁金等,传统医学认为麝香具有醒脑开窍,透达神经的功能,冰片则可以清热解毒,辅助麝香的开窍以及兴奋中枢的功能,加上泻火除烦的栀子等可以更好的清热凉血,行气开窍,研究还发现郁金可以不同程度地提高小鼠对缺氧脑组织的保护作用,与抑制细胞凋亡有一定的关系[8]。
现代医学研究显示,醒脑静注射液可改善大脑功能,兴奋中枢神经系统与醒脑安神乃至提高脑细胞耐氧能力,提高缺氧脑细胞的存活率,同时改善梗塞部位血循环,促进中心坏死区及周围半暗带区的改善,加速神经功能恢复,延缓神经元不可逆损害等作用[9]。同时对于患者细胞因子水平等均具有明显的改善作用[10]。
本研究发现醒脑静注射液对于患者神经功能缺损以及中医证候具有明显的改善,差异有显著性(P<0.05),对于急性脑梗死患者白介素6和白介素8水平改善理想,说明脑梗死患者的发生与炎性介质关系密切,与报道相符合[10],同时说明醒脑静注射液可以较好的通过改善炎性介质的水平改善患者临床症状,具有临床意义。
[1]牟方波,郭 鹏,卢正海.急性脑梗死的中西医研究进展[J].中西医结合心脑血管病杂志,2010,8(2)220-223.
[2]张向前,陆兵勤,刘振华,等.腔隙性脑梗死形似正常区的白质损害与超敏C反应蛋白的关系[J].中华神经医学杂志,2009,8(4):380-381.
[3]张清华,崔元孝,刘敬花,等.老年脑梗死病人血清细胞因子含量及其动态变化[J].中国老年学杂志,2009,29(18):2310-2312.
[4]侯晓红.脑梗死前期血液流变学变化的观察[J].齐齐哈尔医学院学报,2010;31(7):1046.
[5]王 黎,刘瑞珍.急性脑梗死病人血清瘦素和IL-6水平变化及临床意义[J].中西医结合心脑血管病杂志,2010,8(8):939-940.
[6]邰炜彦,王蓓蕾.血清中IL-6、IL-8及TNF-α水平与高血压致急性脑梗死损伤的相关性[J].中华神经医学杂志,2012,11(3):269-272.
[7]张艳红,陈丽丽,王海英,等.急性脑梗死患者血清肿瘤坏死因子-α、白细胞介素-8和瘦素水平变化[J].中国老年学杂志,2012,32(13):2731-2732.
[8]李宗花,张婉娴,朱彤彤,等.郁金防治急性缺氧小鼠脑损伤的机制[J].中国老年学杂志,2011,11(31):4198-4199.
[9]祖衡兵,邬军峰,赵永飞,等.醒脑静治疗64例重症脑梗死的临床疗效观察[J].中国医院药学杂志,2007,27(3):366-368.
[10]钟善全,刘 铮,黄 樱,等.醒脑静对高血压脑出血患者血清IL-6、TNF-α水平的影响及其临床意义[J].广东医学,2008,29(8):1411-1413.

