中药眩晕Ⅲ号治疗脑动脉粥样硬化机制的实验研究
刘式威刘静吕霞梁军田庆华刘志刚尹岭
(1.解放军第211医院神经内科,150080;2.解放军第211医院特诊科,150080;3.解放军第65426部队医院,150087;4.解放军总医院,100837)
中药眩晕Ⅲ号治疗脑动脉粥样硬化机制的实验研究
刘式威1刘静2吕霞3梁军1田庆华1刘志刚1尹岭4
(1.解放军第211医院神经内科,150080;2.解放军第211医院特诊科,150080;3.解放军第65426部队医院,150087;4.解放军总医院,100837)
目的 观察中药眩晕Ⅲ号对脑动脉硬化的治疗作用,并初步探索其作用机制。方法 随机将50只雄性SD大鼠分为正常对照组、模型组、辛伐他汀组、眩晕Ⅲ号低剂量组、眩晕Ⅲ号高剂量组。除正常对照组外,在喂食开始时一次性腹腔注射维生素D3(300 000 IU/kg)加高脂配方饲料喂养方法建立脑动脉硬化大鼠模型。7周后开始灌胃给药,正常对照组和模型组予蒸馏水灌胃。8周后处死大鼠,测各组血脂、脑组织生化指标,并对脑血管作病理检查。结果 眩晕Ⅲ号能降低血脂,降低脑组织丙二醛(MDA)含量,改善脑组织超氧化物歧化酶(SOD)活性(P<0.05);模型组脑动脉内膜内皮细胞呈广泛性变性、坏死、脱落,粥样斑块形成。经眩晕Ⅲ号治疗后上述指标均有一定改善。结论 眩晕Ⅲ号能改善脑动脉硬化模型大鼠的血脂与氧化能力、减轻脑血管壁的病理损害,这些变化提示眩晕Ⅲ号具有防治脑动脉硬化的作用。
脑动脉硬化;动物模型;药物干预;大鼠
随着社会老龄化进程的加快及饮食结构和工作方式的改变,脑血管疾病的发病率近年在全球呈上升趋势。高脂血症是动脉粥样硬化(atherosclerosis,AS)发病的主要因素之一[1]。AS是许多心脑血管疾病的基础病理表现,其最终结果是形成粥样硬化斑块,造成血管壁狭窄,靶器官供血不足,严重时会造成斑块破裂,形成血栓,促发心脑血管疾病的发生。因此,积极降血脂、防治脑动脉硬化是脑血管病治疗的关键。
以往多采用西药他汀类降血脂、防治脑动脉硬化,因为副作用大,使其应用受到限制。本文利用脑动脉硬化大鼠模型,研究中药眩晕Ⅲ号对脑动脉硬化的治疗作用,并探索其可能的机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 清洁级SD雄性大鼠,体质量150~180 g,共50只,由北京医科大学医学部医学实验动物科学部提供,并在SPF环境下饲养。
1.1.2 药物与试剂 中药眩晕Ⅲ号处方组成:生晒参10 g、白术15 g、黄芪15 g、当归15 g、川芎15 g、赤勺15 g、葛根15 g、地龙15 g、丹参15 g、石菖蒲15 g、三七粉3 g。按处方称取中药材,煎熬成汁,相当于每毫升药液含生药量2 g。辛伐他汀片:20 mg×7片,浙江京新药业股份有限公司生产,批号:H20000009。实验前研末以生理盐水调成1 mg/mL浓度供试液备用。高脂乳剂:按文献方法配成含3%胆固醇、10%猪油、0.5%胆酸钠和0.2%丙基硫氧嘧啶的脂肪乳剂,4℃冰箱保存备用。血清三酰甘油(triglycerides,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白(highdensitylipopro-tein,HDL)、低 密 度 脂 蛋 白 (lowdensitylipoprotein,LDL)、丙 二 醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒均由南京聚力生物医学工程研究所提供。
1.1.3 主要仪器 751型分光光度仪系意大利Maselli公司产品;日立7060全自动生化分析仪,日本产;TDL-5-A型离心机系上海安亭公司产品。
1.2 实验方法
1.2.1 动物模型的建立 取大鼠50只,其中40只采用杨鹏远等介绍的方法喂食高脂饲料,即3%胆固醇、0.5%胆酸钠、0.2%丙基硫氧嘧啶、5%白糖、10%猪油、81.3%基础饲料,在喂食开始时一次性腹腔注射维生素D3(300 000 IU/kg)后连续喂养7周,造成大鼠实验性脑动脉硬化模型。另10只SD大鼠只喂常用饲料,作为正常对照组。
1.2.2 分组及给药方法 将上述模型大鼠随机分为4组,即模型组、辛伐他汀组、眩晕Ⅲ号低剂量组、眩晕Ⅲ号高剂量组,每组10只。①正常对照组:只喂常用饲料,每日生理盐水1 mL/kg灌胃1次,连续8周;②模型组:每日生理盐水1 mL/kg灌胃1次,连续8周;③辛伐他汀组:每日辛伐他汀供试液按10 mg/kg灌胃1次,连续8周;④眩晕Ⅲ号低剂量组:每日眩晕Ⅲ号低剂量8 g/kg灌胃1次,连续8周;⑤眩晕Ⅲ号高剂量组:每日眩晕Ⅲ号高剂量16 g/kg灌胃1次,连续8周。
1.3 指标检测
1.3.1 血清脂质水平的检测 抽5 mL静脉血,采用日立7060型全自动生化分析仪测定TC、TG、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)水平。
1.3.2 脑组织氧化能力检测 各组采用脱颈椎法处死大鼠,快速称取脑组织湿质量,按质量与体积比(W∶V)1∶10加入冰生理盐水匀浆。经3 000 r/min,离心15 min,离心半径16 cm,取上清液。按照说明书步骤操作,用751型分光光度仪在325 nm处测MDA、SOD的活力。
1.3.3 脑血管病理形态学检查 大鼠快速断头,开颅取大脑半球,置10%甲醛溶液中固定,脱水,包埋,冠状连续切片,HE染色。光学显微镜观察脑血管动脉粥样硬化程度。
2 结果
2.1 各组大鼠血清脂质水平比较 与正常对照组相比,模型组TC、LDL-C、HDL-C水平均明显上升(P<0.01);与模型组相比,辛伐他汀组、眩晕Ⅲ号低剂量组及眩晕Ⅲ号高剂量组TC、LDL-C、HDL-C均显著降低(P<0.01);辛伐他汀组、眩晕Ⅲ号低剂量组及眩晕Ⅲ号高剂量组TC、LDL-C、HDL-C比较差异无统计学意义(P>0.05,表1)。
2.2 各组脑组织SOD活力与MDA含量测定结果 模型组、辛伐他汀组、眩晕Ⅲ号低剂量组及眩晕Ⅲ号高剂量组血清SOD活性均降低,与正常对照组相比差异均有高度统计学意义(P<0.01);辛伐他汀组、眩晕Ⅲ号低剂量组及眩晕Ⅲ号高剂量组SOD水平与模型组相比差异有高度统计学意义 (P<0.01),且它们组间比较差异无统计学意义(P>0.05);模型组、辛伐他汀组、眩晕Ⅲ号低剂量组及眩晕Ⅲ号高剂量组MDA含量均增高,其中模型组MDA含量增高最为显著,与其他组相比差异有高度统计学意义(P<0.01),说明辛伐他汀、眩晕Ⅲ号可以增强SOD活性,抑制MDA含量(表2)。
2.3 脑血管病理形态学检查结果 光镜下病理组织学检查结果显示,与正常对照组比较,模型组大鼠的脑组织中的动脉血管内膜的内皮细胞呈广泛性变性、坏死、脱落,管壁可见纤维帽样堆积物芽状突出和增生,表明脑血管动脉硬化症状形成。辛伐他汀组、眩晕Ⅲ号低剂量组及眩晕Ⅲ号高剂量组的上述病变情况明显减轻,脑血管内皮基本完整,管壁的纤维帽样增生也明显减少,血管内堆积物芽状突出和增生基本消失,表明用药后明显抑制了脑血管动脉硬化症状的形成(图1)。
表1 各组大鼠血清脂质水平比较(±s,mmol/L,n=10)
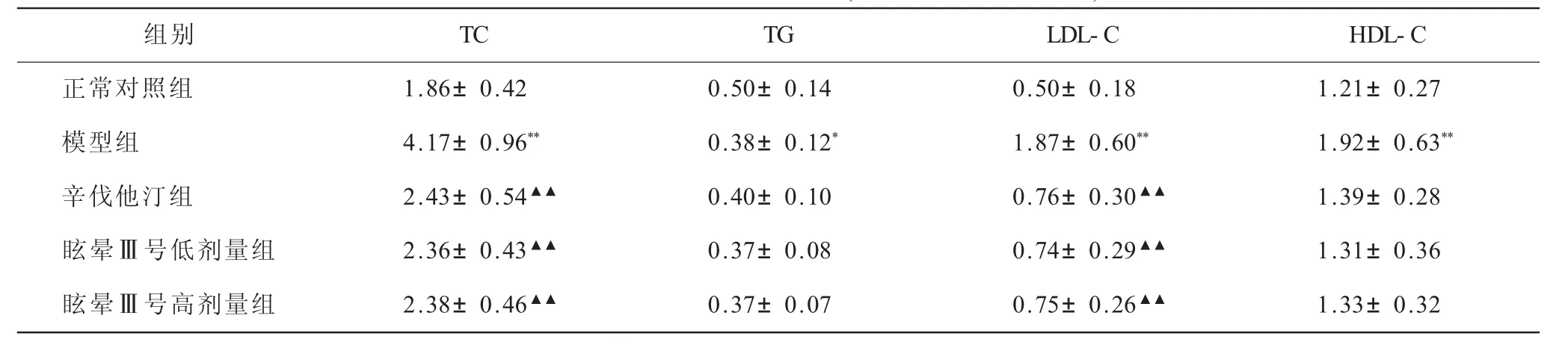
表1 各组大鼠血清脂质水平比较(±s,mmol/L,n=10)
注:与正常对照组比较,*P<0.05,**P<0.01;与模型组比较,▲▲P<0.01
组别 TC TG LDL-C HDL-C正常对照组 1.86±0.42 0.50±0.14 0.50±0.18 1.21±0.27模型组 4.17±0.96** 0.38±0.12* 1.87±0.60** 1.92±0.63**辛伐他汀组 2.43±0.54▲▲ 0.40±0.10 0.76±0.30▲▲ 1.39±0.28眩晕Ⅲ号低剂量组 2.36±0.43▲▲ 0.37±0.08 0.74±0.29▲▲ 1.31±0.36眩晕Ⅲ号高剂量组 2.38±0.46▲▲ 0.37±0.07 0.75±0.26▲▲ 1.33±0.32
表2 各组血清超氧化物歧化酶和丙二醛水平(±s,n=10)

表2 各组血清超氧化物歧化酶和丙二醛水平(±s,n=10)
注:与正常对照组相比,▲P<0.01;与模型组相比,*P<0.01
组别 SOD(NU/mL) MDA(nmol/mL)正常对照组 127.86±5.85 1.48±0.40模型组 70.20±5.76▲ 2.78±0.83▲辛伐他汀组 98.86±14.31▲* 1.78±0.49▲*眩晕Ⅲ号低剂量组 97.38±12.48▲* 1.69±0.48▲*眩晕Ⅲ号高剂量组 101.5±12.38▲* 1.70±0.52▲*

图1 脑血管的病理形态学表现
3 讨论
慢性脑供血不足 (chronic cerebral circulation insufficiency,CCCI)是由于脑动脉循环障碍引起的以头晕、头痛、失眠、健忘等为主症的一种疾病[2]。本病是中老年人常见病、多发病,其早期临床表现不典型,可有头痛、头晕、失眠、善忘、记忆力减退、易疲倦、嗜睡等。主要病因是脑大、中动脉的动脉粥样硬化(可有不同程度的斑块形成、血管狭窄)、弥漫性小动脉硬化和微动脉的玻璃样变,年龄、肥胖、高血压、糖尿病、血脂异常等是导致脑动脉硬化的主要危险因素[3]。长期处于脑供血不足的状态,容易增加脑梗死、血管性痴呆(VD)、阿尔茨海默病(AD)及Binswanger病等疾病的发生率[4]。对于慢性脑供血不足的研究,做到改善临床症状,预防其向严重脑血管病的进展是非常必要的,开发确切有效的防治药物成为医学界的重要课题。
慢性脑供血不足可归于中医学的“头痛”、“眩晕”、“健忘”、“不寐”等范畴,与“中风”、“痴呆”有因果关系[5]。中医药的整体观念以及多靶点作用,使其在治疗缺血性脑血管病中具有一定优势[6]。郝志汉[7]认为慢性脑供血不足的主要病机是血瘀,存在痰瘀互阻之证,治宜利湿化痰,活血祛瘀。
本文作者观察到西医的脑动脉粥样硬化、脑供血不足,与中医的痰湿中阻有相似的病理生理基础[8]。认为痰瘀互结是脑供血不足的主要病机。痰为体内津液停聚而生,瘀乃血液停滞而成,津血同源于水谷精微,故痰瘀二者,互为因果,在生理上可以相互为用、相互转化,在病理上亦可以相互影响。痰伏于血脉之中,影响气机,气机不利,则不能推动血液的正常运行,导致血液停滞于脉管成血瘀。而血液迟涩不畅,不能正常运行于脉中,壅滞气机,则影响津液的流动,反而导致痰的生成,痰浊和瘀血相互影响,痰凝则血瘀,血瘀则挟痰滞,痰瘀互结,胶结难开,从而脑脉不通,清窍被壅,形成恶性循环,贯穿于脑供血不足的整个过程。
本文作者利用痰瘀互阻理论,研制了具有健脾祛痰、化瘀通络作用的眩晕Ⅲ号中药。脂代谢异常血清中TG、TC和LDL-C的升高是诱发动脉粥样硬化的首要因素之一,它与血管内皮的损伤都是粥样硬化形成的始动环节,也是整个疾病发展的关键[9]。MDA[10]作为氧自由基和生物膜不饱和脂肪酸发生脂质过氧化反应的代谢产物,其含量的变化可间接反映组织中氧自由基含量的变化,并间接反映细胞损伤的程度。SOD[11]的表达水平可反映机体内抗自由基水平的高低。本研究发现,与脑动脉硬化模型组相比,眩晕Ⅲ号组血脂水平显著降低,SOD活性显著增强,MDA含量受到显著抑制。同时,脑血管动脉硬化病变情况明显减轻,脑血管内皮基本完整,管壁的纤维帽样增生也明显减少,血管内堆积物芽状突出和增生基本消失。显示眩晕Ⅲ号可促进血清SOD活性,降低MDA的产生,减轻氧化应激,抗脂质过氧化反应从而保护血管内皮细胞功能,这可能是眩晕Ⅲ号减轻动脉粥样硬化症状的机制之一。这就为临床应用眩晕Ⅲ号治疗脑供血不足提供了理论支持。
[1]Rahilly-TierneyCR,ArnettDK,North KE,etal.Apolipoprotein epsilon-4 polymorphism does not modify the association between bodymassindexand high-densitylipoprotein cholesterol:a cross-sectionalcohortstudy[J].Lipids Health Dis,2011,10(1):167.
[2]阚保红.慢性脑供血不足病因病机研究现状[J].中医学报,2010,25(3):430.
[3]Li W,Tang C,Jin H,et al.Regulatory effects of sulfur dioxide on the development of atherosclerotic lesions and vascular hydrogen sulfide in atherosclerotic rats[J].Atherosclerosis,2011,215(2):323-330.
[4]王磊,陈新龙,王华,等.慢性脑供血不足研究进展[J].中国康复理论与实践,2009,15(4):335.
[5]刘玉霞.“血管头痛汤”治疗慢性脑供血不足256例临床观察[J].江苏中医药,2005,26(3):19.
[6]孙强.慢性脑供血不足的基础及临床研究[J].中风与神经疾病杂志,2009,26(6):765.
[7]郝志汉.从瘀论治慢性脑供血不足[J].中国民间疗法,2010,18(9):68.
[8]王育勤.萸竹定眩丸治疗慢性脑供血不足30例疗效观察[J].中国社区医师,2008,24(361):40.
[9]Titov VN,Shiriaeva IuK.Arteriolosclerosis and atherosclerosis.Pathology of the distal and proximal arterial bed.Pathogenesis of diabetic microangiopathy[J].Klin Lab Diagn,2011,4(4):3-14.
[10]张光银,张军平,李明,等.补肾抗衰片对实验性动脉粥样硬化家兔海马氧化应激的影响[J].中华中医药杂志,2011,26(5):1228-1231.
[11]李骥,王松.茯苓与有氧运动联合干预对大鼠动脉粥样硬化进程的影响[J].哈尔滨师范大学自然科学学报,2011,27(6):74-77.
Objective To study the therapeutic action and its mechanism of Xuanyun-Ⅲ on cerebral atherosclerosis(AS).Methods Fifty male adult SD rats were randomly divided into 5 groups:normal control group,model group,Simvastatin group,low-dose Xuanyun-Ⅲ group,and high-dose Xuanyun-Ⅲ group.Except the normal control group,the rats of the other groups were given an intraperitoneal injection dose of vitamin D3(300 000 IU/kg)at the beginning of feeding,together with high-fat feedstuff to set up rat models with cerebral arteriosclerosis.Gavage administration was conducted after seven weeks,while the normal control group and the model group were given distilled water gavage.After eight weeks,all rats were sacrificed,and the serum lipid and the biochemical criteria such as superoxide dismutase(SOD),the content of Malondialdehyde(MAD)were detected in the brain tissues.Pathological examinations of cerebral vascular were performed as well.Results Xuanyun-Ⅲ can reduce serum lipid and the content of Malondialdehyde(MAD),and improve the SOD activity(P<0.05).Cerebral endarterium endothelial cells of the rats in the model group presented universal degeneration,necrosis,ablation,and atheromatous plaque formed.The above indexes were all improved after the treatment of Xuanyun-Ⅲ.Conclusion Xuanyun-Ⅲ can improve the serum lipid and oxidizability of the rats with cerebral arteriosclerosis,alleviate the pathological lesion of brain blood vessel,which shows that Xuanyun-Ⅲ can prevent and treat cerebral arteriosclerosis.
Cerebral arteriosclerosis;Animal model;Drug intervention;Rats
973国家重点基础研究发展计划资助项目(2004CB720302)
刘式威
1005-619X(2013)05-0396-03
2013-03-23)
·疗养·

