麻花秦艽种子休眠机理及其破除方法
李兵兵,魏小红,* ,徐 严,2
(1.甘肃农业大学生命科学技术学院,兰州 730070;2.郴州市农业科学研究所,郴州 423042)
种子休眠是植物适应环境的繁殖策略之一,但往往给实际生产中带来不便。因此,研究生产中如何破除种子休眠,具有重要的理论和现实意义。近年来,国内外对打破种子休眠和提高种子发芽率的方法已有大量报到,如变温和冷湿层积等因素有利于打破苔草(Carex)种子的休眠[1];利用外源赤霉素处理拟南芥(Arabidopsis thaliana)种子及赤霉素结合机械处理宫灯百合(Sandersonia aurantiaca)种子均能提高种子的发芽率[2-3];郑蔚虹等[4]通过采用青霉素、过氧化氢和高锰酸钾浸种沙棘(Hippohae rhamnoides)种子,结果显示3%过氧化氢、250 mg/L青霉素和0.15%高锰酸钾浸种能够显著提高种子的活力,促进种子萌发及幼苗生长;于晓等[5]认为延长储藏时间和划破种皮均能显著提高盐生草(Halogeton glomeratus)种子的萌发率。另外,有关植物种子休眠原因也有大量报道,如Pérez-García等[6]对半日花(Helianthemum soongoricum)种子进行不同的处理,结果表明人工去种皮的种子发芽率最高,种皮不透性是造成其休眠的主要原因。王艳华等[7]研究了大山樱(Prunus sargentii)种子种胚、内种皮和外种皮浸提液对白菜籽萌发的影响,结果表明内源抑制物是大山樱种子休眠的因素之一。Debeaujon等[8]指出,胚的生理休眠主要是抑制剂如脱落酸(abscisic acid,ABA)浓度过高,而促进剂如赤霉素(gibberellin acid,GA)等浓度过低所致。杨期和等[9]论述了胚休眠可以是形态的、生理的或二者兼而有之。
秦艽是我国三级重点保护野生药材之一,有大叶秦艽(Gentiana macrophylla Pall.)、麻花秦艽(G.straminea Maxim.)、粗茎秦艽(G.crassicaulis Duthie ex Burk.)和小秦艽(G.dahurica Fisch.)等。秦艽种子因存在休眠问题、发芽速率慢、出苗不齐整以及当年种子发芽率仅为20%左右,给秦艽的大规模生产栽培带来极大不便。关于提高秦艽种子发芽的相关研究已有报道,如刘丽莎等[10]和滕红梅等[11]利用赤霉素浸泡秦艽种子,20℃培养后均极大提高了种子发芽率,但秦艽种子休眠原因和破除休眠方法的研究鲜有报道。本文选用麻花秦艽种子作为研究材料,深入系统地探讨其休眠机制和打破休眠的方法,为人工驯化和大规模生产栽培提供理论和技术依据。
1 材料与方法
1.1 试验材料
试验材料为麻花秦艽种子。2010年11月采集于甘肃省陇西市首阳镇,通风后熟干燥贮藏。种子呈圆形、椭圆形,表皮呈红褐色,净度分析后过40目筛,取饱满、均匀一致的颗粒。
1.2 试验设计与测定方法
1.2.1 麻花秦艽种子透水性
取2 g种子,分别在天平(1/10000)上精确称量后放入50 mL烧杯中,于蒸馏水中20℃恒温浸泡,每隔2 h取出种子,擦干后准确称重,直至36 h结束。计算种子吸水率,重复3次:
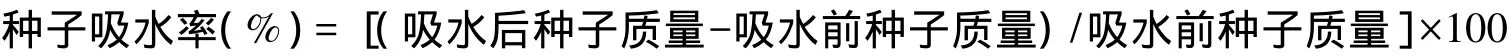
1.2.2 麻花秦艽种子粗提物的制备及活性测定
(1)种子粗提物制备 采用浸提法,参考赵敏等[12]的方法。称取麻花秦艽种子20 g在研钵中研碎,加3倍体积水,置于56℃下浸提24 h。过滤后残渣再浸提2次,每次浸提12 h,合并3次浸提液,56℃下浓缩成100 mL,即浓度为0.2 g/mL粗提物溶液。
(2)粗提物对小麦生长的影响 参考赵敏等[12]的方法,设置粗提物浓度为0(对照)、0.08、0.12和0.16 g/mL,于有双层滤纸的培养皿中加入6 mL的粗提物溶液,(28±1)℃培养皿(d=90 mm)黑暗中培养。24 h后统计和计算处理组发芽率、地上部分和地下部分的长度以及叶绿素含量分别为对照的百分率。叶绿素的含量测定参照邹琦的方法[13]。
(3)粗提物对白菜萌发的影响 参考赵敏等[12]的方法,设置浓度为0(对照)、0.02、0.04、0.08、0.12和0.16 g/mL,加入6 mL的粗提物溶液,(24±1)℃培养皿黑暗中培养,保持培养皿湿润,24 h测定发芽率,48 h测量根长,并计算内源抑制物活性:

(4)粗提物对自身种子萌发的影响 麻花秦艽种子用10%氯化汞溶液消毒5 min,于蒸馏水中浸泡24 h后置于双层滤纸的培养皿中,每培养皿50粒(随机选取),每处理4个重复,20℃恒温黑暗培养。设置粗提物浓度为0.05、0.1、0.15和0.2 g/mL,向培养皿中加入不同浓度6 mL的粗提物溶液,称重法保持培养皿湿润,培养14 d后结束种子萌发试验,统计种子发芽率,测量根长。以上所有实验重复3次。
1.2.3 破除麻花秦艽种子休眠的方法
将消毒的麻花秦艽种子在蒸馏水中浸泡24 h后,作如下处理:①对照处理;②20℃流水浸泡24 h;③500 mg/L赤霉素(GA3)和青霉素(penicillin,医用注射)溶液浸泡24 h;④高锰酸钾(KMnO4)溶液,浓度为1.5%浸泡10 min;⑤1 mol/L硫酸(H2SO4)浸泡40 min。浸泡完成倒去溶液,用蒸馏水冲洗,置于双层滤纸的培养皿中,每个培养皿50粒(随机选取),每处理重复4次,同一时间段培养。培养箱中20℃恒温培养,其中KMnO4处理为光照培养,其它处理为黑暗培养。保持培养皿湿润,每天进行观测,第8天测定发芽势(GP),第14天统计发芽率(GR)、发芽指数(GI)和活力指数(VI),测量根长。

其中,Gt为发芽后第t日的发芽数,Dt为Gt对应的发芽天数。

1.2.4 抑制物清除
各取20 g麻花秦艽种子,消毒,40 mL蒸馏水中浸泡24 h后,作如下处理:40 mL 500 mg/L赤霉素浸泡24 h、40 mL 1.5%高锰酸钾浸泡10 min和不做任何处理。处理完成后参照1.2.2制备种子粗提物及其活性测定。设置粗提物的浓度为0(对照)、0.02、0.04、0.08、0.12和0.16 g/mL,用白菜作生物测定,24 h后测定发芽率,计算处理组发芽率为对照发芽率的百分率。
1.3 数据分析
采用SPSS18.0和Excel 2003软件进行数据分析和图表绘制,用Duncan法对上述指标进行多重比较。
2 结果与分析
2.1 麻花秦艽种子的透水性
图1表明20℃时麻花秦艽种子的吸水率随浸种时间的延长呈抛物线型变化,由其可知种子20℃时吸水过程符合Logistic曲线方程。利用Logistic曲线方程直线化拟合结果及估算的各参数见图2和表1,吸水率对应浸种时间的Logistic直线化方程为y'=0.8827-0.4034x(R2=0.9777,P<0.01)。可知,20℃时2 g麻花秦艽种子浸水后立即吸胀,浸种2.19 h吸水速度最快,为急剧吸水期;浸种5.45 h后吸胀高峰结束,进入稳定吸水期;至浸种8.13 h后吸胀结束为吸水饱和期,最大速率为28.72 g/h。表明麻花秦艽种子透水性良好,种胚能快速吸收足够的水分。因此,推断种皮透性水不是引起麻花秦艽种子休眠的原因。
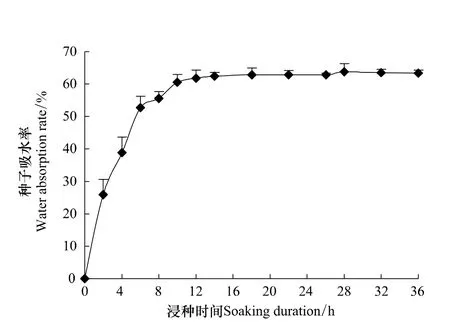
图1 20℃麻花秦艽种子吸水率随浸泡时间的变化Fig.1 Changes of water absorption of G.straminea Maxim.seed to soaking time under 20℃
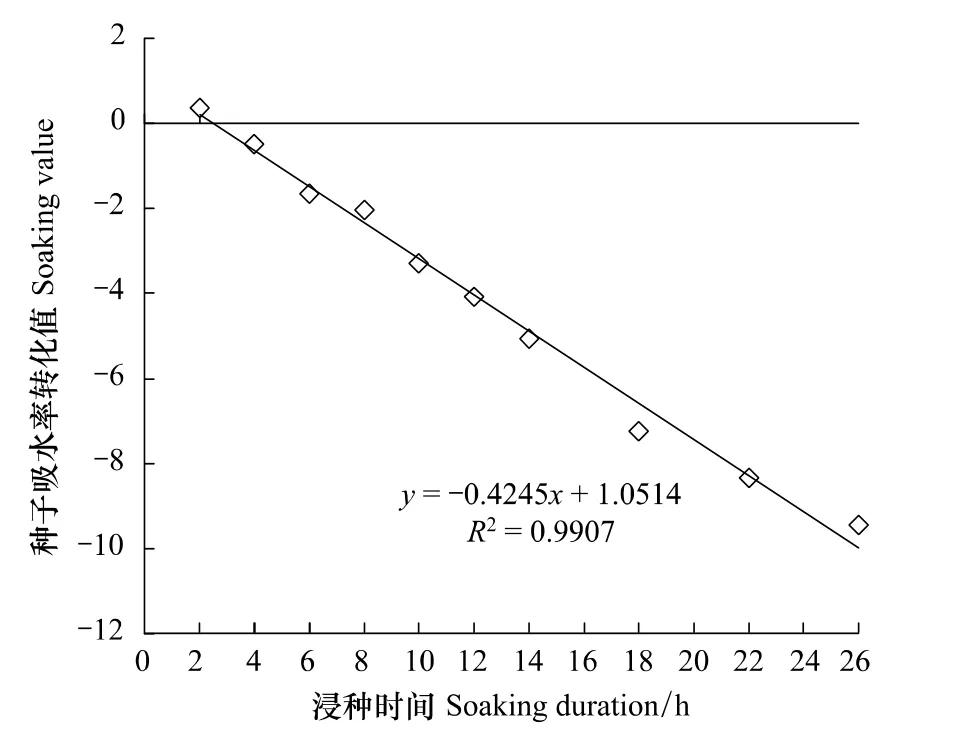
图2 20℃下麻花秦艽种子吸水率与浸种时间配合Logistic方程直线化拟合结果(n=11×3)Fig.2 Linear response of water absorption of G.straminea Maxim.seed to soaking time based on Logistic equation under 20℃

表1 麻花秦艽种子吸水率与浸种时间配合Logistic方程估计的参数Table 1 The estimated parameters based on Logistic equation fitting soaking rate with soaking duration in G.straminea Maxim
2.2 麻花秦艽种子粗提物的生物活性研究
2.2.1 种子粗提物对小麦生长的影响
粗提物对小麦种子的发芽率及地上部分和地下部分的生长均有明显的抑制作用,且随着其浓度增大,抑制作用显著增强(表2)。粗提物浓度为0.16 g/mL时,小麦种子发芽率、地上部分和地下部分的长度分别较0.08 g/mL极显著降低37.61%、30.09%和42.67%(P<0.01),其中对小麦地下部分生长抑制作用最强,说明麻花秦艽种子中可能存在内源抑制物,对小麦种子萌发及幼苗生长有明显抑制作用。但不同浓度粗提物作用下小麦叶绿素含量为对照组的百分率之间差异不显著,说明粗提物虽然对小麦幼苗生长产生抑制,但未干扰叶绿素合成。
2.2.2 种子粗提物对白菜萌发的影响
随着粗提物浓度的增大,内源抑制物的活性则越大,对白菜种子发芽率和根的抑制作用越强,表明粗提物对白菜种子的萌发有明显的抑制作用(图3)。当浓度为0.02 g/mL时,抑制活性最低;当浓度达0.16 g/mL时,抑制活性最强,后者较前者对发芽率和根长的抑制活性分别极显著提高342.13%、66.14%。进一步说明了麻花秦艽种子存在影响种子萌发的内源抑制物。
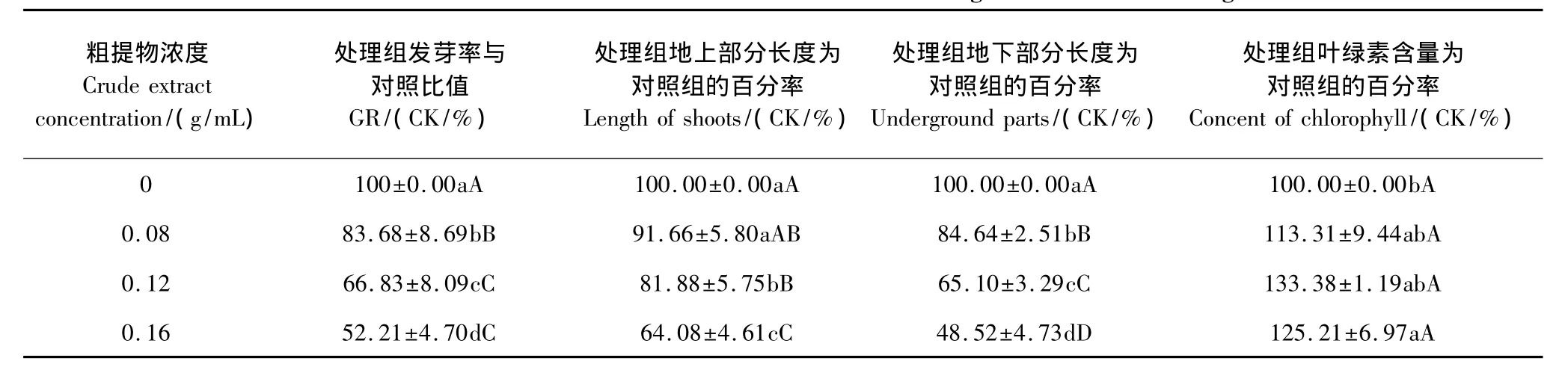
表2 麻花秦艽种子粗提物对小麦种子萌发和幼苗的影响Table 2 Effect of crude extract from G.straminea Maxim.seeds on germination and seedling of wheat
2.2.3 种子粗提物对种子自身萌发的影响
粗提物对自身种子的萌发和幼苗有着明显的抑制作用(表3)。随着粗提物浓度的增大,发芽率和根长与对照相比,其比率(%)均有所降低。当浓度为0.05 g/mL时其发芽率与根长为对照的百分率最大,较0.2 g/mL浓度的发芽率和根长为对照的百分率极显著降低,分别降低47.70%和61.11%。发芽率为对照的百分率随浓度的增大而递减,而粗提物浓度为0.15 g/mL时,根长为对照的百分率最低为52.94%。更进一步说明麻花秦艽种子存在内源抑制物。
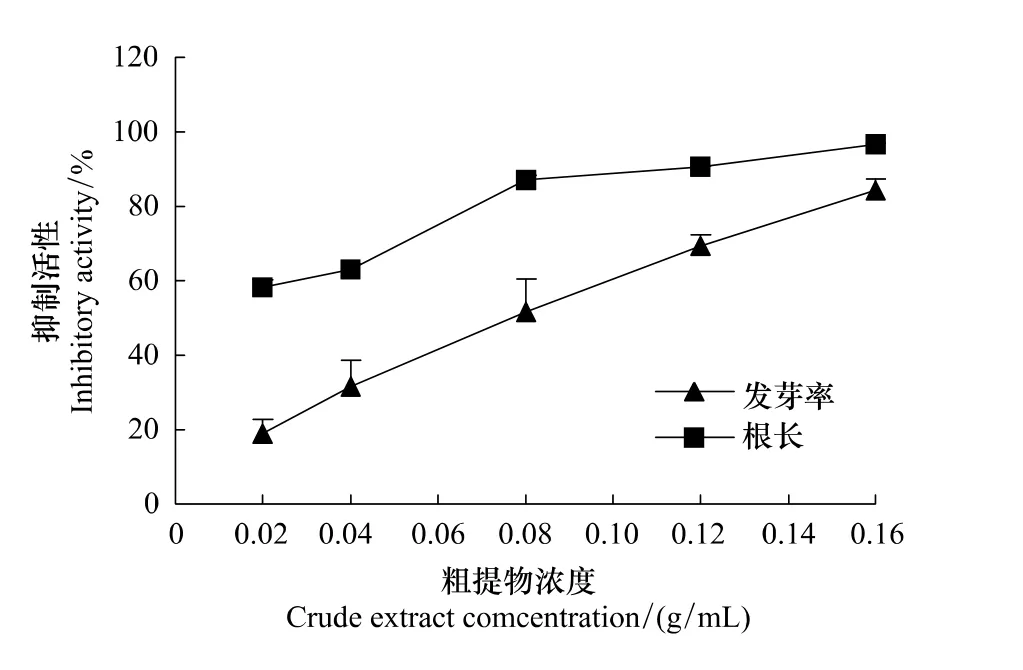
图3 麻花秦艽种子粗提物对白菜萌发和根长的影响Fig.3 Effect of crude extract from G.straminea Maxim.seeds on germination and radicle growth of cabbage
2.3 不同处理对麻花秦艽种子萌发的影响
采用1.5%高锰酸钾和500 mg/L赤霉素等处理对麻花秦艽种子破除休眠进行试验,结果表明,适宜的处理对麻花秦艽种子萌发有促进作用,均可打破麻花秦艽种子的休眠(表4),处理种子最早在第5天发芽,比对照提前2 d。1.5%高锰酸钾处理发芽率最高,达90%,与流水浸泡、500 mg/L青霉素和对照比对差异极显著,分别提高45.16%、20%和106.90%;比1 mol/L硫酸处理,发芽率显著提高9.76%(P<0.05);但与500 mg/L赤霉素处理比较,发芽率仅提高了7.78%,差异不显著。
由表4可知,1.5%高锰酸钾处理麻花秦艽种子发芽势较流水浸种、500 mg/L青霉素和对照极显著提高435.29%、121.95%和521.43%,较1 mol/L硫酸和500 mg/L赤霉素显著提高24.08%、35.82%;发芽指数较流水浸种、500 mg/L青霉素和对照极显著提高158.00%、78.10%、和266.71%,较1 mol/L硫酸和500 mg/L赤霉素显著提高24.04%、19.94%;活力指数较流水浸种、500 mg/L青霉素、对照、1 mol/L硫酸和500 mg/L赤霉素均分别极显著提高364.33%、251.00%、709.66%、111.76%、85.11%。发芽活力可以反映种子萌发动力,发芽指数和发芽势均可揭示种子萌发的速度和整齐度。因此,1.5%高锰酸钾光照培养发芽质量最佳。

表3 麻花秦艽种子粗提物对麻花秦艽种子发芽的影响Table 3 Effects of crude extracts from G.straminea Maxim seeds on germination of G.straminea Maxim.
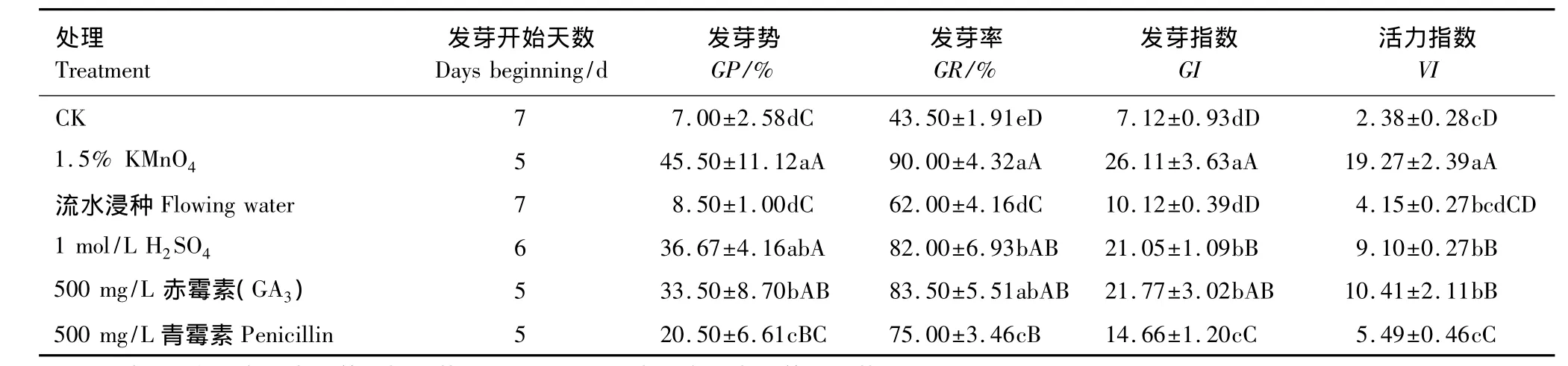
表4 不同处理麻花秦艽种子的发芽特性Table 4 Germinative characteristics of G.straminea Maxim.seeds under different treatment
2.4 高锰酸钾和赤霉素处理后麻花秦艽种子内源抑制物的变化
采用高锰酸钾和赤霉素处理的麻花秦艽种子制备的粗提物,对白菜种子进行生物活性分析,图4显示,该粗提物依然对白菜种子萌发及幼苗生长具有抑制作用,且随着浓度的增大,抑制作用也随之增强。经高锰酸钾处理的不同浓度粗提物培养的白菜种子,其发芽率为对照发芽率的百分率均高于未处理,说明高锰酸钾处理的种子其粗提物抑制作用均低于未处理,尤其浓度为0.02 g/mL时,其发芽率与对照发芽率比值较未处理显著提高了26.33%。当浓度为0.08—0.16 g/mL时,经赤霉素处理的种子其粗提物抑制作用明显强于未处理种子;当浓度为0.02—0.04 g/mL时,抑制作用显著低于未处理,说明赤霉素处理可能导致种子内源抑制物的增加。浓度为0.02 g/mL的赤霉素处理的种子粗提物培养的白菜种子,其发芽率为对照发芽率的百分率较未处理显著提高了18.40%,这可能是粗提物浓度较低,而赤霉素促进了白菜种子的萌发。因此,高锰酸钾处理减弱了麻花秦艽种子内源抑制物的活性。
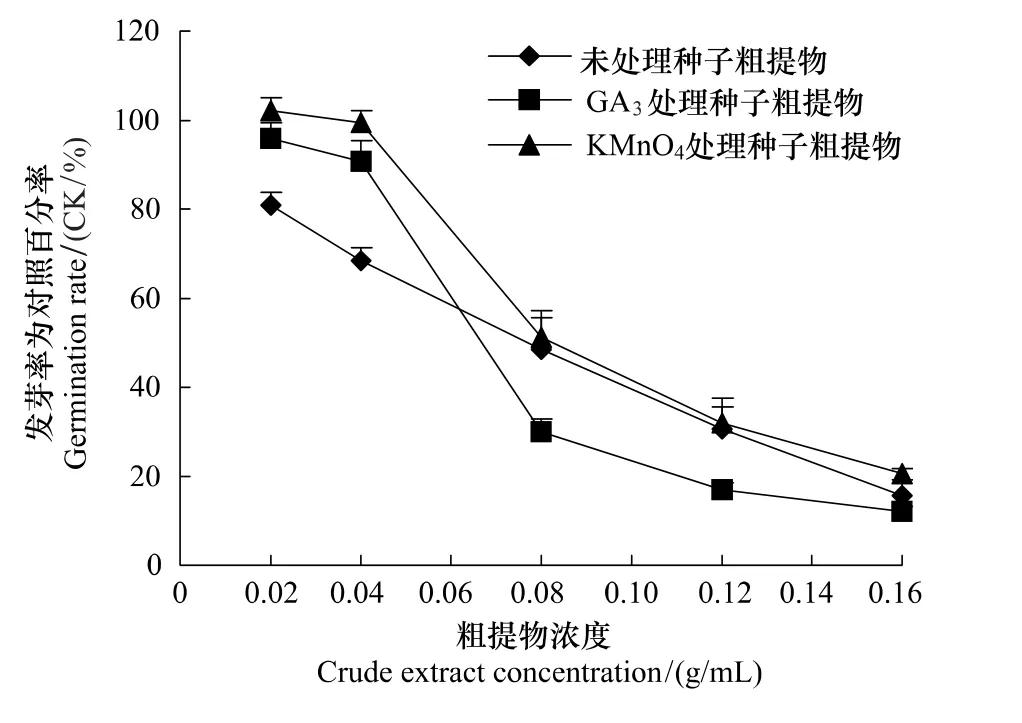
图4 不同处理的麻花秦艽种子粗提物对白菜萌发的影响Fig.4 Effect of crude extract from G.straminea Maxim.seeds of different treatment on germination of cabbage
3 讨论
3.1 影响麻花秦艽种子休眠的主要因素
本试验供试种子为当年采收,干燥贮藏后熟,于2011年3月份实验。本研究中,1)20℃时麻花秦艽种子浸种2.19 h后吸水速率最大为62.84%,8.13 h后吸水饱和,其吸水过程所表现的3个阶段,符合种子的吸水规律,说明麻花秦艽种皮对种子吸水无阻碍作用。秦艽喜生长在雨水充足,气候冷凉,光照充足的高山地区,20℃是秦艽种子最适发芽温度[10-11],此时麻花秦艽呈现的无阻碍吸水是环境选择的结果。2)经1.5%高锰酸钾和1 mol/L硫酸处理腐蚀的麻花秦艽种子均打破了休眠,发芽率、发芽势、发芽指数和活力指数各指标均极显著高于对照,表明麻花秦艽种皮存在着机械障碍,这与溪荪(Iris sanguinea)[14]的研究结果相似。3)流水浸泡可提高麻花秦艽种子的发芽率,说明种子内可能含有萌发抑制物,这与赵敏等[12]报道膜荚黄芪[Astragalus membranaceus(Fisch.)Bunge]温水浸种的结果相似;同样其种子粗提物对小麦和白菜萌发和生长具有明显的抑制作用,也说明麻花秦艽种子内含萌发抑制物;另外,这些粗提物对麻花秦艽种子自身萌发也产生了较强的抑制作用,更证明了这一点。正如Debeaujon等[8]指出,胚的生理休眠主要是因为是抑制剂浓度过高,而促进剂浓度过低所致。赵敏等[12]对膜荚黄芪[Astragalus membranaceus(Fisch.)Bunge]内源抑制物的研究结果表明膜荚黄芪存在内源抑制物。Amritphale等[15]指出,葫芦科(Cucurbitaceae)种子外胚乳中存在的抑制物质ABA能够通过抑制β-1,3-葡聚糖酶的表达影响外胚乳中内含物的代谢,从而抑制珠孔端胚乳的降解与破裂,延缓种子的萌发。喻梅等[16]研究野生鸭儿芹(Cryptotaenia japonica)种子休眠及破除方法,研究结果表明内源抑制物是种子休眠的原因之一,清水浸种和低温冷藏共同处理可有效解除其休眠。可知,已经完成后熟的麻花秦艽种子的休眠属于综合休眠(combinational dormancy,PY+PD)[17],即种皮机械障碍和内源抑制物是影响麻花秦艽种子休眠的主要因素。种子休眠是调节萌发最佳时间和空间分布的一个方法,具有极其重要的生态学意义[9],例如时间分布是通过扩大萌发时期来实现的,如滕红梅等试验结果显示秦艽种子80多天后仍有发芽[11],有利于种的生活和传播。在不同生境中,及不同空间上也有差异,如低温打破种子休眠则在气候温暖的地区很难萌发,而且光敏性强的种子,在阳光照射不到的地方不足以解除休眠。而秦艽生长在海拔较高地区,喜冷凉气候。因此,麻花秦艽种子的综合休眠是生态环境选择的生存方式,可使之与外界环境相适应。
3.2 破除麻花秦艽种子休眠的处理
种子休眠是植物对外界自然环境的一种适应性行为,能够防止种子在不适宜的环境中萌发。但在生产上需要种子快速、整齐的发芽,来满足生产的实际需要。一些研究表明,高锰酸钾、赤霉素、青霉素、硫酸处理均可以打破种子休眠[4,18-21],促进种子萌发。高锰酸钾和硫酸处理可以腐蚀和氧化种皮,也可以氧化种皮中含有的可以抑制种子萌发的物质,同时又打破了胚发育时种皮的机械阻力,增加透水性、透气性,从而打破种子休眠[4,18]。赤霉素增强了α-淀粉酶的mRNA转录,导致α-淀粉酶[19]合成增加,加强了种子有氧呼吸,加大胚的生长速度,提高了种子的发芽率。青霉素亦有诱导植物α-淀粉酶形成和促进生长等作用,类似于生长素、赤霉素和细胞分裂素[20-21]。麻花秦艽种子采摘后需通风后熟处理5—7 d,干燥贮藏,自然条件下虽种子生活力高达94.3%,但发芽率仅为20%,可知种子处于休眠状态。根据前期的一些实验与结果(高锰酸钾、硫酸等不同浓度,光照或黑暗培养的实验),本研究采用1.5%高锰酸钾(光照)、500 mg/L赤霉素、500 mg/L青霉素、1 mol/L硫酸溶液和流水浸种处理麻花秦艽种子,达到了打破种子休眠的目的,缩短发芽时间和提高发芽效果。高锰酸钾是一种强氧化剂,解除了麻花秦艽种子的种皮障碍,并为种子萌发提供氧元素和微量元素锰(Mn),极大地加强了种子破皮后的呼吸和营养作用;光照下能够诱导种子内部细胞分裂素(cytokinin,CTK)含量的增加,从而使CTK能够拮抗种子内源抑制物如脱落酸的作用。高锰酸钾可以清除麻花秦艽种子的内源抑制物,因此,在播种或育苗前可用1.5%高锰酸钾处理10 min自然光下破皮萌发。
[1] Kettenring K M,Galatowitsch S M.Temperature requirements for dormancy break and seed germination vary greatly among 14 wetland Carex species.Aquatic Botany,2007,87(3):209-220.
[2] Karssen CM,Lacka E.A revision of the hormone balance theory of seed dormancy:studies on gibberellin and/or abscisic acid deficient mutants of Arabidopsis thaliana//Bopp M.Plant Growth Substances 1985.Berlin:Springer-Verlag,1986:315-323.
[3] Zhou X Y,David W F,Ed R M.Seed dormancy of Sandersonia aurantiaca broken by interaction of GA3and mechanical treatment.Acta Prataculturae Sinica,2003,12(5):70-76.
[4] Zheng W H,Leng J M.Effect on germination of seed and growth of seeding by Penicillin,Hydrogen Peroxide and Potassium Permanganate to Hippohae rhamnoides.Seed,2003,22(6):21-22,29-29.
[5] Yu X,Yan C,Wei Y.Germination of dimorphism seeds in Halogeton glomeratus(Chenopodiaceae).Acta Ecologica Sinica,2009,29(3):1616-1621.
[6] Pérez-García F,González-Benito M E.Seed germination of five Helianthemum species:effect of temperature and pre sowing treatments.Journal of Arid Environments,2006,65(4):688-693.
[7] Wang Y H,Gao SM,Li F L,Zhao W,Lu L.Discussion of dormancy mechanism of Prunus sargentill seeds.Seed,2005,24(5):12-16.
[8] Debeaujon I,Koornneef M.Gibberellin requirement for Arabidopsis seed germination is determined both by testa characteristics and embryonic abscisic acid.Plant Physiology,2000,122(2):415-424.
[9] Yang Q H,Ye W H,Song S Q,Yin S H.Summarization on causes of seed dormancy and dormancy polymorphism.Acta Botanica Boreali-Occidentalia Sinica,2003,23(5):837-843.
[10] Liu L S,Ji K P.Germination characters of seed of Gentiana macrophylla.Chinese Traditional and Herbal Drugs,2002,33(3):269-271.
[11] Teng H M,Cao X L,Wan Z Z.Effects of different culture conditions and pretreatments on the seed germination of Gentiana macrophylla Pall..Seed,2008,27(11):87-88,91.
[12] Zhao M,Wan Y.Elementary studies on intrinsic inhibitor that retards germination of seed of Astragalus membranaceus.Chinese Traditional and Herbal Drugs,2001,32(7):643-646.
[13] Zou Q.Experiment Guide of Plant Physiological.Beijing:China Agriculture Press,2000.
[14] Eunju L,Jeachul K.Improvement of Seed Germination in Native Iris Sanguinea Donn ex Hom.Korean Journal of Horticultural Science&Technology,2002,20(4):345-351.
[15] Amritphale D,Yoneyama K,Takeuchi Y,Ramakrishna P,Kusumoto D.The modulating effect of the perisperm-endosperm envelope on ABA-inhibition of seed germination in cucumber.Journal of Experimental Botany,2005,56(418):2173-2181.
[16] Yu M,Zhou SB,Wu X Y,Wang J,Chang L L,Wang J M.Dormancy break approaches and property of dormant seeds of wild Cryptotaenia japonica.Acta Ecologica Sinica,2012,32(4):1347-135.
[17] Baskin C,Baskin J M.Determining Dormancy-Breaking and Germination Requirements from the Fewest Seeds.Washington:Island Press,2004,162-179.
[18] Cheng G Y,Tang X J,Gao H B,Shen X H.Dormancy mechanism and relieving techniques of seeds of Taxus cuspidata Sieb.et Zucc.Journal of Beijing Forestry University,2004,26(1):5-9.
[19] Yu L,Wan Y R,Zhang JH,Sun JH,Dong Q.Studies on dormancy characteristics of Cleistogenessongorica and Plantago lessingii seed and some methods for breaking it.Acta Prataculturae Sinica,2004,13(6):45-49.
[20] Zhu J H,Fu X H.Effect of penicillin on seed germination and seedling growth of several crops.Plant Physiology Communications,1995,31(5):344-346.
[21] Li H H,Pan R C.Role of penicillin in higher plant.Plant Physiology Communications,1987,23(5):1-6.
参考文献:
[3] 邹琇莹,Fountain D W,Morgan E R.赤霉素及机械处理的相互作用对破除Sandersonia aurantiaca种子休眠的研究.草业学报,2003,12(5):70-76.
[4] 郑蔚虹,冷建梅.青霉素、过氧化氢和高锰酸钾浸种对沙棘种子萌发及幼苗生长的影响.种子,2003,22(6):21-22,29-29.
[5] 于晓,严成,魏岩.盐生草(Halogeton glomeratus)二型种子的休眠与萌发.生态学报,2009,29(3):1616-1621.
[7] 王艳华,高述民,李凤兰,赵伟,孙玉红,路莲.大山樱种子休眠机理的探讨.种子,2005,24(5):12-16.
[9] 杨期和,叶万辉,宋松泉,殷寿华.植物种子休眠的原因及休眠的多形性.西北植物学报,2003,23(5):837-843.
[10] 刘丽沙,姬可平.秦艽种子发芽特性的研究.中草药,2002,33(3):269-271.
[11] 滕红梅,曹晓燕,王喆之.不同培养条件及预处理对秦艽种子萌发的影响.种子,2008,27(11):87-88,91.
[12] 赵敏,王炎.膜荚黄芪种子萌发抑制物质特性的初步研究.中草药,2001,32(7):643-646.
[13] 邹琦.植物生理学实验指导.北京:中国农业出版社,2000.
[16] 喻梅,周守标,吴晓艳,汪劼,常琳琳,王继明.野生鸭儿芹种子休眠特性及破除方法.生态学报,2012,32(4):1347-1354.
[18] 程广有,唐晓杰,高红兵,沈熙环.东北红豆杉种子休眠机理与解除技术探讨.北京林业大学学报,2004,26(1):5-9.
[19] 鱼小军,王彦荣,张建全,孙建华,董强.无芒隐子草和条叶车前种子破除休眠研究.草业学报,2004,13(06):45-49.
[20] 朱建华,富新华.青霉素对几种作物种子发芽率和幼苗生长的影响.植物生理学通讯,1995,31(5):344-346.
[21] 李海杭,潘瑞炽.青霉素在高等植物中的作用.植物生理学通讯,1987,23(5):1-6.

