灌河口邻近海域春季浮游植物的生态分布及其营养盐限制
方 涛 ,贺心然,冯志华,陈斌林
(1.淮海工学院江苏省海洋生物技术重点建设实验室,连云港 222005;2.连云港市环境监测中心站,连云港 222001;3.连云港市环境保护局,连云港 222001)
在不同环境下的河口,限制浮游植物初级生产的营养元素往往不同。如有学者在对北Carolina州的河口研究发现,N是这些河口系统主要限制因子,P偶尔发生协同发展[1],但Smith指出有一些河口海岸最终P将限制初级生产力[2],而Chesapeake湾,春季硅藻水花由可溶性硅所控制[3]。长江口过高N/P使江口外沿的浮游植物受到P限制[4],黄河口区5月和8月份N/P变化范围分别是10—140和30—300,明显高于正常值16[5]。而珠江口海域丰富的氮、磷、硅和较高的N/P均可能是形成该海域多年来浮游植物群落以硅藻类占优势的主要原因[6]。相比而言,灌河口相关研究就显得十分缺乏。目前灌河口及上游地区形成了较为发达的工业园区,大量工业污水的排放势必对邻近海域的生态环境产生重要影响。因此开展相关海域环境调查尤其是浮游植物的生态分布及营养盐限制的研究就显得十分有意义。
1 站位与方法
1.1 研究站位与分析方法
2011年4月于灌河口邻近海域共设置现场调查站位7个(图1),浮游植物采用浅水III型浮游生物网从底至表层垂直拖网获取和采水器采集表层水样500mL,现场用5%福尔马林溶液固定,在实验室进行种类鉴定及个体计数,另取表层水样经0.45μm孔径的醋酸纤维滤模过滤,滤液储存于125mL聚乙烯塑料瓶中,用于测定磷酸盐、铵盐、亚硝酸盐和硝酸盐,滤膜储存于10mL离心管,用于萃取测定叶绿素a。
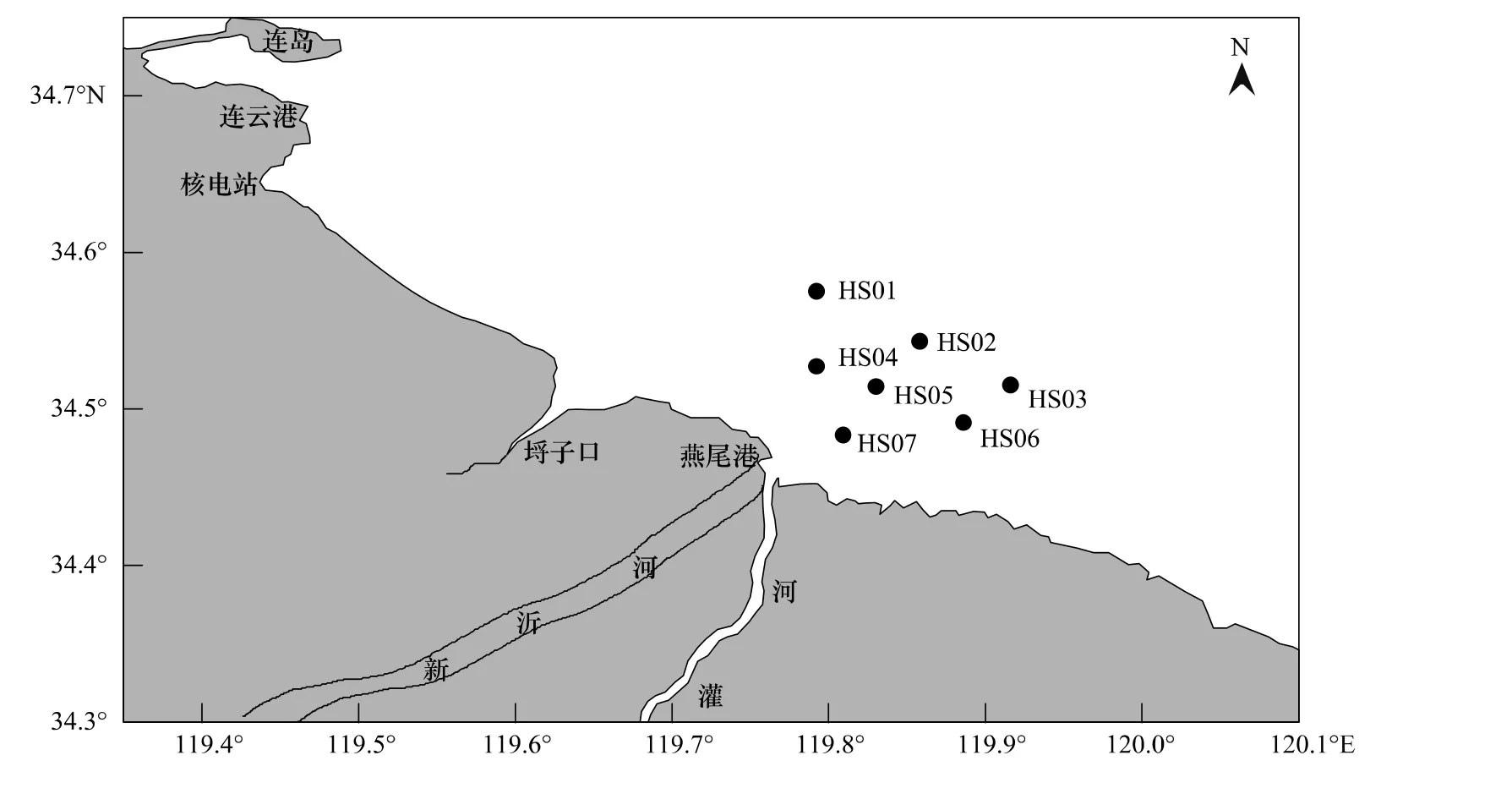
图1 现场采样站位Fig.1 Sampling Locations
各监测指标的样品采集、预处理、分析与鉴定均按《海洋监测规范》(GB17378.1—7—1998)和相关标准方法进行。磷酸盐测定采用磷钼蓝法,氨的测定采用靛酚蓝法,亚硝酸盐的测定采用α-萘-乙二胺-偶氮法,硝酸盐首先经过镉-铜柱还原为亚硝酸盐,而后同上述测定亚硝酸盐的方法分析。叶绿素a于630nm、647nm、664nm、752nm波长下分别测定吸收度值,按下述公式计算:
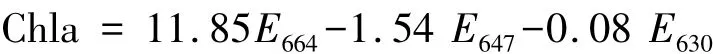
叶绿素a单位为μg/L.式中,E为经750nm波长校正后的吸光值,即E值应扣除E750的数值。
现场培养实验开展于HS05站位,取表层海水经孔径为100μm的筛绢滤出较大型浮游生物的明显干扰[7],混匀后分装入5个5L透明塑料瓶中。根据以往灌河口海域氮磷营养盐浓度变化范围的数据资料[8],确定往培养瓶中添加不同量的5mmol/L NaH2PO4溶液或0.4 mol/L NaNO3溶液,使得培养瓶中磷酸盐和硝酸盐处于不同的浓度水平(表1)。培养瓶固定在岸边通有循环海水的水槽中,循环海水是由泵不断从海上抽取的表层海水,从而使培养介质的温度与现场海水相近。

表1 实验组的设计Table 1 The design of experimental groups
培养实验从23日22:00开始至28日11:00结束,培养过程天气晴好。每次采样前先摇动培养瓶,以使水样混匀,并用光照度计测量当日的自然光强,现场培养实验的测定参数主要包括NO3-N、NO2-N、NH4-N、PO4-P和叶绿素a。现场试验记录如表2。

表2 现场加富培养实验记录Table 2 Records of In situ experiments
1.2 数据处理
1.2.1 Shannon-Weaver多样性指数(H)和优势度指数(Y)计算公式分别如下:
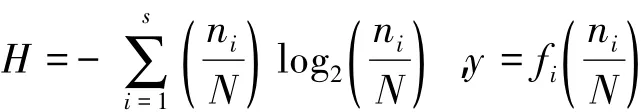
式中,S为样品中的种类总数,ni为第i种浮游植物的密度,fi为该种在各站位出现的频率,N为浮游植物总密度。
1.2.2 营养盐的吸收速率用以下公式计算[9]:
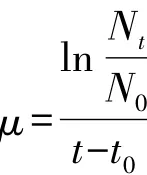
式中,μ为比吸收速率Nt和N0分别为t(结束)和t0(起始)时刻营养盐浓度。
2 结果与讨论
2.1 浮游植物的生态分布
春季调查海域共鉴定出浮游植物6门24科36属68种,其中硅藻门29属61种,占总种类数的89.71%,其次为甲藻和绿藻,各有2种,其他金藻门、蓝藻门和裸藻门各有1种,硅藻在浮游植物种类组成及群落结构中占有重要地位。整个调查海域优势种类(Y≥0.02)共15种。主要优势种类为中肋骨条藻(Skeletonema costatum)、冰河拟星杆藻(Asterionellopsis glacialis)、长菱形藻(Nitzschia longissima)、尖刺伪菱形藻(Pseuo-Nitschia pungens)、新月菱形藻(Nitzschia closterium)、刚毛根管藻(Rhizosolenia setigera)、舟形鞍链藻(Campylosira cymbelliformis),优势度分别达 0.53、0.21、0.083、0.080、0.076 、0.059、0.056。
春季调查海域浮游植物的丰度范围为0.84×106—2.25×106个/L,均值为1.54×106个/L,种类范围为29—39种,均值为35种,丰度和种类数从整个调查区域来看,都主要呈现西边高东边低的特征;浮游植物的多样性指数变化范围为2.60—3.79,均值为3.20,呈现出北边低南边高的特征,在所有采样站位中只有HS01和HS02两站的多样性指数介于2和3之间,属于轻度污染,其它站位的多样性指数介于3和4之间,属于清洁状态,本区海域环境尚适宜浮游植物的生长。浮游植物叶绿素a浓度范围为2.66—6.67μg/L,平均值为3.89μg/L,总体呈现近岸高外海低的特征(图2)。
2.2 氮磷营养盐的分布及其对浮游植物的限制
调查海域磷酸盐浓度的范围为0.35—0.90μmol/L,平均值为0.58μmol/L,,亚硝酸盐浓度范围为1.57—3.93μmol/L,平均值为3.08μmol/L,两者分布均具有近岸高外海低的特征;铵盐浓度范围为3.14—5.43μmol/L,平均值为3.95μmol/L,其分布则是近岸低外海高;硝酸盐浓度在31.2—37.00μmol/L之间变化,平均值为34.55μmol/L,整个分布大小比较近似,差异不明显(图2)。
可以看出春季灌河口邻近海域无机氮(DIN=NO3-N+NO2-N+NH4-N)浓度严重偏高,均超出四类标准(《海水水质标准》(GB 3097—1997)),磷酸盐浓度相对较低,均未超出二类标准,这可能与灌河径流的变化以及浮游植物的数量有关系,春季灌河进入汛期,径流量大,对河口污染物起到一定的稀释作用,而春季又是浮游植物旺发时期,丰度较高的浮游植物会消耗一定量的磷酸盐,而无机氮绝对浓度较高,因此导致调查区域N/P比严重偏高(图2),最小值为42,最大值可达到112。

图2 灌河口邻近海域表层浮游植物丰度、种类数、多样性、叶绿素a以及磷酸盐、硝酸盐、亚硝酸盐、铵盐及N/P比的分布Fig.2 Distribution of phytoplankton abundance,number of phytoplankton species,Shannon-Wiener index,chlorophyll a,phosphate,nitrate,nitrite,ammonium concentration and N/P ratios in surface water of adjacent sea of Guanhe Estuary
根据溶解态的N、P原子比确定水体中限制性的营养盐因子的研究已有不少,如Bernhard[10]指出在美国Puget Sound北部的一个泥沼河口,所有实验期间,可溶解无机N与P比例小于16∶1,因此推测N是这些河口光合作用的限制因子。Jiao[11]等根据国内海岸河口N/P范围(30∶1—80∶1),认为浮游植物可利用N含量远大于P,浮游植物生长的P限制超过N。胡明辉[12]研究了三角褐指藻等4种藻的生长所需要的最佳N/P比,并以此值同长江口的N/P比相比而得出长江口浮游植物受磷限制的结论。本次调查灌河口邻近海域N/P范围为42—112,据此,可初步推测春季灌河口邻近海域浮游植物的生长受到P限制。
通过浮游植物叶绿素a浓度与磷酸盐和无机氮的相关性分析(图3),春季调查水域叶绿素a与磷酸盐有着显著的正相关,而叶绿素a浓度与无机氮之间线性关系不显著。在某种营养盐为限制因子的海域,如添加该营养盐,会促进藻类的生长,因此这种营养盐浓度高的水域,叶绿素a浓度也较高,若营养盐增加致游藻类大量繁殖,甚至发生赤潮时,浮游植物势必会大量消耗该营养盐,从而导致该营养盐浓度快速降低,而表现出营养盐浓度与叶绿素a的负相关。从本文叶绿素a浓度与磷酸盐的相关性来看,虽然不能得出春季灌河口邻近海域浮游植物生长的营养盐限制因子是P,但P可能是潜在的限制因子。
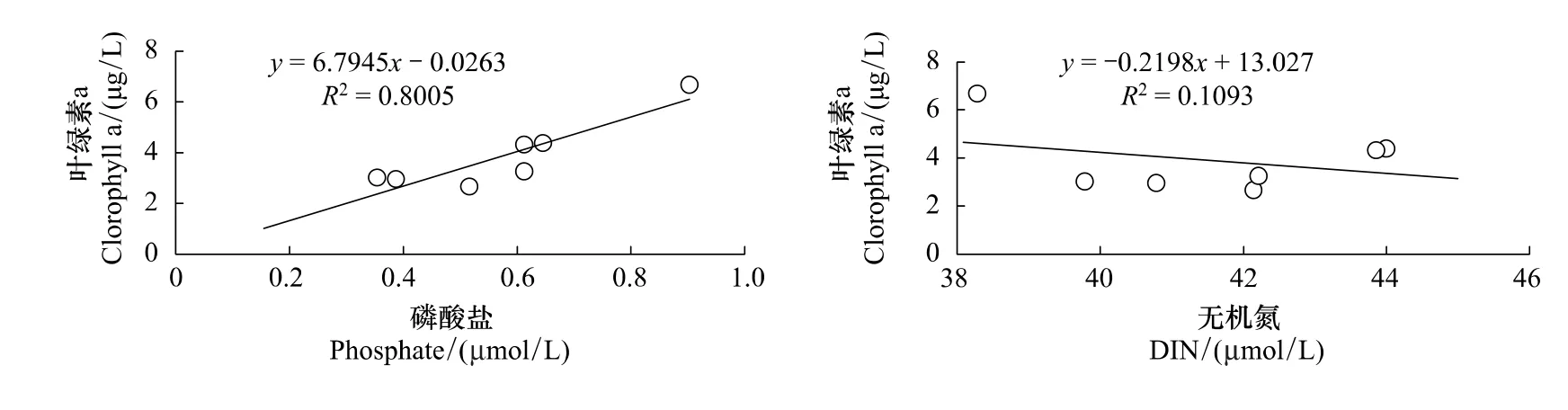
图3 浮游植物叶绿素a与磷酸盐和无机氮的相关性Fig.3 The lineal relationship between chlorophyll a and phosphate or DIN concentration
2.3 现场营养盐加富的藻类培养实验
根据N/P比例判断营养盐限制因子的方法存在一定的不足,首先这种方法没有考虑到各种类型的藻类吸收N、P的比例不完全相同,得出的结论有一定的片面性;其次,不同种类的藻类可吸收利用的N源不同,且三态N之间可以相互转换,所以只能以总溶解无机氮作为标准,但带来的问题就是不能把藻类吸收的N的不同形态这个因素考虑进去,得出的结论会有一些偏差。再次,近岸受人类活动的影响较大,营养盐浓度比例变动较大,需要特别考虑。相比较而言,现场的营养盐加富培养实验,更接近于自然状况,是检验水体中营养盐限制的较好的办法,在国外应用已很普遍[10,13-15]。
本次现场培养实验开展于HS05站位,磷酸盐、铵盐、硝酸盐、亚硝酸盐和叶绿素a的初始浓度分别为0.61μmol/L、3.36μmol/L、35.14μmol/L、3.71μmol/L 和 3.25μg/L。在 P 加富培养实验中,磷酸盐可由初始浓度的0.61、1.22、1.65μmol/L分别降至培养结束后的0.12、0.18、0.17μmol/L,磷酸盐的比吸收速率分别为0.36、0.43、0.51d-1,加P后促进了P本身的吸收;与此同时,P的添加也促进了硝酸盐和亚硝酸盐的吸收,铵盐浓度由于浮游植物的释放总体上呈增大趋势。由于培养海水事先都滤除了大型浮游动物的干扰,且固定在5L的培养桶中,与外界海水不流通,相对平静,加上现场光照强度以及水温都比较适宜,从而导致培养结速后叶绿素a浓度较高,对照组最大值可达到77.24μg/L,而+P组和++P组叶绿素a浓度最大值分别为90.57、96.49μg/L,P的添加也促进了藻类的生长(图4)。
在N加富培养实验中,硝酸盐由初始浓度的35.14、89.11、108.86μmol/L分别降至培养结束后的6.21、71.34、97.32μmol/L,硝酸盐的比吸收速率分别为0.39、0.049、0.025d-1,加N后并未促进硝酸盐本身的吸收速率,而亚硝酸盐在加N组中浓度反而是增加的,这主要与藻类存在的亚硝酸盐释放机制有关,至于图4中无此现象,可能是加磷实验体系中氮少,释放的亚硝酸盐又被浮游植物所吸收所致。同样磷酸盐的吸收也没有得到促进,培养期间3个实验组磷酸盐浓度变化曲线相似,铵盐总体上依然呈增大趋势,培养结速后+N组和++N组叶绿素a浓度最大值分别为72.31、69.62μg/L,都小于对照组的77.24μg/L,表明N的添加也未促进藻类的生长(图5)。
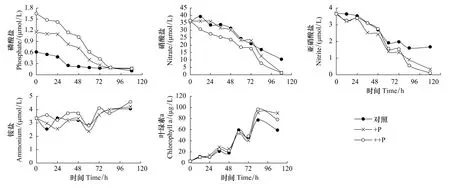
图4 P加富培养实验中氮磷营养盐及叶绿素a浓度的变化Fig.4 Changes of phosphate,nitrate,nitrite,ammonium and chlorophyll a concentration during P enrichment incubations
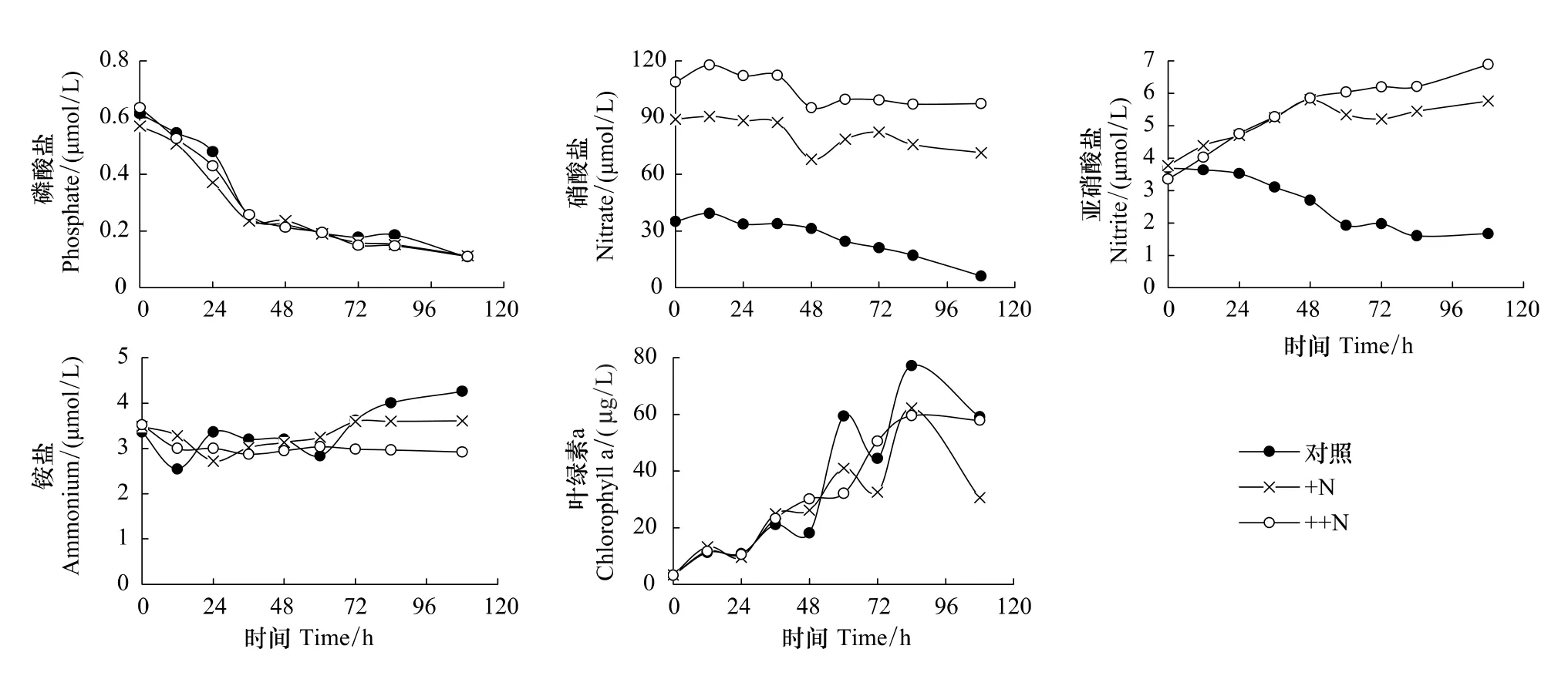
图5 N加富培养实验中氮磷营养盐及叶绿素a浓度的变化Fig.5 Changes of phosphate,nitrate,nitrite,ammonium and chlorophyll a concentration during N enrichment incubations
利用现场培养实验检验水体中营养盐限制在国内也逐渐得到了广泛的应用,如邹立和张经[16]通过现场外加营养盐的受控培养实验,发现在莱州湾附近浮游植物生长受到显著的磷限制,硅酸盐尚不成为限制因子,而渤海海峡及渤海中部不存在营养盐的限制问题。王勇[17]等在胶州湾采用现场添加营养盐的实验方法指出在夏季,N或单独、或与P同时限制浮游植物的生长,在秋季则可能是N与P共同对浮游植物群落产生调控作用,而在冬季,Si是首要的限制浮游植物生长的营养元素。蒲新明[18]等通过现场加富的实验,发现添加KNO3的两组与对照组的生长曲线基本一致,而添加Na2HPO4的两组与N、P都加的两组的生长曲线基本一致,表明:P是起限制作用的营养盐,而N不是。相比较而言,本文现场加P后促进了浮游植物的生长以及对营养盐的吸收,而加N并未促进,表明了春季灌河口邻近海域浮游植物的生长主要受到P的限制,而不受N的限制。
3 结论
(1)春季调查海域共鉴定出浮游植物6门24科36属68种,其中硅藻门29属61种,占总种类数的89.71%,优势度最高的为中肋骨条藻(Skeletonema costatum)。浮游植物丰度介于0.84×106—2.25×106个/L,种类范围为29—39种,叶绿素a浓度在2.66—6.67μg/L变化,多样性指数介于2.60—3.79,基本处于清洁状态。
(2)春季调查海域磷酸盐浓度介于0.35—0.90μmol/L,硝酸盐浓度在31.21—37.00μmol/L变化,灌河口邻近海域无机氮浓度严重偏高,均超出四类标准,磷酸盐浓度相对较低,均未超出二类标准,导致调查区域N/P比严重偏高,且浮游植物叶绿素a与磷酸盐浓度有显著的正相关,而与无机氮无明显线性关系。
(3)在P加富培养实验中,加P明显促进了P本身的吸收,也促进了硝酸盐和亚硝酸盐的吸收,但没有磷酸盐那么显著,铵盐基本上呈增加趋势,P的添加也明显促进了藻类的生长。在N加富培养实验中,加N并未促进硝酸盐本身和磷酸盐的吸收速率,亚硝酸盐在加N组中浓度是增加的,铵盐依然呈增加趋势,培养结速后加N组叶绿素a浓度都小于对照组,N的添加也未促进藻类的生长。加富培养实验表明了春季灌河口邻近海域浮游植物的生长主要受到P的限制,而不是N限制。
[1] Mallin M A.Phytoplankton ecology of North Carolina estuaries.Estuaries and Coasts,1994,17(3):561-574.
[2] Smith SV,Wiebe WJ,Hollibaugh JT,Dollar SJ,Hager SJ,Cole B E,Tribble GW,Wheeler P A.Stoichiometry of C,N,P,and Si fluxes in a temperate-climate embayment.Journal of Marine Research,1987,45(2):427-460.
[3] Malone T C,Conley D J,Fisher T R,Glibert P M,Harding L W,Sellner K G.Scales of nutrient-limited phytoplankton productivity in Chesapeake Bay.Estuaries and Coasts,1996,19(2):371-385.
[4] Harrison P J,Hu M H,Yang Y P,Lu X.Phosphate limitation in estuarine and coastal waters of China.Journal of Experimental Marine Biology and Ecology,1990,140(1/2):79-87.
[5] Chen SZ,Gu Y Q,Liu M G,Zhang M X,Yang SH,Li J.Nutrient distribution at the Huanghe River Estuary.Journal of Ocean University of Qingdao,1991,21(1):34-42.
[6] Dong Y H,Cai JD,Qian H L.Nutrient ratios and its relationship with phytoplankton in the Pearl river estuary.Marine Science Bulletin,2009,28(1):3-10.
[7] Probyn T A.Size-fractionated measurements of nitrogen uptake in aged upwelled waters:implications for pelagic food webs.Limnology and Oceanography,1990,35(1):202-210.
[8] Song W H,Xu JX,Lin B,Zhang G L.The character of changes and distributions of inorganic nitrogen and active phosphorus in Guanhe River Estuary.Ocean Development and Management,2009,26(10):106-110.
[9] Collos Y,Vaquer A,Bibent B,Slawyk G,Garcia N,Souchu P.Variability in nitrate uptake kinetics of phytoplankton communities in a mediterranean coastal lagoon.Estuarine,Coastal and Shelf Science,1997,44(3):369-375.
[10] Bernhard A E,Peele E R.Nitrogen limitation of phytoplankton in a shallow embayment in northern Puget Sound.Estuaries and Coasts,1997,20(4):759-769.
[11] Jiao N Z,Wang R.Size structures of microplankton biomass and production in Jiaozhou Bay,China.Journal of Plankton Research,1994,16(12):1609-1625.
[12] Hu M H,Yang Y P,Xu C L,Harrelson JP.Phosphate limitation of phytoplankton in Changjiang Estuary.Acta Oceanologica Sinica,1989,11(4):439-443.
[13] Hein M,Riemann B.Nutrient limitation of phytoplankton biomass or growth rate:an experimental approach using marine enclosures.Journal of Experimental Marine Biology and Ecology,1995,188(2):167-180.
[14] Beardall J,Berman T,Heraud P,Kadiri M O,Light B R,Patterson G,Roberts S,Sulzberger B,Sahan E,Uehlinger U,Wood B.A comparison of methods for detection of phosphate limitation in microalgae.Aquatic Sciences,2001,63(1):107-121.
[15] Schlüter L.The influence of nutrient addition on growth rates of phytoplankton groups,and microzooplankton grazing rates in a mesocosm experiment.Journal of Experimental Marine Biology and Ecology,1998,228(1):53-71.
[16] Zhou L,Zhang J.Experimental study on the nutrient limitation in the spring of Bohai sea.Oceanologia et Limnologia Sinica,2001,32(6):673-678.
[17] Wang Y,Jiao N Z.Response of phytoplankton to nutrient addition in Jiaozhou Bay.Marine Science,2002,26(4):8-12.
[18] Pu X M,Wu Y L,Zhang Y S.Nutrient limitation of phytoplankton in the Changjiang Estuary Ⅱ.Condition of nutrient limitation in spring.Acta Oceanologica Sinica,2001,23(3):57-65.
参考文献:
[5] 陈淑珠,顾郁翘,刘敏光,张敏秀,杨淑海,李静.黄河口及其邻近海域营养盐分布特征.青岛海洋大学学报:自然科学版,1991,21(1):34-42.
[6] 董燕红,蔡建东,钱宏林.珠江口海域营养盐比及与浮游植物的关系.海洋通报,2009,28(1):3-10.
[8] 宋伟华,徐娇霞,林柏,张国亮.灌河口海域无机氮及活性磷酸盐的变化与分布特征分析.海洋开发与管理,2009,26(10):106-110.
[12] 胡明辉,杨逸萍,徐春林,哈里森J P.长江口浮游植物生长的磷酸盐限制.海洋学报,1989,11(4):439-443.
[16] 邹立,张经.渤海春季营养盐限制的现场实验.海洋与湖沼,2001,32(6):673-678.
[17] 王勇,焦念志.胶州湾浮游植物对营养盐添加的相应关系.海洋科学,2002,26(4):8-12.
[18] 蒲新明,吴玉霖,张永山.长江口区浮游植物营养限制因子的研究 Ⅱ.春季的营养盐限制情况.海洋学报,2001,23(3):57-65.

