甲磺酸加贝酯在小肠缺血-再灌注损伤中的预防作用
王 健,刘振芬
(四川省隆昌县人民医院药剂科,四川 内江 642150)
缺血-再灌注(I/R),损伤是临床实践中最常见的组织器官损伤的病因之一,涉及氧自由基的产生,损伤区炎性细胞浸润等多因素、多阶段复杂的病理生理过程。肠I/R损伤引起消化道局部组织的损害可诱发肠内细菌移位、大量毒素进入体循环,引起炎性介质与细胞因子释放从而导致全身炎性反应、多器官功能衰竭(MODS)甚至死亡[1]。近年来,根据I/R损伤的发生机制采用缺血预处理,低温低流量再灌注,抑制、清除氧自由基氧的产生,抗白细胞聚集黏附等治疗方法来减轻I/R后损伤[2]。然而,迄今尚无一种特效方法能彻底解决这一医学难题。甲磺酸加贝酯是一种非肽类蛋白酶抑制剂,可抑制胰蛋白酶、激肽释放酶、纤维蛋白溶酶、凝血酶等多种蛋白酶的活性,抑制炎症介质的释放,从而减轻炎性反应。本试验运用兔肠I/R模型,颈外静脉应用甲磺酸加贝酯治疗,观察其在肠I/R损伤中的保护作用,旨在探求防治肠I/R损伤的新方法。
1 材料与方法
1.1 材料
健康新西兰白兔60只,体重(2.0±0.3)kg,均购于泸州医学院实验动物中心,雌雄不限,随机分为假手术组、对照组、肠I/R组和药物治疗组,每组15只。甲磺酸加贝酯注射液由四川阳光润禾药业有限公司提供,规格为100mg/支的水溶液。
1.2 方法
标准饲料适应性喂养2周。手术前12 h开始禁食,不禁水,腹腔注射2%硫喷妥钠3mL/kg麻醉后,取右侧卧位,固定于手术台上。右腹股沟区、左腹部备皮、消毒,切开分离出右股动脉,插管,接三通管并连接含有肝素的0.9%氯化钠注射液(肝素0.01 g/L)5mL注射器上(供抽血用)。手术分离肠系膜上动脉(SMA)后,用无损伤血管夹夹闭其根部,1 h后松夹再灌注,关闭切口,术后按试验组分笼饲养。
1.3 动物试验模型制作
将动物随机分成4组,每组15只。模型组:将动物进行上述操作,动脉夹夹闭SMA 1 h松夹;药物治疗组:操作同模型组,在夹闭SMA 30min后经颈外静脉脉注射甲磺酸加贝酯30mg/kg;假手术组:动物进行上述操作,但不夹闭SMA;正常组:不进行手术,正常饲养,麻醉后立即取标本。其余组再灌注6 h后采集门、体静脉血,行左肺灌洗并收集支气管-肺泡灌洗液(BALF),取右肺、肝及小肠组织。
1.4 观察指标与方法
取回盲部近端约16 cm处肠管4 cm,常规石蜡包埋,切片后HE染色;应用OLYMPASBX-50多功能显微镜,观察不同视野并选片照相。运用显微图像分析系统(VIDAS)随机选出每张切片上黏膜内的3个视野进行图像分析,测其平均吸光度值(A值)。肠组织病理分级遵照Chiu等[3]的标准,按照双盲法原则进行。BALF中蛋白含量采用磺基水杨酸透射比浊法测定;门、体静脉血内毒素采用偶氮显色法测定,试剂盒由北京医学化验所提供;肺组织中髓过氧化酶(MPO)含量测定参考Krawisz等[4]的方法。放血处死动物后迅速开胸整块取出肺、肝及小肠组织,立即以0.9%氯化钠注射液进行匀速灌洗;取8~12 g肺组织,加入80mL含0.5%十六烷基三甲基溴化胺的50 mmol/L磷酸钾缓冲液(pH=7.4),用超声细胞粉碎机将其治成组织均浆,离心15min,取20mL上清液加0.3%过氧化氯溶液1.8mL、100mmol/L 4磷酸钾缓冲液30mL及0.041mol/L二茴香胺溶液20mL;用724型分光光度计在460 nm波长处测定1~3min时 A值变化值,按照公式MPO活性=△A460×13.5/肺重量(g)计算每克湿肺组织的MPO活性。以每10个高倍视野中中性粒细胞(PMN)的数目测定肝组织病理切片中PMN浸润程度。
1.5 统计学处理
计量资料的比较采 t检验或方差分析,等级资料的比较采用秩和检验,取 α =0.05。
2 结果
试验结果显示,正常组与假手术组绒毛上皮细胞排列规整,肠壁组织均匀。模型组可见肠上皮细胞明显水肿,壁变薄,小肠绒毛短细间距变宽;部分上皮细胞坏死脱落,肠黏膜固有层内腺体可见灶性区域坏死及淋巴细胞、中性粒细胞浸润;模型组肠病理分级明显高于假手术组(P<0.05)和正常组(P<0.01),见表 1。肠I/R损伤致多器官损伤指标比较见表2。肠I/R对组织中PMN的影响见表3。
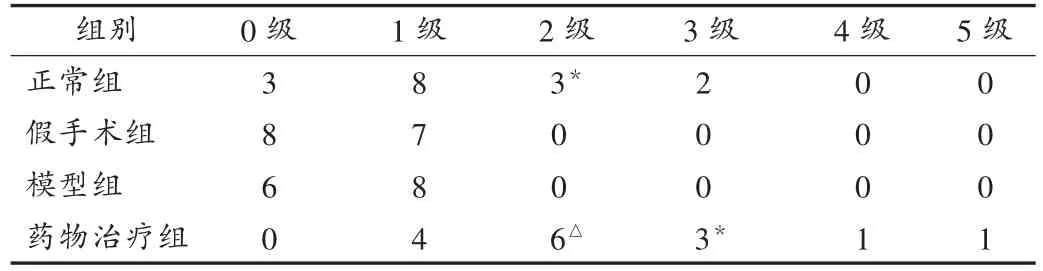
表1 各组兔肠的病理分级(只,n=5)
3 讨论
小肠黏膜是迄今发现I/R损伤最敏感的脏器之一,肠I/R是应激状态中必经的病理生理过程。目前认为,肠黏膜低灌注、氧自由基损伤及细胞因子作用是肠黏膜三大主要致伤因素[5]。黄嘌呤氧化酶形成增多、中性粒细胞的呼吸爆发、线粒体功能受损、儿茶酚胺自身氧化增加等而导致部分动物或患者细胞功能代谢障碍及肠上皮细胞坏死、微绒毛分离及固有层崩解[6]。另外,肠道屏障破坏后细菌移位,细菌毒素入血后而导致时空性炎性反应和毒血症[7],其诱发的MODS和脓毒症的研究一直是国内外的热点、难点,但目前尚缺乏对缺血后肠黏膜局部炎症损害和全身炎性反应无针对性的治疗药物。
表2 肠I/R致多器官损伤各组指标比较(±s)
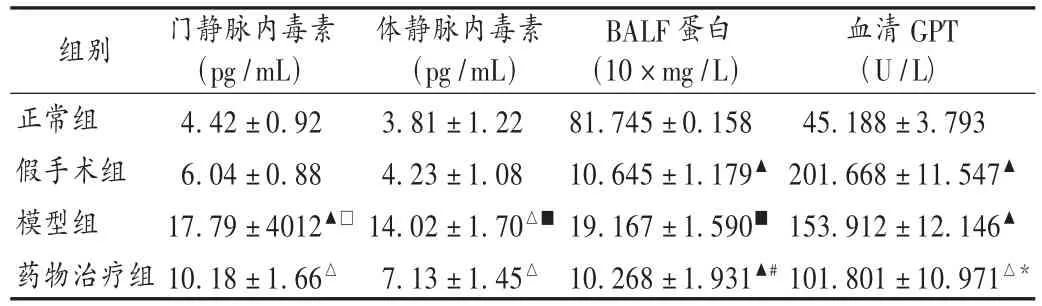
表2 肠I/R致多器官损伤各组指标比较(±s)
注:与正常组比较,△P<0.05,▲P<0.01;与模型组相比较,*P<0.05,#P<0.01;与假手术组相比,□P <0.05,■ P <0.05。下表同。
组别正常组假手术组模型组药物治疗组门静脉内毒素(pg/mL)4.42 ±0.92 6.04 ±0.88 17.79 ±4012▲□10.18 ±1.66△体静脉内毒素(pg/mL)3.81 ± 1.22 4.23 ± 1.08 14.02 ± 1.70△■7.13 ± 1.45△BALF蛋白(10×mg/L)81.745 ±0.158 10.645 ±1.179▲19.167 ±1.590■10.268 ±1.931▲#血清GPT(U/L)45.188 ±3.793 201.668 ±11.547▲153.912 ±12.146▲101.801 ±10.971△*
表3 肠I/R对组织中PMN的影响(±s)
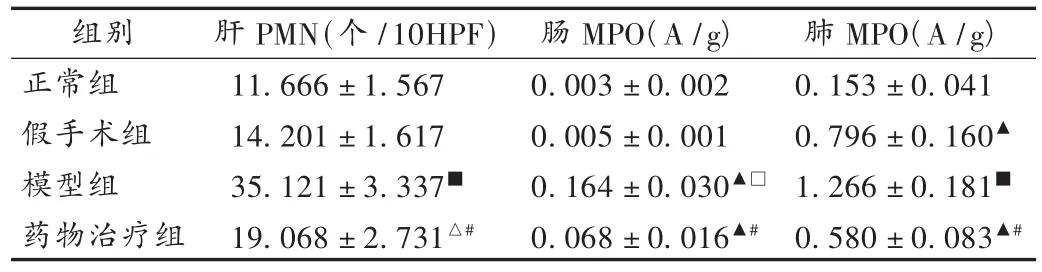
表3 肠I/R对组织中PMN的影响(±s)
组别正常组假手术组模型组药物治疗组肝PMN(个/10HPF)11.666 ± 1.567 14.201 ± 1.617 35.121 ± 3.337■19.068 ± 2.731△#肠MPO(A/g)0.003 ± 0.002 0.005 ± 0.001 0.164 ± 0.030▲□0.068 ± 0.016▲#肺MPO(A/g)0.153 ± 0.041 0.796 ± 0.160▲1.266 ± 0.181■0.580 ± 0.083▲#
本研究中观察了静脉给予甲磺酸加贝酯对肠I/R损伤后的全身炎性反应及多器官功能障碍的影响,结果表明,在肠缺血早期肠内给予甲磺酸加贝酯能多靶点干预肠I/R损伤的基本病理环节,增加肠黏膜血流量,降低血浆肿瘤坏死固子α(TNF-α)的水平,抑制PMN活化、聚集,减轻肝、肺、小肠及肠系膜淋巴结炎性细胞浸润及组织损伤,从而减轻炎性反应,对于防治肠I/R损伤和MODS具有潜在临床应用价值。PMN活化可与内皮细胞的黏附从而促进氧自由基及溶酶体酶释放造成组织损伤,是引起MODS的共同原因之一;PMN与内皮细胞的黏附还能造成微循环障碍,组织器官内皮细胞水肿,阻碍血红蛋白向组织细胞释放氧,进一步加重组织损伤。在本研究中发现,肠I/R中肝、肺等远端组织器官均可见PMN等炎症细胞浸润增加,提示PMN在肠I/R以及所致的全身炎性反应及MODS中有重要作用,抑制PMN的活性有望成为治疗和预防I/R的新的潜在靶点。
[1]Albayrak Y,Halici Z,Odabasoglu F,etal.The effects of testosterone on intestinal ischemia/reperfusion in rats[J].J Invest Surg,2011,24(6):283-291.
[2]刘爱芬.肢体缺血再灌注损伤的研究进展[J].医学综述,2005,1(12):1 130-1 132.
[3]Chiu J,Mcardle AH,Brown R,etal.Intestinalmucosal lesion in low - flow states[J].Arch surg,1970,101(4):478 - 483.
[4]Krawisz JE,Sharon P,Stenson WF.Quantitative assay for acuye intestinal inflammation based on myeloperoxidase activity[J].Gastroenterology,1984,87(10):1 344 - 1 350.
[5]刘海光,杜 丹,伦明辉,等.缺血再灌注损伤降低肠粘膜屏障功能的初步研究[J].大连医科大学学报,2004,26(1):17-19.
[6]Hwang J,Kim J,Park S,etal.Magnesium sulfate does not protect spinal cord against ischemic injury[J].InvestSurg,2011,24(6):250 - 256.
[7]Park JJ,Chung KY,Nam YS.Two - day fasting prior to intestinal ischemia-reperfusion injury on bacterial translocation in rats[J].Invest Surg,2011,24(6):262 -266.

