Pax6在翼状胬肉上皮鳞状化生中的表达及临床意义
黄海东,王明月,郭 颖,管 迪,李鸿甫,尹 禄
目前翼状胬肉的发病机制尚未明确,流行病学的调查结果显示,翼状胬肉多发生于生活在多尘、日照强烈及炎热等环境的人群中,一些户外工作者也容易发生翼状胬肉[1]。有研究者用大剂量的紫外线照射大鼠,结果发现大鼠角膜基质血管形成、前弹力层变性、上皮增生,因此认为紫外线与翼状胬肉的发生关系密切,这可能是环境因素中最重要的因素[2]。Pax6是一种与眼球发育有关的基因,无论是低等线虫还是高等生物人类的眼球发育中,Pax6均发挥了一定的作用,而基因突变可以引发严重异常发育。近些年来,随着研究的深入,已经证实了在晶体及视网膜发育中Pax6的重要性,但关于眼表面上皮细胞中Pax6异常表达的研究很少。笔者应用免疫组织化学法对Pax6在翼状胬肉中的表达情况进行了检测,同时用 K19、K10、MUC5AC检测翼状胬肉上皮鳞状分化,探讨Pax6在翼状胬肉上皮鳞状化生中的表达,现报告如下。
1 资料与方法
1.1 临床资料 选择2011年5月—2012年7月我院眼科25例翼状胬肉标本为观察组,均符合翼状胬肉诊断标准[3];同时选择25例健康眼结膜标本为对照组,眼科检查除外沙眼、过敏性结膜炎、慢性泪囊炎、睑缘炎以及患有其他眼部病变的病例,所有入选病例均无眼科长期用药史。其中观察组男11例,女14例,年龄30~65(45.3±10.4)岁,右眼10例,左眼15例。对照组男12例,女13例,年龄33~69(45.6±11.5)岁,右眼9例,左眼16例。两组眼结膜标本提供者在年龄、性别上无统计学差异(P>0.05),具有可比性。
1.2 方法
1.2.1 翼状胬肉手术方法:常规消毒手术部位,采用表面麻醉,将2%的利多卡因注射于翼状胬肉结膜下,用剪刀在显微镜下将正常眼结膜与翼状胬肉分离,剪除分离的翼状胬肉,同时将变性的结膜下组织清除,必要时可应用烧灼止血。然后沿0.5 mm透明角膜区划切,剥离包括胬肉头部的角膜浅层,在球结膜上方取一块游离球结膜组织植片(包括角膜缘上皮组织),拖到原胬肉植床处,将组织植片展平,与相应角膜缘对应。将植片对位间断缝合,于巩膜浅层固定。手术完毕后将妥布霉素地塞米松眼膏涂至结膜囊,包扎手术眼部。
1.2.2 免疫组织化学染色法:选择鼠抗人单克隆抗体 Pax6、K19 及 K10、MUC5AC,DAPI、OCT 包埋剂,FITC标记的山羊抗鼠IgG二抗,冰冻切片机(Leica CM1850),倒置荧光显微镜(Nikon TE2000)。用4%多聚甲醛固定组织切片15 min,然后置于过氧化氢甲醇溶液(0~3%)中30 min,将内源性过氧化物酶灭活。用PBS清洗标本3次,每次清洗5 min,将第一抗体(已经过血清稀释液稀释)加入,在4℃冰箱中孵育过夜,将抗体吸除,PBS清洗3次,每次清洗15 min。将生物素标记兔抗鼠二抗(已经过血清稀释液稀释)滴加入标本中,在室温下孵育1 h,然后吸除抗体,再次用PBS洗涤,每次清洗5 min,共清洗3次。加入亲和素-生物素-过氧化物酶复合物(ABC),孵育 30 min,用 PBS洗涤,每次清洗5 min,共清洗3次。二氨基联苯胺(DAB)显色50 s,反应终止。用乙醇梯度脱水,二甲苯透明,封片(中性树胶)。在光镜下进行观察并照相。PBS代替一抗行阴性对照。
1.3 评价标准 根据 Pax6、K19、K10及MUC5AC在正常眼结膜组织及翼状胬肉两组标本中的表达情况及吸光度值评价Pax6在翼状胬肉上皮鳞状化生中的表达。
1.4 统计学处理 采用SPSS 13.0统计学软件处理数据,计量资料结果以均数±标准差(±s)表示,采用t检验,α=0.05为检验水准。
2 结果
2.1 Pax6阳性表达情况及吸光度值比较 对照组上皮细胞全层均有 Pax6大量表达,吸光度值为46710±3712;观察组上皮细胞Pax6表达量显著降低,以基底层上皮细胞丢失的Pax6最显著,吸光度值为31984±5413,两组比较差异有统计学意义(t=5.011,P=0.000)。
2.2 上皮细胞表型K19、K10阳性表达吸光度值比较 两组K10及K19阳性表达吸光度值比较差异有统计学意义(P=0.000),见表1。
2.3 黏蛋白MUC5AC阳性表达情况及吸光度值比较 观察组MUC5AC阳性表达吸光度值平均为702±894;对照组MUC5AC阳性表达吸光度值平均为7132±2784。两组比较差异有统计学意义(t=5.136,P=0.000)。
表1 翼状胬肉与正常眼结膜标本上皮细胞表型K19、K10阳性表达吸光度值比较(±s)
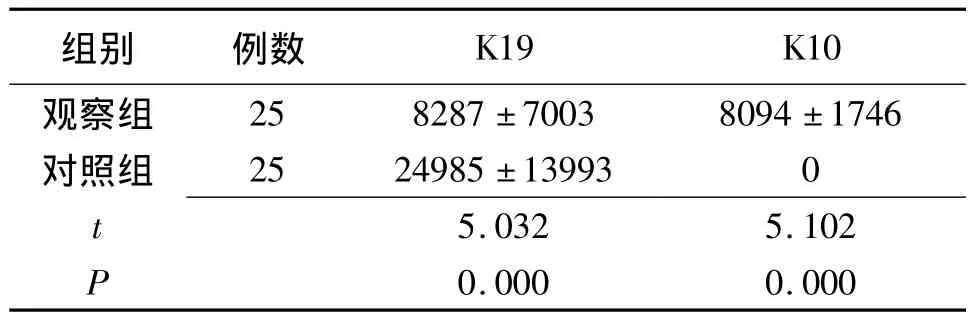
表1 翼状胬肉与正常眼结膜标本上皮细胞表型K19、K10阳性表达吸光度值比较(±s)
注:观察组:翼状胬肉标本,对照组:健康眼结膜标本
组别 例数K19 K10观察组25 8287±7003 8094±1746对照组 25 24985±13993 0 5.032 5.102 P t 0.000 0.000
3 讨论
在各种生物眼睛发育的过程中均有Pax6转录因子的存在,甚至是在果蝇等昆虫中,Pax6都是眼睛分化过程的要素之一[4]。含有配对盒基因序列是Pax基因家族共同的特点,人们首先在果蝇体节基因发现该结构。相关的研究表明,脊椎动物共有Paxl-Pax99组Pax基因,Pax6是人类无虹膜基因,约25 kb,由至少14个外显子组成。无论在非脊椎动物还是脊椎动物中,Pax6基因均十分保守,在生物生长及发育具有重要意义。到目前为止,人们发现了70余种与鼠眼发育相关的、已经定位的基因,其中最重要的基因即为Pax6,其具有高度保守的表达方式,在遗传性眼病的发病过程中发挥一定作用[5-6]。
鳞状上皮化生是一种病理过程,是Stevens-Jobnson综合征、维生素A缺乏综合征、热/化学伤、干燥综合征、眼类天疱疮等多种严重眼科疾病出现干眼表现的标志。李明渊等[7]对50例翼状胬肉患者眼表变化进行了检查,发现所有患者翼状胬肉表面的结膜均有不同程度的鳞状上皮化生。K19作为角质蛋白是细胞的骨架蛋白[8],在正常结膜上皮中,是一种重要的组成蛋白[9]。在正常结膜上皮中,K10并不表达,在角化上皮中是终末分化标志物。MUC5AC是泪膜黏液层的重要组成成分,具有维持泪膜稳定性的重要作用,还对泪膜在眼表分布起促进作用[10]。MUC5AC在正常结膜组织上皮表皮层中呈簇状散在或者单个分布,在翼状胬肉组织中表达明显减弱,大多数上皮并无MUC5AC表达。本研究结果证实,MUC5AC及K19在翼状胬肉上皮中的表达下降明显,而K10则出现了较多的阳性表达,进一步说明翼状胬肉上皮有鳞状上皮化生发生[11]。Pax6在胚胎眼发育中是起主导作用的基因,在眼组织多种类型的上皮细胞中均有表达。出生后,Pax6主要在眼部晶状体上皮细胞、角结膜、视网膜无长突细胞、虹膜等处表达,而在皮肤上皮中无表达[12]。眼球发育很可能因为Pax6基因突变而出现异常,导致遗传性角膜炎、先天性无虹膜等疾病发生。本实验主要研究翼状胬肉发病过程中Pax6上皮鳞状化生中的意义,发现正常眼结膜上皮细胞全层均有Pax6大量表达,翼状胬肉上皮细胞Pax6表达量显著降低,以基底层上皮细胞丢失的Pax6最显著。
综上所述,Pax6基因具有调控并维持眼表面结膜上皮表型正常的作用,其表达下降可能促进翼状胬肉出现鳞状上皮化生[13]。因此,治疗翼状胬肉时采用基因治疗技术[14-16],应用分化抑制剂或者将Pax6基因导入翼状胬肉异常分化的上皮中,应该能够成为治疗翼状胬肉的有效方法[17-22]。
[1]邓莹莹,周霞,孙荣,等.翼状胬肉手术前后对比敏感度和角膜地形图改变的比较[J].临床眼科杂志,2013,21(2):117-119.
[2]赵堪兴,杨培增.眼科学[M].7版.北京:人民卫生出版社,2010:102-103.
[3]梅永新,沈建国.翼状胬肉逆行切除联合角膜缘干细胞移植术的疗效观察[J].中国现代医生,2011,49(6):23-24.
[4]杨真龙,贾卉,施小茹,等.西藏翼状胬肉的流行病学调查[J].吉林医学杂志,2008,28(15):1660-1662.
[5]李奇观,黄伟梅,陈思敏,等.翼状胬肉手术方式对眼前节屈光状态改变的临床研究[J].国际眼科杂志,2013,13(4):680-682.
[6]张海侠,栾春生,胡艳波.翼状胬肉切除联合球结膜瓣移植术后发生角膜上皮缺损[J].临床误诊误治,2010,23(9):879.
[7]李明渊,唐仁泓.HIF-1与VEGF在翼状胬肉中的表达及意义[J].眼科研究,2009,27(3):213-215.
[8]王新宇,许爱娥,傅丽芳,等.毛囊外根鞘细胞的分离培养及鉴定[J].中国现代医生,2013,51(6):1-3,6,封3.
[9]李淑琳.翼状胬肉发病机制的研究进展[J].眼科研究,2009,27(3):247-250.
[10]Li W,Chen Y T,Hayashida Y,et al.Down-regulation of Pax6 is associated with abnorm al difierentiation of corn eal epithelial cells in severe ocular surface diseases[J].J Pathol,2008,214(1):114-122.
[11]张伶俐,刘虹.谷氨酰转移酶2与基质金属蛋白酶2和白细胞分化抗原24对翼状胬肉复发的影响[J].中国医药,2012,7(8):1029-1030.
[12]Dong N,Li W,Lin H,et al.Abnormal epithelial differentiation and tear film alteration in pinguecula[J].Invest Ophthalmol Vis Sci,2009,50(6):2710-2715.
[13]Chui J,Di Girolamo N,Wakefield D,et al.The pathogenes is of pterygium:current concepts and the ir therapeutic implications[J].Ocu Surf,2008,6(1):24-43.
[14]单保生.微创翼状胬肉切除联合自体角膜缘干细胞移植治疗翼状胬肉[J].中国煤炭工业医学杂志,2013,16(5):754-755.
[15]高浩溟,李建国,魏巍.自体游离球结膜瓣移植治疗翼状胬肉的临床观察[J].中国医药,2012,7(9):1162-1163.
[16]肖兴爽,张艳玲,于志涛.翼状胬肉切除联合自体角膜缘干细胞移植疗效观察[J].中国煤炭工业医学杂志,2011,14(9):1305-1306.
[17]刘志英,余金龙.Bcl-2、Ki-67、VEGF在翼状胬肉中的表达[J].农垦医学,2008,30(6):458-461.
[18]董诺,李程,李炜,等.Pax6在翼状胬肉上皮鳞状化生中的异常表达[J].眼科学报,2010,25(1):45-47.
[19]Mery G,Maalouf T,George J L,et al.Limbal-conjunetival autograft in pterygium surgery[J].J Fr Ophthalmol,2010,33(2):92-98.
[20]Kheirkhah A,Sail H,Molaei S,et al.Effects ofpterygium surgery on front and back corneal astigmatism[J].Can Ophthalmol,2012,47(5):423-428.
[21]Takdcs A I,Nagy Z.Microkeratome-assisted anterior lamellar keratoplasty for the removal of corneal scar,caused by pterygium[J].Orv Hetil,2009,150(25):1167-1171.
[22]Wu P L,Kuo C N,Hsu H L,et al.Effect of pterygium surgery on refractive Spheroey inder power and corneal topography[J].Ophthalmic Surg Lasers Imaging,2009,40(1):32-37.

