在离子液体介质中壳聚糖席夫碱衍生物的合成与表征
刘 蒲,李克让,张 帅
(郑州大学化学与分子工程学院,河南郑州450001)
0 引言
壳聚糖是迄今发现的自然界中唯一含有氨基的碱性多糖.壳聚糖具有多样的生物活性、极好的生物相容性、生物可降解性以及无毒性而受到越来越广泛的重视[1].壳聚糖分子链上分布有羟基和氨基活性基团,通过化学改性可以得到应用更加广泛的壳聚糖衍生物,因此壳聚糖的改性研究成为壳聚糖研究领域中的重要课题之一.壳聚糖分子链上的自由氨基可以与醛发生缩合反应生成壳聚糖席夫碱衍生物.壳聚糖席夫碱衍生物具有吸附金属离子、抗菌、药物载体等用途.壳聚糖席夫碱的合成可分为两种方法:(1)传统方法:一般在醇溶液中对壳聚糖进行溶胀,再进行席夫碱反应[2].该方法存在反应时间长、取代度低等问题,而且若温度控制不佳,在改性过程中可能会发生壳聚糖的水解等反应[3].(2)在超声波[4]或微波条件下[5]对壳聚糖进行席夫碱化,该方法效率高,取代度大.但在超声波和微波条件下,反应强度大,可能对壳聚糖分子结构产生影响.
离子液体具有蒸气压低、熔点低、易操作、可溶性好和稳定性高等特性.由于离子液体能够破坏壳聚糖分子内和分子间的氢键,是壳聚糖的良好溶剂,壳聚糖可在离子液体中溶解并进行酰[6]、接枝[7]等反应.文献调研表明,在离子液体中对壳聚糖进行席夫碱化改性少有文献报道.
离子液体BmimCl制备方法简单,成本低,而且壳聚糖在BmimCl中有较好的溶解性[8],有利于进一步对壳聚糖进行衍生化.
笔者以BmimCl离子液体为反应介质,以水杨醛作为反应试剂,通过研究得到了在离子液体介质中制备壳聚糖水杨醛席夫碱的最佳反应条件,并在此最佳反应条件下合成了一系列壳聚糖席夫碱衍生物.
1 实验部分
1.1 原料及仪器
壳聚糖:200 kDa,山东荣成鲁阳化学品公司,使用前经脱乙酰处理;10 kDa、5 kDa,济南海得贝生物有限公司;2 kDa,大连中科格莱克生物科技有限公司;N-甲基咪唑:99%,浙江凯乐化工有限公司,使用前经减压蒸馏;氯代正丁烷、水杨醛等均为分析纯.
Nicolet 380型红外光谱仪;Bruker DPX-400型超导核磁共振波谱仪(TMS为内标);Panalytical X’PertPro型X-射线粉末衍射仪.
1.2 BmimCl的制备
参照文献[9]报道的制备方法合成.产物的1H-NMR(D2O,ppm)为:0.76-0.80(t,CH3-inCH3CH2CH2CH2-),1.13-1.23(q,CH2-inCH3CH2-),1.68-1.75(h,CH2-inCH3CH2CH2-),3.77(s,CH3-inN-CH3),4.05-4.09(t,CH2-in N-CH2-),7.31-7.32(t,CH-in-CH=CH-),7.36-7.37(t,-CH=CH-),8.62(s,CH-inN=CH-),与文献[9]一致.
1.3 壳聚糖水杨醛席夫碱衍生物的制备
将10 g BmimCl加入到三口瓶中,升温至70℃,待BmimCl全部溶解后,加入0.15 g壳聚糖,搅拌溶解约4 h,然后调节至设定反应温度,于恒压滴液漏斗滴加一定量的水杨醛,反应一定时间.反应结束后,将反应液倒入100 mL无水乙醇中进行沉降,过滤得固体物质,对其用无水乙醇进行索氏提取至无醛和反应介质后,真空干燥至恒重,得黄色固体粉末产品.壳聚糖水杨醛席夫碱的合成路线如图1所示.
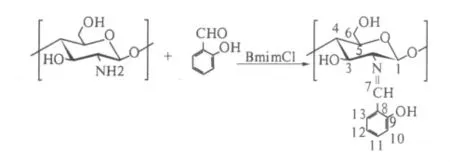
图1 BmimCl中壳聚糖席夫碱衍生物的合成Fig.1 Synthesis of chitosan schiff base in BmimCl
1.4 取代度的测定
将6 mg样品溶于0.6 mL 5% 体积分数HCl-D2O溶液中,在343 K下对壳聚糖及其席夫碱衍生物进行NMR测定,根据1H-NMR测定结果计算产物取代度[10].
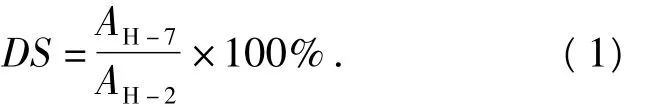
式中:AH-7为1H-NMR中CH═N官能团中氢的积分面积;AH-2为1H-NMR中壳聚糖分子链上2-H峰的积分面积.
2 结果与讨论
2.1 壳聚糖水杨醛席夫碱衍生物的合成
2.1.1 壳聚糖中氨基与水杨醛摩尔比对产物取代度的影响
反应条件为壳聚糖:0.15 g;BmimCl:10 g;反应温度:70℃;反应时间:2 h,壳聚糖中氨基与水杨醛摩尔比对产物取代度的影响见表1.由表1可以看出产物取代度先随壳聚糖中氨基与水杨醛摩尔比的增大而增大,当壳聚糖中氨基与水杨醛摩尔比大于1∶2.5时取代度反而降低.在实验过程中,我们发现随着水杨醛量的增加,反应体系的黏度逐渐增大.这可能是因为当壳聚糖中氨基与水杨醛摩尔比大于1∶2.5时,此时反应体系较高的粘度阻碍了水杨醛的扩散,从而导致在水杨醛摩尔量较高的情况下取代度较低的现象.因此,壳聚糖与水杨醛的最佳摩尔比为1∶2.5.

表1 壳聚糖与水杨醛摩尔比对席夫碱产物取代度的影响Tab.1 The effect of molar ratio of chitosan to salicylaldehyde on the DS of chitosan schiff base derivates
2.1.2 反应温度对产物取代度的影响
反应条件为壳聚糖:Chitosan:0.15 g;BmimCl:10 g;n(CS)∶n(SA):1∶2.5;反应时间:2 h,反应温度对产物取代度的影响见表2.由表2可知,随反应温度提高,产物取代度随反应温度的提高而增加;当温度80℃以上时,产物取代度随温度提高增加不明显.所以适宜的反应温度为80℃.

表2 反应温度对席夫碱产物取代度的影响Tab.2 The effect of reaction temperature on the DS of chitosan schiff base derivates
2.1.3 反应时间对产物取代度的影响
反应条件为壳聚糖:Chitosan:0.15 g;BmimCl:10 g;n(CS)∶n(SA):1∶2.5;反应温度:80℃,反应时间对产物取代度的影响见表3.

表3 反应时间对席夫碱产物取代度的影响Tab.3 The effect of reaction time on the DS of chitosan schiff base derivates
从表3中数据可知,产物取代度先随反应时间的延长而增大,当反应时间为2 h时,取代度最大,达到29.2%,当反应时间大于2 h后产物取代度略有降低.因此,最佳反应时间为2 h.
综上所述,离子液体BmimCl中,壳聚糖水杨醛席夫碱衍生物的最佳反应条件为:壳聚糖0.15 g,溶解于10 g BmimCl中,壳聚糖中氨基与水杨醛的摩尔比为1∶2.5,反应温度为80℃,反应时间为2 h.
2.2 壳聚糖水杨醛席夫碱衍生物的结构表征
壳聚糖水杨醛席夫碱衍生物的红外、核磁和XRD测定结果如图2~5所示.

图2 壳聚糖(a)和席夫碱产物(b)的IR图谱Fig.2 IR spectra of chitosan(a)and schiff base(b)
从图2红外图谱中可以看出,壳聚糖席夫碱衍生物除具有壳聚糖的特征峰外,还出现一些新的吸收峰:1 631 cm-1处出现C═N的强吸收峰,而且在 1581 cm-1,1 497 cm-1和 1 461 cm-1处出现苯环骨架特征振动吸收峰,754 cm-1为苯环邻位取代的弯曲振动吸收峰,1 278 cm-1处为酚羟基的弯曲振动吸收峰.红外光谱表明壳聚糖与水杨醛发生了席夫碱化反应.

图3 壳聚糖(a)和席夫碱产物(b)的1H-NMR图谱Fig.3 1H-NMR spectra of chitosan(a)and schiff base(b)
图3是壳聚糖及其水杨醛席夫碱产物的1H-NMR谱图.从图3中可以看出,壳聚糖原料的氢谱中各峰均能得到很好的归属,而且在氢谱中没有出现乙酰基的-CH3峰(δ=2.0×10-6左右),说明壳聚糖脱乙酰度为100%.壳聚糖水杨醛席夫碱衍生物的氢谱峰的归属为:δ=10.34×10-6(H-7);δ=7.42-8.15×10-6(H-10,H-11,H-12,H-13,); δ =5.29 ×10-6(H-1);δ=4.14-4.31×10-6(H-3,H-4,H-5,H-6);δ=3.61×10-6(H-2).

图4 席夫碱产物的13C-NMR图谱Fig.4 13C-NMR of schiff base
图4是壳聚糖水杨醛席夫碱产物的13CNMR谱图.图谱中共出现13组峰,位于56.50,60.91,69.0,70.66,75.34和 98.11×10-6处的峰分别归属于壳聚糖单元吡喃糖环上的C-2,C-6,C-3,C-5,C-4和 C-1.除了壳聚糖链上这些固有的峰外,在117.59,121.21,121.79,134.29,138.05和160.16×10-6出现了水杨醛芳香环上的C-10,C-8,C-9,C-11和 C-13信号峰,而且在198.37×10-6处还出现了C═N的信号峰.以上结果表明,壳聚糖与水杨醛发生缩合反应得到壳聚糖水杨醛席夫碱产物.

图5 壳聚糖(a)和席夫碱产物(b)的XRD图谱Fig.5 XRD spectrum of chitosan(a)and chitosan schiff base derivatives(b)
图5是壳聚糖(a)与壳聚糖水杨醛席夫碱(b)的XRD图谱.从壳聚糖的XRD谱图可以看到在2θ为20.2°显示一个尖锐峰,对应壳聚糖的Ⅱ形晶体结构,在2θ为12.1°处有一小的肩峰,对应壳聚糖的Ⅰ形晶体结构.壳聚糖经过水杨醛修饰后,传统方法生成衍生物的 XRD中2θ为20.2°处的峰有较大变化,壳聚糖的晶体结构遭到破坏[11],而在本研究中,2θ为 20.2°处的峰并未发生较大变化,说明壳聚糖在离子液体中进行席夫碱化改性后,壳聚糖Ⅱ形晶体结构并未遭到破坏.在2θ为5.7°处出现一个新的尖锐峰,这可能是由于亚胺键的形成[12]及衍生物上引入的酚羟基形成氢键所导致的.在2θ为12.1°处的肩峰消失,这可能是水杨醛的引入破坏了壳聚糖分子内氢键,壳聚糖的Ⅰ形晶体结构遭到破坏.
2.3 不同分子量壳聚糖水杨醛席夫碱衍生物的合成
在壳聚糖水杨醛席夫碱的最佳合成条件下,合成了不同分子量的壳聚糖水杨醛席夫碱衍生物.结果如表4所示.从表4中可知,200 kDa的壳聚糖席夫碱衍生物取代度最低,为29.2%,5 kDa壳聚糖水杨醛席夫碱衍生物取代度高达71.4%.壳聚糖分子量从5 kDa降低到2 kDa,其席夫碱产物取代度反而降低,其原因可能是2 kDa壳聚糖的脱乙酰度(83.3%)小于5 kDa的(92.4%),水杨醛可进攻的自由氨基较少,导致取代度较5 kDa壳聚糖席夫碱的低.我们还可以看出分子量为200 kDa和10 kDa的壳聚糖,虽然脱乙酰度均为100%,但衍生物的取代度差距很大.其原因可能是分子量为200 kDa的壳聚糖在溶解后其溶液黏度较大,阻碍水杨醛的进攻;而且200 kDa的壳聚糖分子链较长,导致部分自由氨基不能裸露出来,反应位点较少,使得反应衍生物的取代度较低.

表4 不同分子量壳聚糖水杨醛席夫碱产物的取代度Tab.4 The DS of chitosan schiff base derivatives with different molar weight
2.4 不同醛壳聚糖席夫碱衍生物的合成
在壳聚糖水杨醛席夫碱的最佳合成条件下,以不同的醛对壳聚糖(200 kDa)进行改性制得一系列壳聚糖席夫碱产物.产物的取代度如表5所示,用其它醛对壳聚糖进行席夫碱化改性时,不同醛所生成的席夫碱衍生物的取代度有很大差别.导致产物取代度不同的可能原因是所用芳香醛取代基不同所致.如硝基具有钝化作用,导致壳聚糖对硝基苯甲醛席夫碱的取代度低,而羟基的活化作用使得壳聚糖水杨醛席夫碱的取代度高.而且,产物的取代度还可能与醛的空间结构有关,当其空间位阻较大时,阻碍其进攻自由氨基,导致反应取代度低.

表5 系列壳聚糖席夫碱衍生物的取代度Tab.5 The DS of a series of chitosan schiff base derivatives
2.5 离子液体的回收
壳聚糖与水杨醛在最佳反应条件下进行缩合反应后,反应液经无水乙醇沉降、过滤,为考察离子液体的回收性能,我们对过滤液进行离子液体的回收,经旋转蒸发除去滤液中的大量无水乙醇,然后用无水乙醚洗涤溶液至没有水杨醛为止,旋转蒸发除去无水乙醚,真空60℃干燥48 h,BmimCl的回收率为93.8%.
3 结论
(1)利用绿色溶剂离子液体为反应介质,水杨醛与壳聚糖进行缩合反应制得壳聚糖水杨醛席夫碱衍生物,通过实验得到最佳反应条件为:0.15 g壳聚糖溶解于10 g BmimCl中,壳聚糖中氨基与水杨醛摩尔比为1∶2.5,反应温度为80℃,反应时间为2 h,取代度可达29.2%.
(2)在最佳反应条件下合成了系列壳聚糖席夫碱衍生物,产物的取代度可能与醛的取代基及其空间结构有关.
[1]RINAUDO M.Chitin and chitosan:Properties and ap-plications[J].Progress in Polymer Science,2006,31(7):603-632.
[2]仇立干,王茂元.壳聚糖及其改性衍生物对锆(Ⅳ)离子的吸附研究[J].离子交换与吸附,2007,23(6):546-552.
[3]SANTOS J E,DOCKAL E R,CAVALHEIRO É T G.Synthesis and characterization of schiff bases from chitosan and salicylaldehyde derivatives[J].Carbohydrate Polymers,2006,60(3):277-282.
[4]罗洁,陈建山,王贵武,等.水杨醛接枝壳聚糖的制备及其吸附性能[J].化学与生物工程,2006,23(11):25-27.
[5]温燕梅,李思东,钟杰平,等.微波辐射法制备N-亚水杨基壳聚糖Schiff碱及其吸附性能的研究[J].应用化学,2006,23(8):892-896.
[6]MINE S,IZAWA H,KANEKO Y,et al.Acetylation of a-chitin in ionic liquids[J].Carbohydrate Research,2009,344(16):2263-2265.
[7]韩小进,程春祖,朱庆松,等.壳聚糖与L-丙交酯接枝共聚物的均相和非均相合成[J].高分子材料科学与工程,2011,27(1):20-23.
[8]HUDDLESTON J,VISSER A,REICHERT W,et al.Characterization and comparison of hydrophilic and hydrophobic room temperature ionic liquids incorporating the imidazolium cation [J].Green Chemistry,2001,3(4):156-164.
[9]XIE Hai-bo,ZHANG Suo-bo,LI Sheng-hai.Chitin and chitosan dissolved in ionic liquids as reversible sorbents of CO2[J].Green Chemistry,2006,8(7):630-633.
[10]GUINESI L S,CAVALHEIRO É T G.Influence of some reactional parameters on the substitution degree of biopolymeric schiff bases prepared from chitosan and salicylaldehyde [J].Carbohydrate Polymers,2006,65(4):557-561.
[11]袁彦超,章明秋,容敏智.交联壳聚糖树脂对Ni(II)的吸附行为研究[J].化学学报,2005,68(18):1753-1758.
[12]JIAO Ti-feng,ZHOU Juan,ZHOU Jing-xin,et al.Synthesis and characterization of chitosan-based Schiff base compounds with aromatic substituent groups[J].Iranian Polymer Journal,2011,20(2):123-136.

