肾活检标本的制备
孙 璟,武芳芳,郎冬梅
肾活检病理不同于常规病理,除了光学显微镜外,还需要借助免疫病理和电镜的观察,才能作出病理诊断。在肾穿刺活检标本制片过程中,组织的前期处理对标本制作的效果起着关键性作用[1]。根据笔者所在科近年来50例肾活检标本制备体会进行分析,现将在长期实践中摸索出来的一套较好的制备方法介绍如下。
1 标本取材前准备
肾活检标本要进行3种病理检查,因此取出肾标本后就立即分为3部分送检。各种标本固定液均应在穿刺前按不同检视方法置于干净的小瓶内待用。①光镜:清洁的5 ml小瓶,装满FAA混合固定液(配方为10%甲醛10 ml、冰醋酸5 ml和90%乙醇溶液85 ml)盖紧常温保存;②免疫荧光:清洁的5 ml小瓶,瓶中放入浸湿生理盐水的纱布,冰桶内保存备用;③电镜:清洁的1 ml的离心管,加满2%的戊二醛盖紧置冰桶内保存备用[2]。
2 标本的判断与分割
肾穿刺一般应用穿刺针在B超定位下进行。一次可获取1.0~1.5 cm肾组织。肉眼观肾组织髓质颜色暗红,皮质稍浅;在放大镜下,皮质部分可见到肾小球呈小红点结构,放入固定液中,可沉于瓶底。另外,在取材时应注意标本的鉴别,如肌肉组织的颜色与肾组织的颜色相似,相对密度也和肾组织差不多,但其看不到肾皮质小红点。脂肪组织呈黄白色,相对密度小,漂浮于固定液表面。结缔组织呈灰白色,较肾组织质地柔韧,不易切割。如发现无肾小球或不是肾组织,则应重新穿刺取材。
常规在确定为肾组织标本后,应立即分割进行光镜、免疫荧光或电镜检查。操作中需注意标本未固定时,摄取标本动作一定要轻,切勿挤压,避免人为破坏肾组织结构,应在短时间分切标本,不宜过长时间将标本暴露在空气中或强光下,以保持标本的湿润性,否则标本将会缩小、干枯。方法如下:将肾穿刺标本轻轻放在软木板上,分清皮质端和髓质端,用锋利的小刀进行切割,自皮质端切下1~2 mm(分配1~2个肾小球)供电镜检查用,依次再切下3~4 mm(分配1~5个肾小球)供免疫荧光检查用,其余大部分(分配不少于10个肾小球)供光镜检查,如取材标本较少,应先满足染色光镜标本,其次为免疫病理标本。笔者所在科一般制作冰冻切片7~8 张,厚度为 3~4 μm,做 IgG、IgA、IgM、C3、Clq、C4 等抗体检查,石蜡包埋切片 2~3 μm, 分别做常规 HE染色,PAS,Masson、PASM以及刚果红和甲基紫等特殊染色。
标本分割后应立即放于事先准备好的容器内,做免疫荧光的标本,放在经生理盐水浸温的纱布上,连同纱布置于干净容器内,及时经OTC包埋剂包埋切片。光镜标本即放进FAA混合固定液内,电镜标本立即放入2.5%戊二醛内于4℃冰箱内固定。标本装瓶后应及时加盖,并在瓶上写清患者姓名、科室及床号。若未能及时送检标本应置于冰箱中保存待检。
3 标本的具体制备方法
3.1 免疫荧光的制片 方法是肾脏病理学中最重要的方法,最好用冷冻切片机,冷冻切片的肾组织新鲜,抗原保存良好,若暂时不能切片,应将标本放在-70℃低温冰箱内保存。将标本置于冷冻切片机的冷冻头上,加少许OTC包埋剂,于冷室内-20℃切片,厚度要求3~4 mm附贴于载玻片上需要10片以上备用。光镜观察切片有无肾小球(不染色),如有肾小球,则视需要选择相应抗体的种类,切出相应数量的片子,剩余肾组织放入冰箱备用。
3.2 石蜡包埋制备方法 组织的固定:肾组织在固定液内于室温下固定45 min。脱水、透明、浸蜡、包埋:①梯度酒精脱水,以70%-80%-90%-无水乙醇,每梯 2缸,每缸 20 min,二甲苯透明,分2缸,每缸10 min;②浸蜡包埋:优质石蜡(58~62℃)2缸,每缸30 min后包埋。切片:修理蜡块,置于冰箱预冷40 min,在切片机上切出2~3 μm的切片。在实践中发现石蜡切片时需要注意室温不能过高,应保持在25~28℃之间,否则蜡块易溶,不易制片。
3.3 电镜标本制备方法 ①取材:标本要求含有肾小球;②固定:标本立即放入2.5%戊二醛内于4℃冰箱内固定4 h后入0.05 mol/L磷酸缓冲液冲洗3 h,再入1%锇酸于室温下固定1 h;③脱水包埋:依次用50%-65%-75%-85%-95%-无水乙醇脱水,30 min/次;氧化丙烯酸浸透 3 次,15~30 min/次;浸透:浸透1 h;固化,使之聚合变硬,呈淡黄色透明块状;④超薄切片:将包埋块修整,用切片机制成超薄片[2]。许多类型的肾小球疾病诊断必须以电镜下观察其超微结构或免疫电镜结果,才能得出正确诊断。

图1 光镜标本
图2 冰冻标本
4 结果
笔者所在科所处理的98%左右的肾穿刺标本都能确保光镜(图 1)、冰冻(图 2)、电镜(图 3)标本都有肾小球。 按上述程序操作的特殊染色对比鲜艳,效果好,完全可以满足病理诊断。
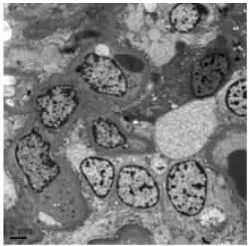
图3 电镜标本
5 体会
结合50例肾穿刺活检病理标本制备情况,现总结体会如下:首先要进行肾活检标本的判断和辨认,因肾穿组织较普通病理体积较小,组织块一定要包好。其次组织在标本分割时要注意动作要轻柔,切片刀要锋利,切片要平整。再次,标本根据需要选择固定液进行固定。在此需要注意的是固定液应为标本体积的10倍。标本装瓶后应及时加盖。最后,进行切片。在标本制片过程中,组织的前期处理对组织制片的效果起到关键作用。所以,在肾穿刺活检组织标本制片中一定要掌握时间,才能保证做出良好的肾脏病理切片,更好的为临床医师诊断提供帮助。
[1]邹万忠.肾活检病理诊断标准指导意见[J].中华肾脏病杂志,2001,17(3):270-275.
[2]王伯沄,李玉松,黄高昇,等.病理学技术[M].北京:人民卫生出版社,2001.948-952.
[3]龚志锦.病理组织制作和染色技术[M].上海:上海科学技术出版社,1994.359.

