滇西北高原纳帕海湿地湖滨带优势植物生物量及其凋落物分解
郭绪虎,肖德荣,2,* ,田 昆,2,余红忠
(1.西南林业大学环境科学与工程学院,昆明 650224;2.国家高原湿地研究中心,昆明 650224;3.云南省香格里拉县林业局保护办,香格里拉 674400)
植物是生态系统碳循环重要的生物因子,决定碳输入的数量、形式及存留时间[1]。植物光合能力、生长速率和凋落物分解强烈影响着生态系统碳的输入和输出过程[2]。作为物质循环和能量流动基础的植物或优势功能群的性状对生态系统功能起着关键作用[3-7]。生态系统碳循环与不同植物物种的形态[8]和化学性状有关[9]。速生植物光合能力强,能通过输入大量的碳以增加土壤碳库,而慢生植物因光合作用率低、碳输入量相对较低。初级生产力成为土壤碳汇的主要驱动因子[1]。另外,植物凋落物的分解也是影响土壤碳汇的关键因素。难分解、存留久的植物凋落物能显著增强土壤的碳储存[10]。因此,不同植物物种对于生态系碳收支的作用不同,从而导致碳汇功能的差异。
滇西北高原湿地属我国封闭与半封闭的独特湿地类型[11]。因地处高寒区域、常年冷湿环境使得湿地生态系统积累了大量的有机物质,成为滇西北自然生态系统最为重要的碳库之一,对区域碳循环以及大气温室气体的平衡有着重要的功能作用[12]。滇西北高原湿地湖滨带拥有丰富的湿地植物,其优势物种的生物量及其凋落物分解是该类型湿地碳循环的关键过程,也是掌握该类型湿地碳汇功能及其碳汇过程的基础和重点,但目前尚缺乏研究。因此,选择滇西北高原典型湿地湖滨带优势植物物种,研究其生物量特征及其凋落物分解过程以及相互间的权衡,对于掌握该类型湿地生态系统碳循环过程与规律、不同湖滨带植物在生态系统碳循环中的作用与贡献具有重要理论意义,同时,为进一步揭示滇西北高原湿地碳汇功能与碳汇过程奠定基础。
本研究选取滇西北高原典型湿地纳帕海湖滨带优势植物茭草(Zizania caduciflora)、水葱(Scirpus tabernaemontani)和刘氏荸荠(Heleocharis liouana)作为研究对象,研究3种湖滨带优势植物(1)群落特征及其地上生物量,(2)凋落物分解过程及其特征,(3)地上生物量与凋落物分解的权衡。通过研究,拟掌握滇西北高原湿地生态系统植物库中碳循环的过程与规律,为揭示湖滨带植物碳汇功能及其贡献奠定基础,同时也为滇西北高原湿地的碳汇功能的保护提供一定的科学依据。
1 材料与方法
1.1 研究区域概况
纳帕海湿地位于滇西北横断山脉中段香格里拉县境内(99°37'—99°43'E,27°49'—27°55'N)(图 1),海拔3260 m,面积3100 hm2。该湿地发育在石灰岩母质上、为第三纪陷落湖,受喀斯特作用的强烈影响、湖盆底部被蚀穿形成落水洞,湖水潜流10 km后汇入金沙江,为我国低纬度高海拔、拥有“面山-湖滨-湖盆”典型结构的封闭与半封闭的独特湿地类型。纳帕海地处滇西北高原、属寒温带高原季风气候区西部型季风气候区,冬季又受青藏高原寒流影响,湿地水量补给主要依靠降雨、地表径流、冰雪融水和湖两侧沿断裂带上涌的泉水,湿地区域年均降雨619.9 mm,干湿季分明,6—9月份为明显湿季、降水量充足、湖水上涨,11月—翌年5月份为明显干季、降水少,每年9月后湖水逐步退落。

图1 纳帕海湿地位置图及其研究区域Fig.1 Location of Napahai wetland and the study area
纳帕海湿地为众多植物区系成分的交汇区,分布有世界广布、旧热带、北温带、东亚、极高山地理成分和淡水湖泊特有植物类型六大地理成分,其中,湖滨带优势植物包括茭草、水葱和刘氏荸荠等。纳帕海独特的地理环境和丰富的植物多样性为诸如国家Ⅰ、Ⅱ级保护鸟类黑颈鹤(Grus nigricollis)、黑鹳(Ciconia nigra)、白马鸡(Crossoptilon crossoptilon)、白琵鹭(Platalea leucorodia)以及国家Ⅰ级保护的地方特有鱼类中甸叶须鱼(Ptychobarbus chungtienensis)提供了良好的栖息生境,成为国内外生物多样性保护关注的热点区域。由于地处高寒地区和常年的湿地生境,植物凋落物分解缓慢,土壤有机质大量积累,发生泥炭化及潜育化,形成沼泽土类型的湿地土壤[13],纳帕海成为滇西北高原重要的土壤碳汇区域。
1.2 研究方法
1.2.1 供试植物的选择
前期研究表明,茭草、水葱、刘氏荸荠等为纳帕海湖滨带分布的优势植物物种[14]。3种植物群落分布区域淹水深度均在20—30 cm。因此,本研究选取这3种湖滨带优势植物作为研究对象,通过其生物量与凋落物分解过程的研究,拟掌握纳帕海湖滨带优势植物群落特征与地上生物量,以及其凋落物分解过程,分析典型湖滨带植物在碳循环过程中的作用及其碳“汇”效率。
1.2.2 生物量与凋落物分解研究
纳帕海湖滨带植物多为1年生植物、生长期相对较短。2010年10月(湖滨带植物生长末期),选择茭草、水葱和刘氏荸荠等植物群落主要分布区域(99°40'10.8″—99°40'14.5″E,27°49'37.7″—27°49'49.3″N),分别随机设置3个1 m ×1 m的样方,对植物群落进行实地调查、记录群落的外貌特征,主要包括群落密度、高度、盖度等指标。同时,在每个调查样方中分别齐地刈割25 cm ×25 cm植株,带回实验室放置于65℃的烘箱中、烘干至恒重,用电子天平分别进行称重,研究和分析3种湖滨带植物地上生物量。
同时,收集足量的3种湖滨带植物凋落物、带回实验室,仔细剔除泥土等杂质,放置65℃的烘箱中烘干至恒重,分别称取样品10 g、装入已编号的尼龙网袋(网袋大小为20 cm ×25 cm,网眼为2 mm ×2 mm)中,每湖滨带植物凋落物36袋。将装有凋落物的尼龙网袋分别放回各群落生长的原生自然环境中(20—30 cm淹水生境),并用尼龙线系于竹竿上以固定。从2010年11月始,将装有凋落物的尼龙网袋取回(每物种3袋),放置于65℃的烘箱中烘干并称重,计算湖滨带植物凋落物每月失重率。在试验期间、通过美国PORTLOG便携式自动气象站监测纳帕海湿地区大气温度指标。
1.3 数据统计与分析
依据Olson提出的指数衰减模型[15],计算纳帕海湖滨带植物凋落物分解速率常数k值:
xi/x0=e-kt
式中,x0为凋落物的起始质量(g);xi为凋落物分解后的剩余质量(g);t为凋落物的分解时间(m)。其中,k值越大表明植物凋落物分解速率越快。
运用SPSS11.5统计软件、采用单因素方差分析(One-Way ANOVA),最小显著差数法(LSD)对纳帕海湖滨带植物地上生物量及其凋落物分解的相关指标进行差异性检验,对不符合单因素方差齐性检验的数据进行log(x+1)的处理,显著性水平设定为α=0.05。
2 结果
2.1 群落特征与地上生物量
茭草、水葱、刘氏荸荠为纳帕海湿地湖滨带单优植物群落,其群落盖度分别为(40±14.1)%、(75±14.2)%、(65±14.2)%(图2)。3种湖滨带植物群落密度较高,其中,刘氏荸荠群落密度(1592±57)株/m2显著高于水葱(712±11)株/m2和茭草(480±45)株/m2(P<0.05)(图2)。水葱群落高度最高(191.5±5)cm,其次是茭草(135.2±4.8)cm和刘氏荸荠(56.7±2.1)cm(图2)。3种湖滨带植物群落地上生物量存在差异,茭草、水葱和刘氏荸荠植物群落地上生物量分别为(853.6±58.2)g·m-2·a-1、(730.7±7.8)g·m-2·a-1和(338.9±32.6)g·m-2·a-1(图2),其中,茭草和水葱地上生物量显著高于刘氏荸荠地上生物量(P<0.05)。
2.2 植物凋落物分解特征
纳帕海湖滨带植物凋落物月平均分解速率不同(图3)。2010年10月—2011年1月,随着月平均温度的逐步降低,刘氏荸荠、茭草和水葱凋落物的月分解速率均呈现逐渐减少的趋势,而在2011年2月—2011年9月,随着区域月平均温度的回升,3种湖滨带植物凋落物月平均分解速率均呈现不断增加的趋势,其中,2—5月分解率开始升高,6—7月分解率最高,分解最快,8、9月分解率缓慢回落。
纳帕海湖滨带不同植物凋落物分解速率常数不同(图4),其中,刘氏荸荠、茭草凋落物分解速率常数k值分别为0.067 ±0.0026和0.062±0.0072,两者显著高于水葱凋落物分解速率常数 k值(0.039 ±0.0062)(P<0.05),这表明刘氏荸荠凋落物最易分解、其次为茭草凋落物,水葱凋落物最不易分解。
2.3 植物凋落物存留
纳帕海湖滨带植物凋落物通过1年的分解,3种湖滨带植物均具有较高的生物量存留率(图5),水葱、茭草和刘氏荸荠凋落物年存留率分别为(62.0±8.8)%、(47.5±9.0)%和(44.5±7.9)%,水葱凋落物年存留率显著高于茭草和刘氏荸荠凋落物年存留率(P<0.05)。
基于水葱、茭草和刘氏荸荠3种湖滨带植物地上生物量及其凋落物年分解特征,估算3种湖滨带植物地上生物量年均存留量分别为(453.1±4.9)g·m-2·a-1、(405.4±27.7)g·m-2·a-1和(150.9±14.5)g·m-2·a-1(图5),水葱、茭草凋落物年存留量显著高于刘氏荸荠凋落物年存留量(P<0.05)。
3 讨论
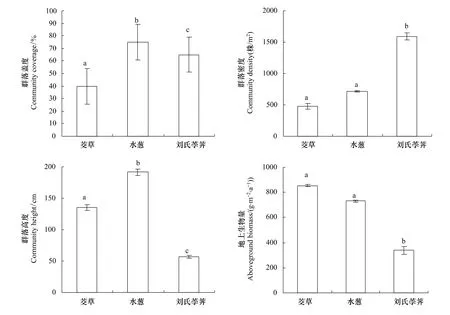
图2 纳帕海3种湖滨带植物群落特征及其地上生物量Fig.2 Characteristics of three lakeshore plants community and their aboveground biomass in Napahai

图3 纳帕海区域月平均温度(2010.10—2011.09)及其湖滨带植物凋落物分解速率Fig.3 Monthly mean temperature in Napahai and lakeshore plants litter decomposition rate(2010.10—2011.09)
植物初级生产力是湿地生态系统物质循环与能量流动的基础,其生长态势直接指示着区域生态系统健康状况[16]。由于环境条件的差异,不同区域、不同湿地植物物种的初级生产力存在差异。本研究中,滇西北高原湿地湖滨带优势植物茭草、水葱和刘氏荸荠均具有较高的地上生物量,其高于我国三江平原沼泽湿地植物年平均生物量(92.2—675)g·m-2·a-1[17-18]。较高的湖滨带植物生物量为该类型湿地生态系统物质的循环与能量补给奠定了物质基础,成为该区域湿地生态系统结构与功能的核心,驱动着整个湿地生态系统的物质循环与能量流动。但不同湖滨带植物生物量间存在差异,也表明不同湖滨带植物对于整个湿地生态系统的物质循环功能的贡献率存在差异,这有待于进一步深入研究。
植物凋落物分解是湿地生态系统植物库与土壤库间生物地球化学循环的重要环节[19],植物凋落物的分解通常与温度有关[20]。滇西北纳帕海湿地3种湖滨带植物的分解速率7月最快(月平均温度13.5℃),这与高温增强微生物活性,加快有机质和凋落物分解以及元素循环的进行有关;随着当年12月—翌年1月月平均温度的降低(平均温度-3.1℃)起,分解作用的主要微生物处于冬眠状态、淋溶作用基本停止,湖滨带植物凋落物的分解速率最慢,这进一步表明植物凋落物分解速率随温度的升高而不断加快[21-22]。另外,有机与无机组成种类与数量,即凋落物本身的质量在凋落物分解过程中起关键性的作用[23]。一般认为,初始C/N较高的凋落物分解得较慢[24-26]。本研究中,3种植物凋落物处于同一水文环境,水体的溶解氧、微生物、温度等外界条件相似,刘氏荸荠凋落物分解速率相对较高,水葱、茭草凋落物分解速率相对较低,这是否与湖滨带植物不同的初始C/N有关,尚需深入研究。

图4 纳帕海3种湖滨带植物凋落物分解速率常数k值Fig.4 The k value of three lakeshore plants litter decomposition rate in Napahai

图5 纳帕海湖滨带3种植物凋落物年存留量(g·m-2·a-1)Fig.5 Aboveground biomass remains per year of three lakeshore plants in Napahai
植物的生长与凋落物分解连接着生物有机体的合成(光合作用)和分解(有机物的分解和营养元素的释放),其间的权衡决定着湿地生态系统物质的积累与释放。纳帕海湿地是青藏高原东南缘横断山系区的高寒湿地生态系统,高寒、冷湿条件致使植物凋落物分解率低。本研究中的3种湖滨带植物年存留率均在年生物量的40%以上,其中,水葱残留率最高,其次为茭草和刘氏荸荠,这就使得大量湖滨带植物生物量将以有机质的形式在土壤中不断积累,成为纳帕海湿地生态系统碳汇功能的基础。近年来,随着纳帕海区域人为活动干扰加剧,湿地水文环境不断丧失,湿地陆地化进程加速,致使该湿地植物群落类型及其空间分布格局发生改变,原有湖滨带植物不断向中生、旱生演替,其分布面积不断萎缩,这必将对纳帕海湿地生态系统碳沉降功能产生影响[27-28]。
滇西北高原湿地拥有极高的生物多样性和特有性,受到国内外广泛关注。但是,随着对湿地碳汇功能认识的不断提高,这一区域湿地生态系统植被生产力和固碳潜力如何?目前尚缺乏足够的重视和深入研究。本文对纳帕海湿地3种湖滨带优势植物生物量和凋落物分解进行了初步研究,其湖滨带植物的高生物量与低分解率进一步证实该类型湿地具有极其重要的“碳汇”功能,其碳汇过程及其贡献需要深入研究。
[1] Wang P,Sheng L X,Yan H,Zhou D W,Song Y T.Plant functional traits influence soil carbon sequestration in wetland ecosystem.Acta Ecologica Sinica,2010,30(24):6990-7000.
[2] Fornara D A,Tilman D.Plant functional composition influences rates of soil carbon and nitrogen accumulation.Journal of Ecology,2008,96(2):314-322.
[3] Chapin F S III,Walker B H,Hobbs R J,Hooper D U,Lawton J H,Sala O E,Tilman D.Biotic control over the functioning of ecosystems.Science,1997,277(5325):500-504.
[4] Hooper D U,Vitousek P M.The effects of plant composition and diversity on ecosystem processes.Science,1997,277(5330):1302-1305.
[5] Tilman D,Knops J,Wedin D,Reich P,Ritchie M,Siemann E.The influence of functional diversity and composition on ecosystem processes.Science,1997,277(5330):1300-1302.
[6] Wardle D A,Bonner K I,Barker G M,Yeates G W,Nicholson K S,Bardgett R D,Watson R N,Ghani A.Plant removals in perennial grassland:Vegetation dynamics,decomposers,soil biodiversity,and ecosystem properties.Ecological Monographs,1999,69(4):535-568.
[7] Wardle D A,Zackrisson O.Effects of species and functional group loss on island ecosystem properties.Nature,2005,435(7043):806-810.
[8] De Deyn G B,Quirk H,Yi Z,Oaklley S,Ostle N J,Bardgett R D.Vegetation composition promotes carbon and nitrogen storage in model grassland communities of contrasting soil fertility.Journal of Ecology,2009,97(5):869-875.
[9] Lang S I,Comelissen J H C,Klahn T,van Logestijn R S P,Schweikert W,Aerts R.An experimental comparison of chemical traits and litter decomposition rates in a diverse range of subarctic bryophyte,lichen and vascular plant species.Journal of Ecology,2009,97(5):886-900.
[10] Cornelissen J H C,Lang S I,Soudzilovskaia N A,During H J.Comparative cryptogam ecology:a review of bryophyte and lichen traits that drive biogeochemistry.Annals of Botany,2007,99(5):987-1001.
[11] Xiao D R,Tian K,Zhang L Q.Relationship between plant diversity and soil fertility in Napahai wetland of Northwestern Yunnan Plateau.Acta Ecologica Sinica,2008,28(7):3116-3124.
[12] Li N Y,Yuan H,Tian K,Peng T.Landscape pattern change and its influence on soil carbon pool in Napahai wetland of Northwestern Yunnan.Acta Ecologica Sinica,2011,31(24):7388-7396.
[13] Southwest Forestry College. Comprehensive Scientific Survey Report of Yunnan Bidahai Nature Reserve. Kunming:Southwest Forestry College,2002.
[14] Xiao D R,Tian K,Yuan H,Yang Y M,LI N Y,Xu S G.The distribution patterns and changes of aquatic plant communities in Napahai Wetland in northwestern Yunnan Plateau,China.Acta Ecologica Sinica,2006,26(11):3624-3630.
[15] Olson J S.Energy storage and the balance of producers and decomposers in ecological systems.Ecology,1963,44(2):322-331.
[16] Wang L,Hu J M,Song C C,Yang T.Influences of water gradients on the aboveground biomass of a typical wetland plant(Calamagrostis angustifolia)in the Sanjiang Plain.Acta Prataculturae Sinica,2008,17(4):19-25.
[17] Guo Z X,Wang Z M,Song K S,Liu D W,Zhang B.Spatial features of productivity variability of marsh in the Sanjiang plain.Wetland Science,2008,6(3):372-378.
[18] Liu X T,Ma X H.The Natural Environment Change and Ecological Conservation in Sanjiang Plain.Beijing:Science Press,2002:59-82.
[19] Zhong H P,Du Z C.The relationship between the climatic factors and the litter decomposition of Trifolium pratense,Dactylis glomerata in mountains of Eastern Sichuan.Grass of China,1997,6:29-32.
[20] Vitousek P M,Turner D R,PartonW J,Sanford R L.Litter decomposition on the Mauna Loa environmental matrix,Hawai'i patterns,mechanisms and models.Ecology,1994,75(2):418-429.
[21] Kalburtji K L,Mamolos AP,Kostopoulou SK.Litter dynamics of Dactylis glomerata and Vicia villosa with respect to climatic and soil characteristics.Grass and Forage Science,1998,53(3):225-232.
[22] Moore T R,Trofymow J A,Taylor B,Prescott C,Camiré C,Duschene L,Fyles J,Kozak L,Kranabetter M,Morrison I,Siltanen M,Smith S,Titus B,Visser S,Wein R,Zoltai S.Litter decomposition rates in Canadian forests.Global Change Biology,1999,5(1):75-82.
[23] Norby R J,Cotrufo M F.A question of litter quality.Nature,1998,396(6706):17-18.
[24] Neckles H A,Neill C.Hydrologic control of litter decomposition in seasonally flooded prairie marshes.Hydrobiologia,1993,286(3):155-165.
[25] Baker T T,Lockaby B G,Conner W H,Meier C E,Stanturf J A,Burke M K.Leaf litter decomposition and nutrient dynamics in four southern forested floodplain communities.Soil Science Society of America Journal,2001,65(4):1334-1347.
[26] Aerts R,van Logtestijn R,van Staalduinen M,Toet S.Nitrogen supply effects on productivity and potential leaf litter decay of Carex species from peatlands differing in nutrient limitation.Oecologia,1995,104(4):447-453.
[27] Yin W Y.A study on the wetland vegetation of the Bitahai Nature Reserve.Southwest Forestry College,2002,22(3):16-19.
[28] Tian K,Lu M,Chang F L,Mo J F,Li L C,Yang Y X.The Ecological environment degradation and degradation mechanism of Napahai wetland in southwestern Yunnan Plateau.Lake Sciences,2004,16(1):35-42.
参考文献:
[1] 王平,盛连喜,燕红,周道玮,宋彦涛.植物功能性状与湿地生态系统土壤碳汇功能.生态学报,2010,30(24):6990-7000.
[11] 肖德荣,田昆,张利权.滇西北高原纳帕海湿地植物多样性与土壤肥力的关系.生态学报,2008,28(7):3116-3124.
[12] 李宁云,袁华,田昆,彭涛.滇西北纳帕海湿地景观格局变化及其对土壤碳库的影响.生态学报,2011,31(24):7388-7396.
[13] 西南林学院.云南碧塔海自然保护区综合科学考察报告.昆明:西南林学院,2002.
[14] 肖德荣,田昆,袁华,杨宇明,李宁云,徐守国.高原湿地纳帕海水生植物群落分布格局及变化.生态学报,2006,26(11):3624-3630.
[16] 王丽,胡金明,宋长春,杨涛.水分梯度对三江平原典型湿地植物小叶章地上生物量的影响.草业学报,2008,17(4):19-25.
[17] 国志兴,王宗明,宋开山,刘殿伟,张柏.三江平原沼泽湿地植被净初级生产力空间变化特征分析.湿地科学,2008,6(3):372-378.
[18] 刘兴土,马学慧.三江平原自然环境变化与生态保育.北京:科学出版社,2002:59-82.
[19] 钟华平,杜占池.川东中高山地区红三叶、鸭茅凋落物分解速率与气候因子之间的定量关系.中国草地,1997,6:29-32.
[27] 尹五元.碧塔海自然保护区湿地植被研究.西南林学院学报,2002,22(3):16-19.
[28] 田昆,陆梅,常凤来,莫剑锋,黎良材,杨永兴.云南纳帕海岩溶湿地生态环境变化及驱动机制.湖泊科学,2004,16(1):35-42.

