胃肠道间质瘤中干细胞因子的表达及与其细胞增殖的关系
侯晓玮,白辰光,马大烈,庄兴俊
胃肠道间质瘤 (gastrointestinal stromal tumor,GIST)为最常见的胃肠道间叶来源肿瘤,其常见的发病部位为胃、小肠、结直肠等。GIST起源于消化道间质的 Cajal细胞(interstitial cell of Cajal,ICC)或其更原始的祖细胞[1],肿瘤中存在c-Kit基因(75%~80%)或PDGFRA基因(5%~10%)的功能获得性突变[2-5],这些突变导致非配体依赖的受体蛋白的持续活化,激活下游信号传导通路,阻止细胞发生凋亡,促进细胞增殖,这被认为是GIST的经典发病机制。研究发现,部分GIST具有恶性行为,能够发生侵袭和转移。目前认为所有的GIST都有恶性潜能。Flether等提出肿瘤大小和有丝分裂指数可以作为GIST危险度评估的指标[6],Ki-67指数也可作为GIST预后评估的指标。但是目前促使GIST细胞增殖和转移的原因却尚未清楚。干细胞因子(stem cell factor,SCF)为 KIT受体蛋白的配体,由 Steel基因编码,由于不同的mRNA剪接方式,表达为分子量为31 kD的膜结合型蛋白 (mSCF)和分子量为18.5 kD的可溶性蛋白(sSCF)两种形式[7]。在正常情况下,SCF与KIT受体结合,诱导KIT蛋白胞外区的构象发生变化,使受体在细胞膜上迁移、聚集,形成二聚体,使胞内酪氨酸残基磷酸化,调控MAPK和PI3-K等多条信号传导通路,最终活化胞质内的转录因子,调控细胞的生长、增殖和分化。研究发现,由可溶性SCF激活的KIT蛋白通过泛素-蛋白酶体通路迅速被降解,而由膜结合型SCF蛋白激活的KIT能够保持稳定和持久的活性[8]。目前已证实SCF/KIT通路的活化在ICCs和造血干细胞的增殖分化过程中发挥重要作用[9],而近期研究发现,在某些肿瘤如宫颈腺鳞癌、恶性黑素瘤、Merkel细胞癌、白血病、转移性前列腺癌和胰腺癌中,SCF/KIT系统的激活参与了肿瘤的增殖与转移[10-16]。在GIST中,SCF是否也通过自分泌或旁分泌方式存在,SCF是否能够发挥活化GIST细胞中KIT蛋白的功能,SCF/KIT信号传导系统的激活是否在GIST细胞的增殖和转移过程中发挥作用,值得研究探讨。
在本研究中,笔者检测了68例GIST组织中SCF的表达,分析SCF表达情况与GIST预后评估表 指标的关系,同时结合c-Kit基因的突变状态分析,探索c-Kit基因的突变与SCF表达有无相关性。
1 资料与方法
1.1 病例资料 收集笔者所在医院2002~2009年经病理诊断确诊的GIST患者共68例。男29例,女39例;年龄23~84岁,平均55岁。肿瘤发生于胃43例(63.2%)、小肠 21例(30.1%)、直肠 2例(2.9%)、未知部位2例(2.9%)。肿瘤直径0.8~22.0 cm,平均5.8 cm。
1.2 免疫组织化学检测 在石蜡组织标本的HE染色切片中光镜下对病变组织进行定位,用蜡块组织取样器,每例取直径4 mm的病变组织,重复3次,制作石蜡组织芯片。使用的抗体分别为兔抗人SCF单克隆抗体 (1∶250)、兔抗人KIT多克隆抗体(1∶150)、兔抗人 Ki-67 单克隆抗体(1∶100)。 免疫组化步骤按Envision法,抗原修复方法均为柠檬酸热修复。免疫组化结果判定方法为:SCF和KIT阳性为胞膜或胞浆呈明显棕黄色显色;Ki-67阳性强度判定是在显微镜400倍视野下,计算5个视野的细胞总数,以肿瘤细胞核明显呈棕黄色者为阳性,阳性细胞数除以肿瘤细胞总数,即为Ki-67抗原标记的细胞增殖指数:设定<5%为-,5%~10%为+,>10%为++。
1.3 组织蛋白抽提与Western-blot检测 切取黄豆大小新鲜组织,将组织匀浆,加入RIPA裂解液400 μl,冰上裂解 30 min,经 12 000 r/min 低温离心15 min后吸取上清,BCA法测定蛋白浓度。蛋白上样量为50 μg/孔,常规SDS-PAGE电泳后将蛋白转印至PVDF膜,含有0.05%Tween20、5%脱脂奶粉的封闭液封闭PVDF膜2 h,一抗兔抗人SCF单克隆抗体(1∶5000)、兔抗人 KIT 多克隆抗体(1∶1000)、内参蛋白 GAPDH(1∶10 000,上海康成生物)各 3 ml,4℃孵育过夜,洗膜,按1∶10 000加入HRP标记的相应二抗37℃孵育2 h,洗膜后加入ECL系统,暗室显影2~3 min后冲洗胶片。
1.4 c-Kit基因突变检测 采用蛋白酶K消化/苯酚-氯仿法抽提组织基因组DNA,以此为模板进行PCR反应扩增c-Kit基因,体系为2 μl模板DNA、25 μl 2×Taq PCR MasterMix(北京天为时代科技有限公司),上下游引物 (10 μmol/l) 各 1 μl,终体积50 μl(引物序列见表 1),反应条件为 94 ℃ 1 min、60℃ 1 min、72℃ 1 min至38个循环。PCR产物经1.5%琼脂糖凝胶电泳鉴定后,送上海生工生物公司测序。
1.5 统计学方法 SPSS13.0统计学软件,采用非参数Mann-Whitney检验和McNemar检验,P<0.05认为有统计学意义。
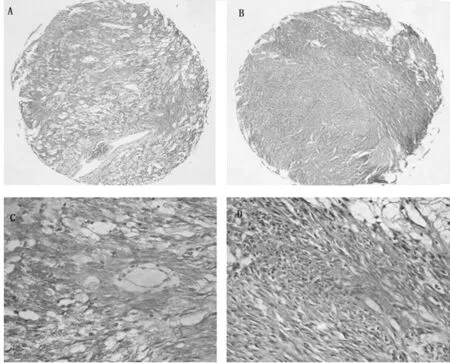
A、C:SCF 在 GIST 中的表达;B、D:KIT 在 GIST 中的表达(×400)图 1 免疫组化检测SCF和KIT在GIST中的表达
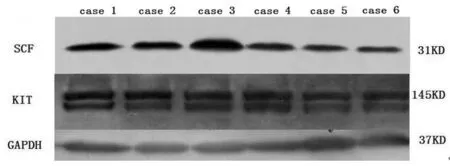
图2 Western-blot检测GIST中SCF和KIT的表达
2 结果
2.1 GIST细胞中SCF及相关蛋白的表达 免疫组化检测68例GIST组织,其中52例组织中SCF表达阳性,表达率为76%,在几乎所有的阳性标本中,SCF表达均位于肿瘤细胞的胞膜和/或胞浆;KIT蛋白在所检标本中均表达。部分肿瘤细胞的胞核可见Ki-67 表达(图 1)。
2.2 Western-blot检测SCF蛋白 为进一步明确SCF蛋白在GIST中的表达形式,在其中的21例新鲜GIST组织中行蛋白印迹检测SCF的表达。结果,其中17例标本SCF表达阳性,在分子量为31 kD处可见明显阳性条带,其表达与免疫组化检测结果相一致;同时在所有检测标本中,分子量为145 kD处均可检测到KIT蛋白的阳性条带(图2)。
2.3 SCF表达与肿瘤增殖相关因素的关系 根据Fletcher提出的GIST危险度分级[6],所检测的标本分为极低危2例、低危21例、中危23例及高危22例。在极低危2例中无SCF表达,而SCF在低危、中危和高危标本中的阳性表达率分别为71%、78%和86%(表2);52例SCF表达阳性标本中,肿瘤平均最大径为6.1 cm,高于不表达SCF的标本组的平均最大径4.9 cm。经Mann-Whitney检验,SCF阳性标本中的每50个高倍视野病理性核分裂数较SCF阴性标本明显增多(表3);表达SCF标本组的Ki-67增殖指数也明显高于SCF阴性标本(表4)。
2.4 c-Kit基因突变分析及其与SCF表达的关系将68例GIST组织的c-Kit基因行PCR扩增后,成功测序54例,有37例c-Kit基因发生突变,其中外显子11突变31例,外显子9突变6例;其余17例组织未发现c-Kit基因突变。结合SCF表达情况,经McNemar检验发现,c-Kit基因的突变与否与SCF表达无明显相关性(表5)。

表 2 SCF在不同危险度分级GIST中的表达

表 3 不同SCF表达的GIST病理性核分裂数

表 4 不同SCF表达的GIST中Ki-67增殖指数

表 5 GIST中SCF表达与c-kit突变的相关性
3 讨论
胃肠道间质瘤为最常见的消化道间叶来源肿瘤,KIT蛋白的表达为GIST最重要的病理特征,c-Kit基因发生功能获得性突变导致KIT蛋白自动磷酸化而激活下游信号传导,是GIST的重要发病机制,但是GIST细胞继续增殖和发生远处转移的机制尚未完全阐明。GIST中因发生自主磷酸化而活化的KIT蛋白为纯和型突变基因所编码蛋白,然而约20%的GIST无c-Kit突变,且c-Kit突变的GIST中94%的病例为杂和型突变[17],而几乎所有GIST中的KIT蛋白均可发生磷酸化[18],这提示GIST中是否存在另外某种机制促使未突变的c-Kit基因编码的蛋白发生活化?
KIT蛋白不仅仅在GIST中表达,已有研究发现,在粒细胞白血病、精原细胞瘤、恶性黑素瘤、小细胞肺癌、乳腺癌、胃癌、结肠癌、宫颈癌和卵巢癌中均有KIT蛋白表达[19-25],在这些肿瘤中,KIT蛋白和其配体SCF的共表达提示KIT/SCF信号通路在肿瘤的增殖过程中发挥作用。最新研究也证实,KIT蛋白的配体SCF通过自/旁分泌促进胰腺癌细胞、恶性黑素瘤细胞、白血病细胞增殖,在前列腺癌骨转移的组织中也发现KIT和SCF高表达[10-16]。因此,在KIT表达率高达95%的GIST中,SCF是否存在并发挥作用,野生型c-Kit基因所编码的KIT蛋白是否是被其配体SCF激活,这种激活作用是否是GIST细胞增殖和转移的机制之一,均有待于研究和解释。
在本研究中通过免疫组织化学和Western-blot检测发现,在GIST中存在着SCF的高表达,其表达率为76%,并且KIT和SCF的共表达率也达到74%。此结果证实SCF蛋白在GIST中确切存在。Bono等在GIST患者的血清中检测到SCF[26],也支持本文结果。可以推论在GIST中存在SCF的自分泌。同样也有研究在正常胃肠道组织中检测到SCF的分泌[27],结合前述结果可以进一步肯定GIST中存在SCF的自/旁分泌。经过蛋白印迹检测发现,GIST中所表达的SCF蛋白为分子量31 kD的膜结合型蛋白,此型蛋白对KIT的激活作用能够达到稳定和持久,可以证明GIST中存在的SCF具备激活KIT活性的生物学功能。
目前研究认为,所有的GIST都具有恶性潜能[6],肿瘤大小、有丝分裂指数和Ki-67都作为评价肿瘤恶性行为的指标而被广泛采用。本研究发现,相比较于不表达SCF的GIST,SCF阳性的肿瘤具有更大的体积,有丝分裂指数也明显增高;在表达SCF及SCF/KIT共表达的GIST中,肿瘤细胞胞核Ki-67染色强度明显增高,具有统计学差异;同样,Fletcher危险度分级较高的患者,也具有高的SCF表达率。以上结果均可以初步证实,SCF的表达与GIST的潜在恶变存在一定关系,SCF活化KIT蛋白可能是促进GIST细胞增殖和转移的主要因素之一。结合c-Kit基因突变状态分析,笔者发现,SCF表达与否与c-Kit突变并无明显相关性,提示在GIST中,无论是否存在突变导致的不依赖配体的KIT蛋白自主磷酸化,SCF都有广泛表达,而SCF的表达就意味着配体依赖的信号通路即SCF/KIT信号传导通路可能被激活,这也从另一方面证明了SCF在不同突变类型的GIST中促进肿瘤增殖和恶性转化的可能性。
综上所述可见,SCF能够通过自/旁分泌途径在GIST中发挥刺激细胞增殖的作用;GIST中可能存在KIT蛋白自动磷酸化之外的另外一条重要细胞增殖信号通路,即依赖配体SCF的KIT活化,c-Kit突变可能是肿瘤发生的早期事件,而SCF/KIT通路是促进肿瘤细胞增殖生长的重要因素。但是,SCF在不同突变类型的GIST中发挥作用有何不同,在对野生型KIT蛋白的激活作用之外,对突变型KIT蛋白的活化有何影响,这些问题仍需进一步深入研究和探讨,研究GIST中SCF/KIT信号通路的功能作用,有望阐明GIST增殖和转移机制提供新的思路和证据。
[1]Kindblom LG,Remotti HE,Aldenborg F,et al.Gastrointestinal pacemaker cell tumor(GIPACT):gastrointestinal stromal tumors show phenotypic characteristics of the interstitial cells of Cajal[J].Am J Pathol,1998,152(5):1259-1269.
[2]Heinrich MC,Corless CL,Demetri GD,et al.Kinase mutations and imatinib response in patients with metastatic gastrointestinal stromal tumor[J].J Clin Oncol,2003,21(23):4342-4349.
[3]Hirota S,Isozaki K,Moriyama Y,et al.Gain-of-function mutations of c-Kit in human gastrointestinal stromal tumors[J].Science,1998,279(5350):577-580.
[4]Rubin BP,Singer S,Tsao C,et al.KIT activation is a ubiquitous feature of gastrointestinal stromal tumors[J].Cancer Res,2001,61(22):8118-8121.
[5]Heinrich MC,Corless CL,Duensing A,et al.PDGFRA activating mutations in gastrointestinal stromal tumors[J].Science,2003,299(5607):708-710.
[6]Fletcher CD,Berman JJ,Corless C,et al.Diagnosis of gastrointestinal stromal tumors:A consensus approach[J].Hum Pathol,2002,33(5):459-465.
[7]Toyota M,Hinoda Y,Itoh F,et al.Expression of two types of Kit ligand mRNAs in human tumor cells[J].Int J Hematol,1992,55(3):301-304.
[8]Miyazawa K,Williams DA,Gotoh A,et al.Membrane-bound stem cell factor induces more persistent tyrosine kinase activation and longer life span of c-Kit gene-encoded protein than its soluble form[J].Blood,1995,85(3):641-649.
[9]Miettinen M,Lasota J.KIT(CD117):a review on expression in normal and neoplastic tissues,and mutations and their clinicopathologic correlation[J].Appl Immunohistochem Mol Morphol,2005,13(3):205-220.
[10]Martinho O,Goncalves A,Moreira MA,et al.KIT activation in uterine cervix adenosquamous carcinomas by KIT/SCF autocrine/paracrine stimulation loops[J].Gynecol Oncol,2008,111(2):350-355.
[11]Hofmann UB,Kauczok-Vetter CS,Houben R,et al.Overexpression of the KIT/SCF in uveal melanoma does not translate into clinical efficacy of imatinib mesylate[J].Clin Cancer Res,2009,15(1):324-239.
[12]Ashida A,Takata M,Murata H,et al.Pathological activation of KIT in metastatic tumors of acral and mucosal melanomas[J].Int J Cancer,2009,124(4):862-868.
[13]Krasagakis K,Kruger-Krasagakis S,Eberle J,et al.Co-expression of KIT receptor and its ligand stem cell factor in Merkel cell carcinoma[J].Dermatology,2009,218(1):37-43.
[14]Toki T,Kanezaki R,Adachi S,et al.The key role of stem cell factor/KIT signaling in the proliferation of blast cells from Down syndrome-related leukemia[J].Leukemia,2009,23(1):95-103.
[15]Wiesner C,Nabha SM,Dos Santos EB,et al.C-Kit and its ligand stem cell factor:potential contribution to prostate cancer bone metastasis[J].Neoplasia,2008,10(9):996-1003.
[16]Yasuda A,Sawai H,Takahashi H,et al.The stem cell factor/c-Kit receptor pathway enhances proliferation and invasion of pancreatic cancer cells[J].Mol Cancer,2006,18(5):46.
[17]Emile JF,Theou N,Tabone S,et al.Clinicopathologic,phenotypic,and genotypic characteristics of gastrointestinal mesenchymal tumors[J].Clin Gastroenterol Hepatol,2004,2(7):597-605.
[18]Antonescu CR,Besmer P,Guo T,et al.Acquired resistance to imatinib in gastrointestinal stromal tumor occurs through secondary gene mutation[J].Clin Cancer Res,2005,11(11):4182-4190.
[19]Cohen PS,Chan JP,Lipkunskaya M,et al.Expression of stem cell factor and c-Kit in human neuroblastoma[J].Blood,1994,84(10):3465-3472.
[20]Hassan S,Kinoshita Y,Kawanami C,et al.Expression of protooncogene c-Kit and its ligand stem cell factor(SCF)in gastric carcinoma cell lines[J].Dig Dis Sci,1998,43(1):8-14.
[21]Hines SJ,Organ C,Kornstein MJ,et al.Coexpression of the c-Kit and stem cell factor genes in breast carcinomas[J].Cell Growth Differ,1995,6(6):769-779.
[22]Inoue M,Kyo S,Fujita M,et al.Coexpression of the c-Kit receptor and the stem cell factor in gynecological tumors[J].Cancer Res,1994,54(11):3049-3053.
[23]Krystal GW,Hines SJ,Organ CP.Autocrine growth of small cell lung cancer mediated by coexpression of c-Kit and stem cell factor[J].Cancer Res,1996,56(2):370-376.
[24]Pietsch T,Kyas U,Steffens U,et al.Effects of human stem cell factor(c-Kit ligand)on proliferation of myeloid leukemia cells:heterogeneity in response and synergy with other hematopoietic growth factors[J].Blood,1992,80(5):1199-1206.
[25]Toyota M,Hinoda Y,Takaoka A,et al.Expression of c-Kit and Kit ligand in human colon carcinoma cells[J].Tumour Biol,1993,14(5):295-302.
[26]Bono P,Krause A,von Mehren M,et al.Serum KIT and KIT ligand levels in patients with gastrointestinal stromal tumors treated with imatinib[J].Blood,2004,103(8):2929-2935.
[27]Théou-Anton N,Tabone S,Brouty-Boyé D,et al.Coexpression of SCF and KIT in gastrointestinal stromal tumours(GISTs)suggests an autocrine/paracrine mechanism[J].Br J Cancer,2006,94(8):1180-1185.

