铁氰化钾/碳用作锂二次电池正极材料
周 飞,赵培正,郑洪河,2
(1.河南师范大学化学化工学院,河南 新乡 453007;2.苏州大学能源学院,江苏 苏州 215006)
锂离子电池使用的正极材料多为能够可逆脱嵌Li+的层状化合物,在Li+的可逆脱嵌过程中,会伴随着电极材料体积的膨胀和收缩,导致结构失效,容量衰减、使用寿命终结[1]。在电化学反应过程中,Li+同时在电解液、SEI 膜和电极材料本体中迁移,在电极材料本体中的迁移是速率限制步骤,也是决定电池倍率性能的主要因素[2]。为了克服这些问题,人们尝试将液体电极用作正极材料制备锂二次电池。
以铁氰化钾[K3Fe(CN)6]为前驱体制备的普鲁士蓝和普鲁士蓝的衍生物,已经用于锂离子电池电极材料中[3];K3Fe(CN)6也可掺杂在导电聚合物膜中,用于电池系统[4]。
本文作者设计制备了以K3Fe(CN)6/C 复合材料为正极的锂二次电池,测试了电池的电化学性能,并对电极的充放电机理进行了探讨。
1 实验
1.1 K3Fe(CN)6/C 复合材料的制备
将K3Fe(CN)6(Aladdin 公司产,≥99.5%)溶于二次水,形成饱和溶液。向20 ml 饱和溶液中滴加5 ml 丙酮(洛阳产,AR)之后,加入炭黑(Timcal 公司产,Super P Li),控制K3Fe(CN)6与炭黑的质量比为7∶3。搅拌12 h 后,用超声波分散30 min。在30~60℃减压蒸馏,除去溶剂后,即得到产物K3Fe(CN)6/C 复合材料。
1.2 扣式电池的装配
按质量比9∶1将制备的K3Fe(CN)6/C 与粘结剂聚偏氟乙烯(Arkema 公司产,电池级)混合,使用N-甲基吡咯烷酮(Aladdin 公司产,AR)调浆,搅拌均匀后,涂覆在20 μm 厚的铝箔(天津产,电池级)上,在100℃下干燥12 h 后,用打孔器制成直径为13 mm 的圆形电极片,并迅速转移到充满高纯氩气的手套箱中。
以金属锂片(天津产,电池级)为负极、Celgard 2400 膜(美国产)为隔膜、1 mol/L LiPF6/EC +DMC +EMC(体积比1∶1∶1,深圳产,电池级)为电解液,装配CR2032 型扣式电池。
1.3 材料的形貌分析
使用JSM-6390LV 扫描电子显微镜(日本产),观察炭黑、K3Fe(CN)6/C 复合材料和电极片的形貌。
1.4 K3Fe(CN)6在电解液中的溶解度测试
将装有0.008 6 g K3Fe(CN)6粉末的100 ml 容量瓶在120℃下真空(真空度为-0.1 MPa)干燥12 h 后,再转移到手套箱中,边搅拌,边向其中滴加电解液,直至固体恰好溶解完全。根据加入的电解液体积,计算溶解度。
1.5 电化学性能测试
使用BT2000 多功能电池测试系统(美国产)进行循环伏安测试,以金属锂为对电极和参比电极,电压2.5~4.0 V,扫描速率为0.1 mV/s。
首先采用普通的三电极体系;为了验证充放电机理,又设计了图1 的实验装置,用Celgard 2400 膜将吸液纸包裹的K3Fe(CN)6粉末(粒径约5 μm)与炭黑电极、金属锂电极隔开,避免固态K3Fe(CN)6与电极直接接触。
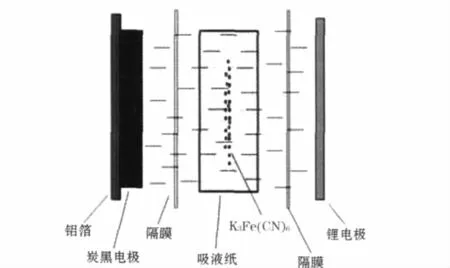
图1 排除K3Fe(CN)6/C 电极固态电化学过程的装置Fig.1 The device which eliminated the solid-phase transformation process of K3Fe(CN)6/C electrode
用CT2001A 电池测试系统(武汉产)进行充放电测试,电压为2.0~4.0 V,温度为35℃。
以0.5 C 进行20 次循环后,以0.5 C 充电至4.0 V,再分别以0.5 C、1.0 C、2.0 C、5.0 C 及10.0 C 放电至2.0 V,对电池的倍率性能进行测试;以2.0 C 充放电,对电极进行循环性能测试。
2 结果与讨论
2.1 表面形貌
炭黑、K3Fe(CN)6/C 复合材料和K3Fe(CN)6/C 电极的SEM 图见图2。

图2 炭黑、K3Fe(CN)6/C 复合材料和K3Fe(CN)6/C 电极的SEM 图Fig.2 SEM photographs of carbon black,K3Fe(CN)6/C composite and K3Fe(CN)6/C electrode
从图2 可知,与炭黑相比,K3Fe(CN)6/C 复合材料的颗粒尺寸较大,原因是K3Fe(CN)6在析出的过程中附着在炭黑颗粒的表面,充当了粘结剂的角色,使颗粒变大;在图2b中并没有发现K3Fe(CN)6固体颗粒的存在;将复合材料制成电极再进行观察,也没有发现K3Fe(CN)6固体颗粒的存在。这说明通过复合处理,K3Fe(CN)6被很好地分散在炭黑中间。
2.2 循环伏安测试
K3Fe(CN)6/C 电极用普通三电极体系的循环伏安测试结果见图3。
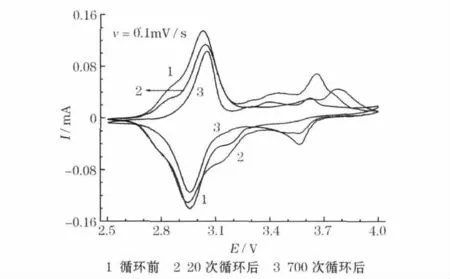
图3 K3Fe(CN)6/C 电极用普通三电极体系的循环伏安曲线Fig.3 CV curves of K3Fe(CN)6/C electrode using normal three-electrode system
从图3 可知,循环伏安曲线上可辨认出两个典型的可逆氧化还原峰,分别位于3.05 V/2.95 V 和3.64 V/3.55 V。在实验中发现,在2.5~4.0 V,电极没有明显的不可逆反应。与没有经历电化学循环相比,20 次循环后,两对氧化还原峰都有所增强,可能是电极的活化造成的;700 次循环后,低电位峰(3.05 V/2.95 V)几乎没有变化,但高电位峰(3.64 V/3.55 V)明显减弱。由此可知,低电位电化学过程具有很好的可逆性,高电位电化学过程的可逆性较差。
2.3 充放电测试
K3Fe(CN)6/C 电极在0.5 C 倍率时的循环充放电曲线见图4。
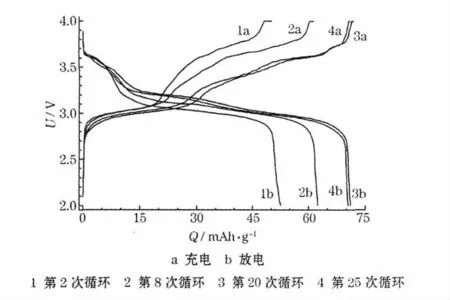
图4 K3Fe(CN)6/C 电极的充放电曲线Fig.4 Charge-discharge curves of K3Fe(CN)6/C electrode
从图4 可知,两个明显的充放电平台与循环伏安曲线的两个典型氧化还原峰能够很好地吻合。在前20 次循环中,充放电容量随着循环次数增加,与循环伏安测试氧化还原峰增强、电极需要活化的结果一致。放电比容量由第2 次循环的52.6 mAh/g 增加到第20 次循环的71.4 mAh/g。在前20次循环中,随着循环的增加,高电位(3.3~4.0 V)充电曲线逐渐被拉长,表明容量的增加主要发生在高电位区域,即活化主要发生在高电位区。
2.4 充放电的机理
两个电压平台和两对氧化还原峰都表明,电极经历了两个电化学过程。
3.05V/2.95 V 对应的可能是液态活性物质参与电化学反应的电化学过程。电极反应可表述为式(1):

放电时,液态Fe(CN)3-6接受由金属锂负极所释放的电子,被还原成Fe(CN)4-6,Fe 的化合价由+3 变为+2。在液态电化学反应的过程中,活性物质以液态的形式存在,几乎不需要活化。由于不存在Li+在晶格中的可逆脱嵌,没有电极体积的变化,不会导致结构失效,这个过程具有很好的可逆性。
3.64V/3.55 V 对应的应该是一个固态电化学过程,即固态K3Fe(CN)6直接参与电化学反应,见式(2):
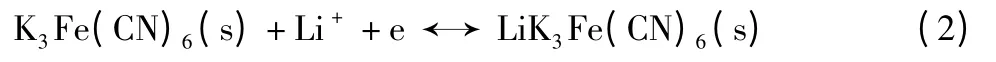
大颗粒K3Fe(CN)6很难直接参与电化学反应,但是被有效地分散在炭黑中的小颗粒,却有直接参与电化学反应的可能。对于固态过程,K3Fe(CN)6颗粒的尺寸、在电极中所处的位置及制备电极的方法等,都会影响这个过程的电化学行为,这就表现在电池前20 次循环中需要活化。
使用图1 的装置进行循环伏安测试,得到的循环伏安曲线见图5。
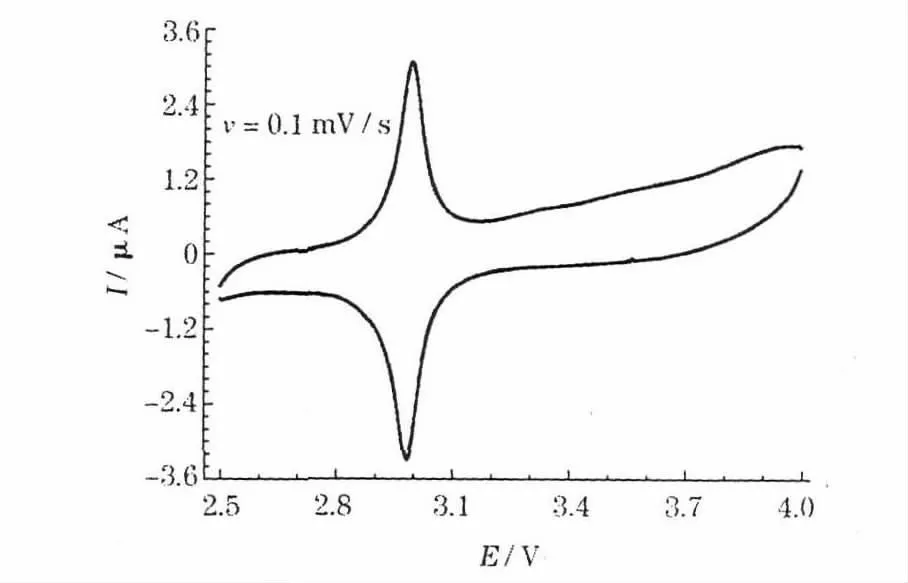
图5 使用图1 装置测得的K3Fe(CN)6/C 电极的循环伏安曲线Fig.5 CV curves of K3Fe(CN)6/C electrode obtained with the device shown in Fig.1
K3Fe(CN)6的粒径(约5 μm)大于隔膜的孔径(0.03~0.12 μm),固态K3Fe(CN)6无法与电极直接接触,就无法透过隔膜从炭黑电极得到电子,也就不会发生固态电化学反应。溶解度测试结果表明,K3Fe(CN)6在电解液中的溶解度为0.100 9 g/L,因此,部分溶解在电解液中的K3Fe(CN)6以溶剂化的Fe(CN)3-6 离子的形式存在,可透过隔膜在炭黑电极上发生电化学反应,图5 中的氧化还原峰对应的只能是液态电化学过程。
图3 中,低电位处的氧化还原峰与图5 中的曲线一致,说明K3Fe(CN)6/C 电极在低电位区经历的是一个液态电化学过程。
2.5 倍率性能测试
K3Fe(CN)6/C 电极的倍率性能测试结果见图6。
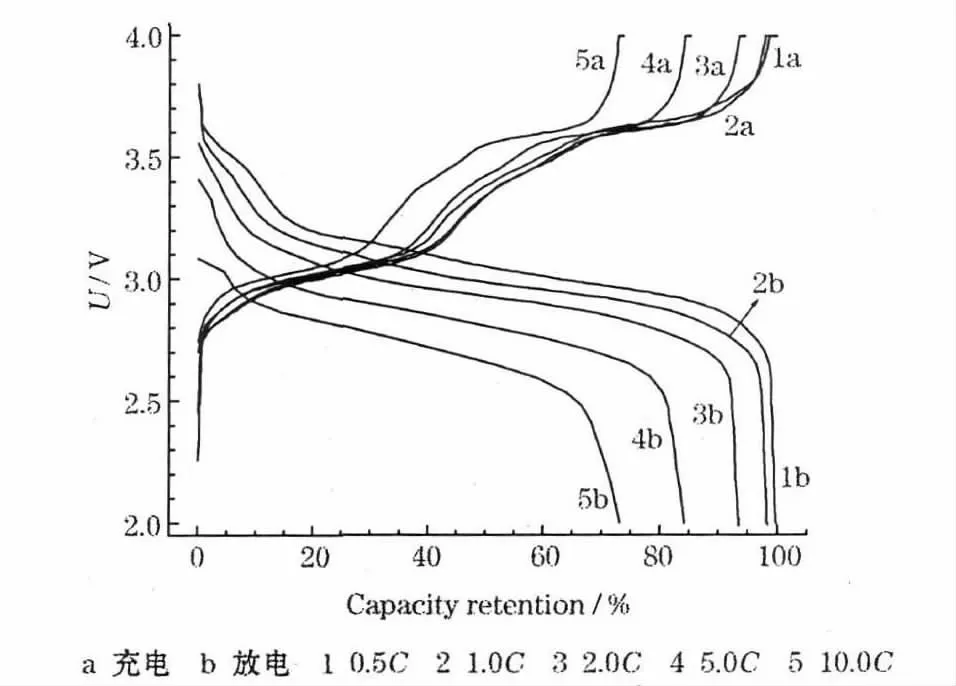
图6 K3Fe(CN)6/C 电极的倍率性能Fig.6 Rate capability of K3Fe(CN)6/C electrode
从图6 可知,以1.0 C、2.0 C、5.0 C 及10.0 C 倍率放电,容量保持率相对于0.5 C 分别为98%、93%、84%和73%。从图6 还可看出,高倍率放电容量的损失主要发生在高电位区,即固态电化学过程。这一测试结果,与推测的充放电机理吻合。
2.6 循环性能测试
K3Fe(CN)6/C 电极的循环性能测试结果见图7。
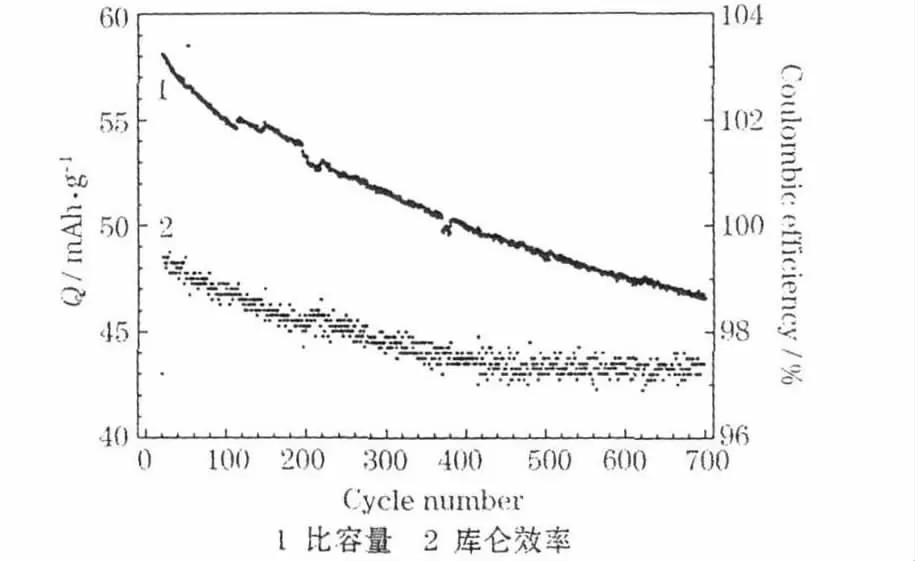
图7 K3Fe(CN)6/C 电极的循环性能Fig.7 Cycle performance of K3Fe(CN)6/C electrode
从图7 可知,循环700 次,电极的容量保持在初始容量的80%以上,库仑效率大于97%。
为了了解液态和固态电化学过程的循环性能,将测试过程中首次、第200、400、600 和700 次循环的充放电曲线进行了对比,如图8 所示。
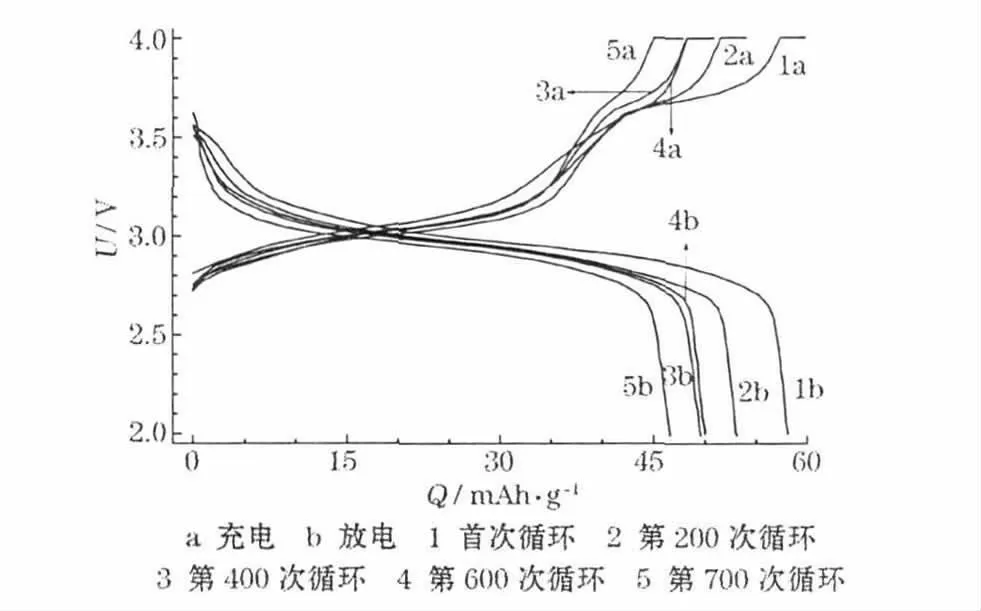
图8 循环测试过程中的充放电曲线Fig.8 Charge-discharge curves in cycle test process
从图8 可知,在不同的循环下,低电位区(2.0~3.3 V)容量随着循环次数的增加变化不大,几乎没有衰减。高电位区(3.3~4.0 V)即固态电化学过程发生的电压区域,情况却截然相反,经历了700 次循环之后,高电位充电平台几乎消失。这些测试结果表明,长循环容量的衰减主要发生在固态过程,液态过程在经历700 次循环后几乎没有发生变化。
对于有液态过程参与的电池系统,如锂硫电池,往往存在飞梭效应[5]。在实验过程中,并未观察到严重的飞梭现象,可能是由于溶剂化的Fe(CN)3-6离子在金属Li 表面反应活性较低,或者是由于在电极表面形成了钝化膜,阻止了飞梭效应的发生。这一推测,还有待进一步的论证。
3 结论
本文作者将K3Fe(CN)6/C 复合材料用作锂二次电池正极,在0.5 C 倍率时具有71.4 mAh/g 的可逆比容量,循环700 次的容量保持率在80%以上。对电极充放电机理的初步探讨表明:电极在3.64 V/3.55 V 经历一个需活化的固相电化学过程;在3.05 V/2.95 V 经历液相电化学过程,即活性物质以液态存在。
[1]Zheng H H,Zhang L,Liu G,et al.Correlationship between electrode mechanics and long-term cycling performance for graphite anode in lithium ion cells[J].J Power Sources,2012,217(1):530-537.
[2]Zheng H H,Li J,Song X Y,et al.A comprehensive understanding of electrode thickness effects on the electrochemical performances of Li-ion battery cathodes[J].Electrochim Acta,2012,71(1):258-265.
[3]Asakura D,Okubo M,Mizuno Y,et al.Fabrication of a cyanidebridged coordination polymer electrode for enhanced electrochemical ion storage ability[J].The Journal of Physical Chemistry C,2012,116(15):8 363-8 369.
[4]Torres-Gómez G,Gómez-Romero P.Conducting organic polymers with electroactive dopants.Synthesis and electrochemical properties of hexacyanoferrate-doped polypyrrole[J].Synth Met,1998,98(2):95-102.
[5]LIU Hui(刘慧),YUE Xin(岳鑫),LIU Jing-dong(刘景东).蒙脱石对介孔炭复合硫正极性能的影响[J].Battery Bimonthly(电池),2012,42(4):186-188.

