饲料中维生素D3添加水平对黄鳝外周免疫相关组织细胞增殖和凋亡的影响
黎德兵 李 超 张龚炜 彭 西 周定刚* 李学伟*
(1.四川农业大学动物科技学院,雅安 625014;2.四川农业大学动物医学院,雅安 625014)
细胞生长与细胞增殖是有机体的生命进程中2个基本且重要的特征。细胞凋亡(apoptosis)也常被称为细胞编程性死亡(programmed cell death,PCD),是一个主动的由基因决定的自动结束生命的过程,其在维持多细胞生物个体发育的正常进行、保持自稳态平衡以及抵御外界各种因素的干扰等方面都起着非常关键的作用[1]。
20世纪初,科学家发现维生素D3通过其活性形式1,25 - 二羟维生素 D3[1,25(OH)2D3]与细胞核维生素D受体(VDR)结合而在机体骨钙代谢方面发挥重要作用。随着研究的深入,在一些与骨钙代谢无关的组织和细胞上也发现了VDR。头肾、脾脏等是鱼类最主要的外周免疫组织器官,它们是免疫细胞发生分化、成熟、定居、增殖以及产生免疫应答的场所。越来越多的研究证实,单核细胞、巨噬细胞以及活化了的T、B淋巴细胞等绝大多数与免疫系统有关的细胞上也有VDR的分布[2],提示这些免疫细胞同样是维生素D3的靶细胞。现已发现上百种直接或间接影响细胞周期、增殖、分化和凋亡的基因含有维生素D受体反应元件(vitamin D responsive element,VDRE),同时已有研究证实,维生素D3对机体细胞的增殖、分化和细胞凋亡也有重要影响,但这些研究对象目前主要限于医学上离体癌细胞培养模型[3]。
近年来,维生素D3的非经典作用引起不少学者的广泛关注,特别是维生素D3及其类似物对免疫调节的影响已逐渐成为免疫营养学的一个研究热点,但有关调节机制尚未阐明。本试验以黄鳝为研究对象,采用流式细胞术[4],研究饲料中添加梯度剂量的维生素D3对黄鳝肝胰脏、脾脏、后肠、头肾等几种主要外周免疫相关组织细胞增殖和凋亡的影响,以期为探讨维生素D3对黄鳝上述组织生长发育和免疫功能的产生影响的机理提供依据。
1 材料与方法
1.1 试验饲料
根据陈玉冰等[5]方法,以鱼粉、豆粕为蛋白质源,α-淀粉、玉米为糖源,鱼油为脂肪源,并补充矿物质和维生素预混料(不含维生素D3)等配制基础饲料,其组成及营养水平见表1。在基础饲料中分别添加 0(对照)、250、500、1 000、2 000、4 000 IU/kg的维生素D3[由拜耳(四川)动物保健有限公司提供],配制成6种试验饲料。主要饲料原料均粉碎过80目筛,混合均匀后,以挤压机制成直径为2 mm的长条饲料,自然晾干备用。
1.2 试验动物及饲养管理
试验用黄鳝采自四川省雅安市雨城区草坝镇野生群体。挑选体质健康、规格基本一致、初始体重为(21.7±2.1)g的个体,随机分为6个组,每组2个重复,每个重复30尾。养殖试验在四川农业大学鱼类生理实验室进行,采用水族箱(100 cm×60 cm×60 cm)内静水养殖,水源为曝气后的自来水,水面高15~20 cm。经过15 d驯养,黄鳝适应水族箱环境并逐步达到能够摄食配合饲料后开始正式试验。试验期间水温(20±3)℃,pH 6.8~7.5,溶氧在5 mg/L以上。每日18:00按鱼体重的2%投饵1次,并根据黄鳝的摄食状况调整饲料的投喂量(以30 min吃完为准)。每天09:00换水1次,换水量约占总体积的1/5,正式试验共进行60 d。
1.3 样品制备
最后1次投饲12 h后,从各组中分别随机取6尾黄鳝剖杀,立即分别取2 g左右的肝胰脏、脾脏、后肠和头肾,并用冰生理盐水(2~8℃)冲洗,再用滤纸拭干,然后准确称量上述组织1 g,参照陈涛等[6]方法制备组织细胞匀浆。具体方法如下:在5 mL冰生理盐水中用小剪刀迅速将组织块剪碎至1~3 mm3大小,即看不到明显的组织块为止;然后加入5 mL的胰蛋白酶-乙二胺四乙酸(EDTA)消化液,37℃恒温水浴30 min,并间断振荡3次;用300目尼龙网过滤,1 000 r/min离心沉淀5 min,再以冰生理盐水冲洗2次,1 000 r/min离心2 min;弃上清液,用注射器将细胞喷入预冷的70%乙醇中固定12 h,500 r/min离心15 min,将固定好的单细胞悬液上清弃之,用冰生理盐水漂洗2次,调整细胞数在1×106个/mL,备用。相关试剂、试剂盒均购自于美国BD Pharmingen公司(以下同)。

表1 基础饲料组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air-dry basis) %
1.4 指标测定
1.4.1 细胞增殖测定
取上述方法制成的组织细胞匀浆,用流式细胞术检测细胞周期。取1 mL组织细胞匀浆加入碘化丙啶染液(5 μL/mL碘化丙啶,0.5%Tritonx-100和RNA酶0.5 mg),室温下染色20 min左右,磷酸盐缓冲液(PBS)离心洗涤1次;加PBS 1 mL重新悬浮细胞,上FACSCalibur流式细胞仪(BD Pharmingen公司,美国)检测,Modifit软件分析后打印出检验结果,计算细胞增殖指数(proliferating index,PI)。

式中:G0/G1表示静止期的细胞百分比;S表示增殖期的细胞百分比;G2+M表示分裂期的细胞百分比。
1.4.2 细胞凋亡测定
取上述方法制成的组织细胞匀浆,用流式细胞术检测细胞凋亡。取100 μL组织细胞匀浆于流式管中,加入5 μL膜联蛋白Ⅴ-异硫氰酸荧光素(annexinⅤ-FITC)和5 μL 碘化丙啶,轻微振荡混匀,室温避光静置15 min;加入400 μL PBS缓冲液,混匀,FACSCalibur流式细胞仪检测,CellQuest软件分析后,计算细胞凋亡指数(apoptotic index,AI)。在流式细胞仪的散点图上,左上象限显示机械损伤细胞;左下象限显示活细胞;右上象限显示非活细胞,即坏死细胞和晚期凋亡细胞;右下象限显示早期凋亡细胞。

1.5 数据统计与分析
试验数据采用平均值±标准误表示,采用SPSS 18.0软件进行单因素方差分析(one-way ANOVA),以P<0.05为差异显著。
2 结果
2.1 饲料中维生素D3添加水平对黄鳝肝胰脏细胞增殖和凋亡的影响
由表2可知,随维生素D3添加水平的升高,处于静止期(G0/G1期)的细胞百分比逐渐增多,而处于分裂期(G2+M期)和增殖期(S期)的细胞百分比逐渐减小。PI以4 000 IU/kg组最低,显著低于对照组(P<0.05),同时 500、1 000和2 000 IU/kg组亦显著低于对照组(P<0.05)。而AI以4 000 IU/kg组最高,显著高于其他各组(P <0.05),同时500、1 000和 2 000 IU/kg组显著低于对照组(P<0.05)。由肝胰脏细胞凋亡散点图(图1)可见,4 000 IU/kg组凋亡细胞数量明显多于其他组。

表2 饲料中维生素D3添加水平对黄鳝肝胰脏细胞增殖和凋亡的影响Table 2 Effects of vitamin D3supplemental level on cell proliferation and apoptosis of hepatopancreas in Monopterus albus(n=6)
2.2 饲料中维生素D3添加水平对黄鳝脾脏细胞增殖和凋亡的影响
由表3可知,随维生素D3添加水平的升高,处于静止期的细胞百分比先减小后增多,而处于分裂期和增殖期的细胞百分比则先增多后减小。与对照组相比,1 000 IU/kg组PI显著升高(P<0.05),250、4 000 IU/kg组 PI显著降低(P <0.05)。AI则随维生素D3添加水平的升高呈先下降后上升趋势,各维生素D3添加组均显著低于对照组(P<0.05),以1 000 IU/kg组AI最低,并显著低于其他各组(P<0.05)。由脾脏细胞凋亡散点图(图2)可见,与对照组相比,1 000 IU/kg组凋亡细胞数量明显减少。

图1 肝胰脏细胞凋亡散点图Fig.1 Scattergram of cell apoptosis in hepatopancreas
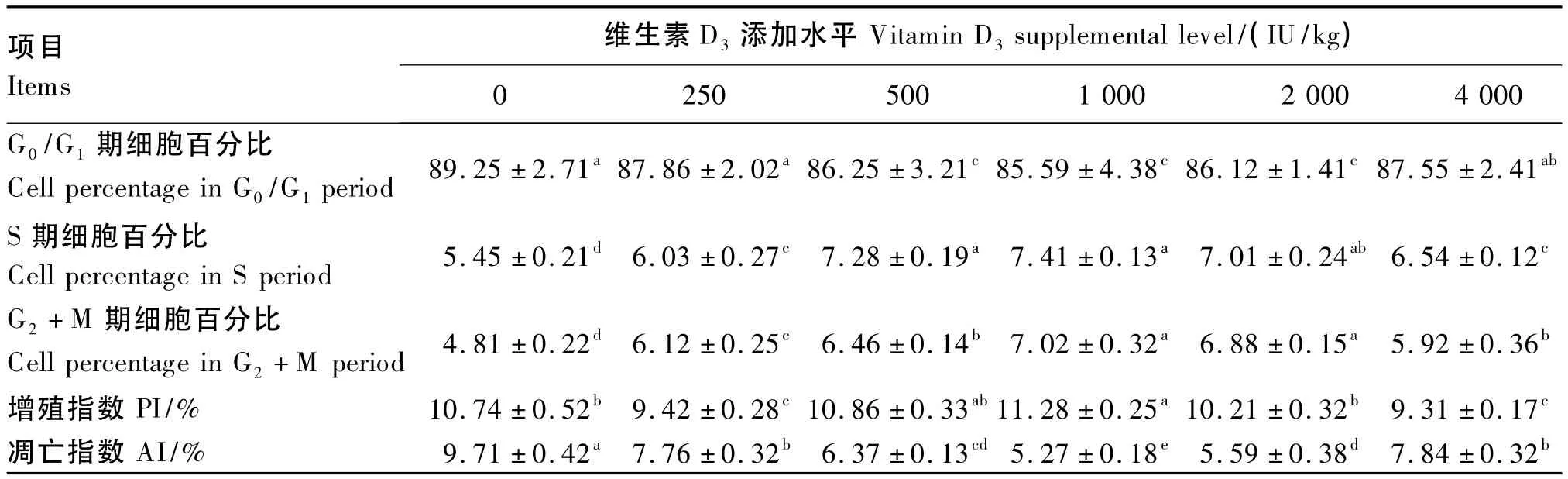
表3 饲料中维生素D3添加水平对黄鳝脾脏细胞增殖和凋亡的影响Table 3 Effects of vitamin D3supplemental level on cell proliferation and apoptosis of spleen in Monopterus albus(n=6)
2.3 饲料中维生素D3添加水平对黄鳝后肠细胞增殖和凋亡的影响
由表4可知,随维生素D3添加水平的升高,处于静止期的细胞百分比先减小后增多,而处于分裂期和增殖期的细胞百分比则呈无规律变化。PI随维生素D3添加水平的升高呈先上升后下降趋势,500~1 000 IU/kg组显著高于其他各组(P<0.05),而4 000 IU/kg组显著低于对照组(P<0.05)。AI随维生素D3添加水平的升高呈先下降后上升趋势,1 000 IU/kg组最低,4 000 IU/kg组最高,并均与其他组存在显著差异(P<0.05)。由后肠细胞凋亡散点图(图3)可见,1 000 IU/kg组凋亡细胞数量明显少于其他组。
2.4 饲料中维生素D3添加水平对黄鳝头肾细胞增殖和凋亡的影响
由表5可知,随维生素D3添加水平的升高,静止期细胞百分比先减小后增多,而分裂期细胞百分比则先增多后减小,增殖期细胞处于持续升高状态,致PI先升高后降低,除4 000 IU/kg组外的各维生素D3添加组均显著高于对照组(P<0.05),并以1 000 IU/kg组PI为最高。AI变化趋势与前3种组织基本一致,以1 000 IU/kg组最低,显著低于其他各组(P<0.05)。由头肾细胞凋亡散点图(图4)可知,与对照组相比,1 000 IU/kg组凋亡细胞数明显减少。

图2 脾脏细胞凋亡散点图Fig.2 Scattergram of cell apoptosis in spleen

表4 饲料中维生素D3添加水平对黄鳝后肠细胞增殖和凋亡的影响Table 4 Effects of vitamin D3supplemental level on cell proliferation and apoptosis of hindgut in Monopterus albus(n=6) %
3 讨论
流式细胞术是检测细胞增殖和凋亡的主要手段之一,具有速度快、精度高、准确性好等优点,成为当代最先进的细胞定量分析技术。无论细胞凋亡过程还是细胞增殖各时相均伴随着细胞内DNA的变化,细胞固定后用碘化丙啶染色,因碘化丙啶特异性结合于细胞DNA,荧光强度直接与碘化丙啶结合量呈良好线性关系,可反映细胞内DNA含量的多少。因碘化丙啶不能通过细胞膜完整的细胞(如活细胞和早期凋亡细胞),在标本制备时,本试验采用了浓度为70%的预冷乙醇固定,增强了细胞膜的通透性,能使碘化丙啶进入细胞内与细胞内的核酸结合。
脾脏和头肾组织富含T、B淋巴细胞,是鱼类重要的免疫器官;后肠黏膜层有淋巴组织和杯状细胞等免疫相关细胞分布,因而被认为是鱼类黏膜免疫系统重要组成部分。近年来,越来越多的研究证实了肝脏也是一个免疫器官,它含有丰富的细胞成分,如窦内皮细胞、星状细胞、树突状细胞、枯否氏细胞以及淋巴细胞,这些细胞分泌一系列的细胞因子,对机体的免疫调节起重要作用[7]。

图3 后肠细胞凋亡散点图Fig.3 Scattergram of cell apoptosis in hindgut

表5 饲料中维生素D3添加水平对黄鳝头肾细胞增殖和凋亡的影响Table 5 Effects of vitamin D3supplemental level on cell proliferation and apoptosis of head kidney in Monopterus albus(n=6)
前髓细胞中VDR的发现,促使维生素D对细胞增殖和分化的研究不断展开。Yang等[8]观察了1,25(OH)2D3及其类似物对正常小鼠免疫反应的影响,发现维生素D缺乏和过量都会使小鼠胸腺淋巴细胞增殖受到抑制,数量减少,且二硝基氟苯(DNFB)刺激指数降低,抑制T细胞调节免疫。医学上利用离体癌细胞培养模型进行的研究大多表明体内活性维生素抑制细胞增殖、诱导细胞分化和凋亡作用,据此,医学上已探讨将活性维生素D3用于治疗肿瘤问题,并取得一定成果[9-11]。曹荣等[12]研究证实,在饲料中添加维生素D3能极显著提高T细胞亚群和白细胞的数量,增强围产期奶牛免疫功能;张淑云等[13]报道,提高饲料维生素D3水平显著增高了生长肉鸡胸腺和脾脏等淋巴器官指数。以上结果提示,维生素D3可通过调控细胞增殖和凋亡,影响淋巴器官生长,继而影响机体免疫功能。
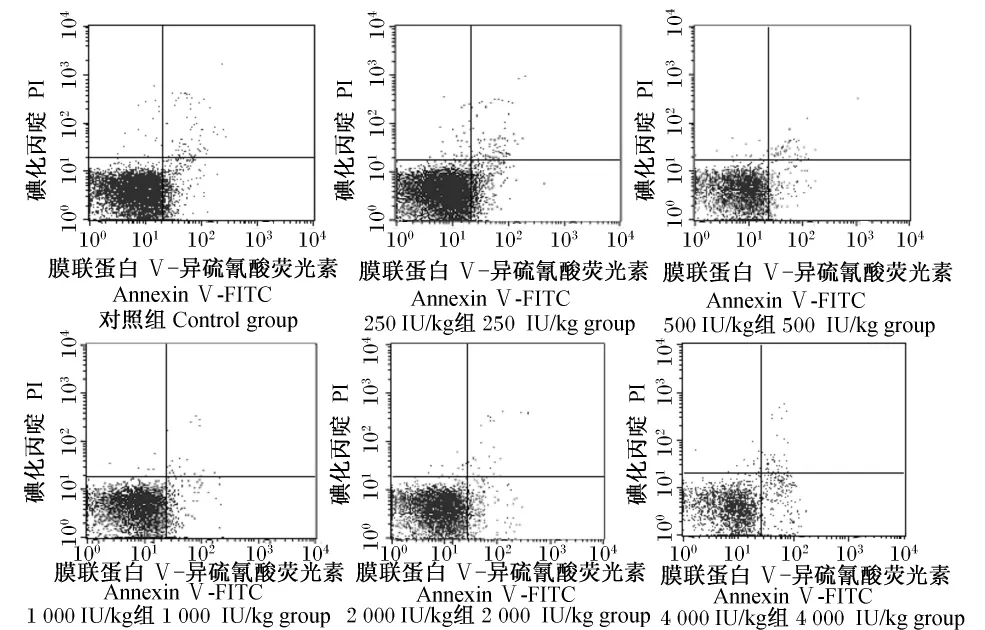
图4 头肾细胞凋亡散点图Fig.4 Scattergram of cell apoptosis in head kidney
本试验结果表明,饲料中维生素D3添加水平可显著影响黄鳝外周免疫相关组织细胞增殖和凋亡过程。具体对各器官的影响表现在:维生素D3对脾脏、后肠和头肾3种组织细胞增殖和凋亡的影响变化趋势基本一致,即适宜维生素D3水平(1 000 IU/kg)促进细胞增殖,减少细胞凋亡,有利于3种组织的生长和发育;维生素D3缺乏和过高都会表现出细胞增殖受阻,导致细胞凋亡发生率增高。从表2可见,维生素D3对肝胰脏细胞增殖起抑制作用,G2+M期和S期细胞百分比减小,G0/G1期细胞百分比增多,细胞被阻滞于G0/G1期,而且这种抑制呈剂量效应,添加水平越高抑制作用越强;而对细胞凋亡而言,4 000 IU/kg的维生素D3诱导细胞凋亡,500~2 000 IU/kg的维生素D3有对抗细胞凋亡的作用。维生素D3对上述器官调节效应的差异,可能与器官组织细胞构成以及VDR基因多态性有关[14],这种差异也体现了维生素D3调节功能的多效性。目前研究认为,维生素D3对细胞增殖的影响是通过与VDR结合,直接增强或抑制调控细胞生长的关键基因的转录因子表达,以及导致增殖素与增殖素依赖性激酶复合物活性的下调[15],或通过与其他重要的转录调节蛋白或细胞信号系统相互作用间接影响来实现的。维生素D也能通过调控促凋亡蛋白Bax、Bak和/或抗凋亡蛋白 Bcl-2、Bcl-xL 的平衡诱导细胞凋亡[16]。
4 结论
①饲料中添加1 000 IU/kg维生素D3可降低黄鳝外周免疫相关组织细胞凋亡,促进肝胰脏、脾脏、头肾和后肠细胞增殖,利于外周淋巴器官生长。
②饲料中添加4 000 IU/kg可致黄鳝外周免疫相关组织细胞增殖受阻,细胞凋亡加快,引起机体免疫功能抑制。
[1]欧阳五庆.动物生理学[M].北京:科学出版社,2006.
[2]SAMUEL S,SITRIN M D.Vitamin D’s role in cell proliferation and differentiation[J].Nutrition Reviews,2008,66:S116 - S124.
[3]NEMERE I,FARACH-CARSON M C.Membrane receptors for steroid hormones:a case for specific cell surface binding sites for vitamin D metabolites and estrogens[J].Biochemical and Biophysical Research Communications,1998,248(3):443 -449.
[4]王文娟,蔡春芳,叶元土,等.鲫鱼淋巴细胞转化PHA刺激剂量及流式细胞仪检测参数探讨[J].上海海洋大学学报,2010,19(2):25-29.
[5]陈玉冰,曹永红,夏轮志,等.饲粮不同蛋白质原料和水平对黄鳝生长性能与肉质的影响[J].饲料工业,2009,30(6):21 -24.
[6]陈涛,龚涛,柏才敏,等.高氟对雏鸡法氏囊形态结构、细胞周期和凋亡影响的研究[J].畜牧兽医学报,2009,40(8):1235 -1243.
[7]邢同京.肝脏免疫学[M].北京:科技文献出版社,2010.
[8]YANG S L,SMITH C,PRAHL J M,et al.Vitamin D deficiency suppresses cell-mediated immunity in vivo[J].Archives of Biochemistry and Biophysics,1993,303(1):98-106.
[9]GRANT W B,GARLAND C F,GORHAM E D.An estimate of cancer mortality rate reductions in europe and the us with 1,000 IU of oral vitamin D per day[J].Recent Results in Cancer Research,2007,174:225-234.
[10]DEEB K K,TRUMP D L,JOHNSON C S.Vitamin D signalling pathways in cancer:potential for anticancer therapeutics[J].Nature Reviews Cancer,2007,7:684-700.
[11]PEREZ-LOPEZA F R,MARC B,EREL C T.EMAS position statement:vitamin D and postmenopausal health[J].Maturitas,2012,71:73 - 78.
[12]曹荣,王加启,卜登攀,等.日粮添加维生素D3对围产奶牛外周血免疫球蛋白及T细胞亚群的影响[J].动物营养学报,2007,19(6):748 -752.
[13]张淑云,王安.钙和维生素D对生长肉鸡免疫及抗氧化功能的影响[J].动物营养学报,2010,22(3):579-585.
[14]WANG J H,TANG K,HOU Q Q,et al.Theoretical studies on the structural rearrangement of ligand binding pocket in human vitamin D receptor[J].International Journal ofQuantum Chemistry,2011,111(14):3928-3937.
[15]GEDLICKA C,HAGER G,WEISSENBOCK M,et al.1,25(OH)2vitamin D3induces elevated expression of the cell cycle inhibitor p18 in a squamous cell carcinoma cell line of the head and neck[J].Journal of Oral Pathology & Medicine,2006,35(8):472 -478.
[16]FUKUYA Y,HIGAKI M,HIGAKI Y,et al.Effect of vitamin D3on the increased expression of Bcl-xL in psoriasis[J].Archives of Dermatological Research,2002,293(12):620 -625.
