基于纳米技术的芯片电泳快速检测脂蛋白及其亚型的研究
汪 骅,韩崇旭,王惠民,金庆辉,王大新,曹 丽,董兰梅
(1.苏北人民医院临床医学检测中心,江苏 扬州 225001;2.南通大学附属医院检验医学中心,江苏 南通 226001;3.中国科学院上海微系统与信息技术研究所,上海 205001)
纳米技术作为20世纪80年代末诞生的新技术,被公认为目前科学研究和应用的前沿和热点领域。纳米技术开辟了分离科学的一个全新领域,有不少研究成果在《Science》[1-3]和《Nature》[4]等杂志上发表,该项技术得到广泛的关注。芯片电泳是在玻璃、石英、硅、塑料等基片的微细通道或色谱柱中,以电场为驱动力,借助于离子或分子在电迁移或分配行为上的差异,对复杂试样中的多种组分进行高速分离分析的技术,使传统毛细管电泳分离物质的整个过程可以在一块几平方厘米的基片上得以实现。研究表明,与在气相色谱和液相色谱中的应用相比,纳米技术显示出更适合在芯片电泳中发挥作用[5],其相关研究非常活跃,应用形式灵活多样,选择性和分离效率改善明显,毛细管电泳和芯片电泳生物分离在此技术推动下进入了一个新的时代。
我们曾利用自制的微芯片结合激光诱导荧光检测系统快速分离了血清脂蛋白[6],但脂蛋白各组分间不能有效分离。在前期研究基础上,我们在芯片电泳缓冲液中加入纳米金颗粒作为添加剂,脂蛋白的分辨率显著提高,在3 min内实现了高密度脂蛋白(HDL)、大而轻低密度脂蛋白(lLDL,即A型LDL)、小而密低密度脂蛋白(sdLDL,即B型LDL)以及极低密度脂蛋白(VLDL)的高效分离。通过对健康人和CHD患者血清脂蛋白分析,探讨基于纳米技术的芯片电泳的临床应用价值。
材料和方法
一、芯片及仪器
石英芯片由石英玻璃(DuPont公司)经光刻、湿法腐蚀、低温键合而成[7],见图1。芯片分离通道总长76.9 mm(有效长度45 mm),进样通道总长28 mm,通道顶宽100 μm,深 25 μm;激光诱导荧光(LIF)分析仪[8]自行研制;OptimaTM L-90K型超速离心机(美国贝克曼公司);CX系统电源(0~5000 V)(中科院上海应用物理研究所)。
二、标准品及缓冲液
HDL、低密度脂蛋白(LDL)、VLDL标准品及纳米金(5、10、20 nm,CASno.7440-57-5)、Tricine、十二烷基硫酸钠(SDS)、乙二醇、甲醇、甲基葡胺均购自美国Sigma公司。硝基苯并噁二唑-C6-酰基鞘氨醇(NBD C6-ceramide)购自美国Molecular Probes公司。超速离心制备lLDL(密度为1.020~1.044 kg/L)、sdLDL(密度为1.044 ~1.063 kg/L)[6]。40 mmol/L Tricine 缓冲液(pH 值 9.8),含40 mmol/L甲基葡胺、0.02 mmol/L十二烷基硫酸钠、20 nmol/L纳米金(5 nm)。所有试剂均为分析纯,配制试剂用水为二次蒸馏水。

图1 微流控芯片
三、临床资料
CHD患者35例,其中男20例、女15例,年龄56~78岁,均经冠状动脉造影证实有冠状动脉病变。正常对照组30名,男15名,女15名,年龄33~70岁,均排除心脑血管疾病。
四、血清样本的采集及预处理
2 μL 血清加入 4 μL 缓冲液,再加入 2 μL 0.1 g/L NBD C6-ceramide(乙二醇∶甲醇 =9∶1 的混合液预先溶解)进行避光预染,1 min后加入25 μL缓冲液,此为电泳待测样本。
五、芯片电泳过程
将4 μL检测样本加入试样池,5 μL缓冲液分别加入试样废液池、缓冲液池、缓冲液废液池,各电泳池插入电极。试样池加+750 V电压,试样废液池接地,缓冲液池加+200 V,缓冲液废液池加+300V,进样40 s后同时切换电压进入分离阶段。分离阶段缓冲液废液池加0 V,缓冲液池加+3100 V,试样池和试样废液池均施加+300 V,运行温度25℃。分离电场强度为403 V/cm。
六、统计学方法
统计方法采用Student's t-test检验,数据处理采用SPSS11.5软件。P<0.05表示差异有统计学意义。
结 果
一、纳米金对脂蛋白分离的影响
芯片电泳分离混合的HDL标准品、VLDL标准品、lLDL和sdLDL,电泳图谱见图2。缓冲液中的纳米金颗粒为5 nm时,脂蛋白各组分完全分离,当纳米金颗粒>5 nm时,脂蛋白分辨率降低,分离效率下降。图3为缓冲液中不同浓度的纳米金对脂蛋白分离度的影响。当纳米金浓度为20 nmol/L时,脂蛋白各组分之间实现基线分离。
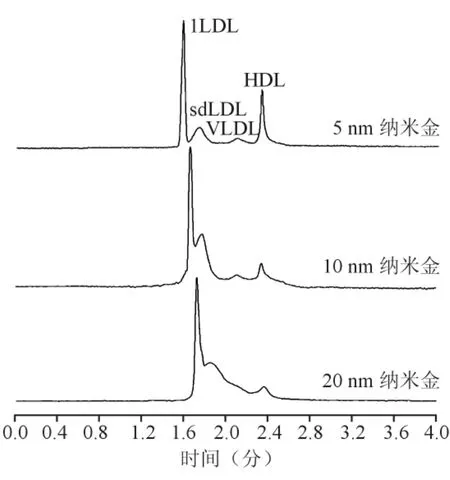
图2 不同大小的纳米金颗粒对脂蛋白分离的影响
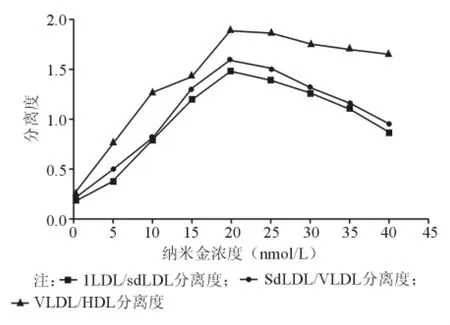
图3 缓冲液中不同浓度纳米金对脂蛋白分离度的影响
二、芯片电泳与琼脂糖凝胶电泳分离血清脂蛋白的对比
芯片电泳与琼脂糖凝胶电泳分离同一健康体检者血清脂蛋白,结果见图4。图4(a)为脂蛋白琼脂糖电泳图谱,健康体检者血清脂蛋白可分出3条区带,分别为HDL、VLDL及LDL。图4(b)为脂蛋白芯片电泳图谱,电泳分离出4条特征峰,分别为lLDL、sdLDL、VLDL及HDL。相对于芯片电泳,琼脂糖凝胶电泳分析时间长,分辨率不高,不能区分lLDL与sdLDL,而且LDL区带容易拖尾。
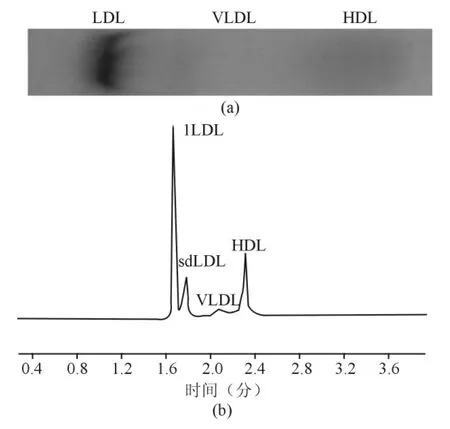
图4 芯片电泳与琼脂糖凝胶电泳分离血清脂蛋白的对比
三、线性范围、检测限和重现性
在优化的分离条件下,lLDL、sdLDL、VLDL和HDL芯片电泳的线性范围[信噪比(S/N)=3]分别为0.01 ~0.8、0.04 ~ 1.0、0.04 ~1.0、0.02 ~0.8 mg/L;检出限分别为 5、5、15 和 8 μg/L。对健康体检者的血清样本连续测定5次,lLDL、sdLDL、VLDL和 HDL的峰面积相对标准偏差(RSD)分别为 3.5%、2.2%、4.5%、3.9%。
四、临床样本测定
对临床确诊的35例CHD患者和30名健康体检者血清进行芯片电泳分析。CHD组与健康对照组比较,sdLDL与 VLDL峰面积显著增加(P <0.01),HDL 峰面积显著下降(P <0.001)。见图5。

图5 CHD组与正常对照组脂蛋白峰面积比较
讨 论
纳米材料可直接作为缓冲液添加剂使用。由于其具有比表面积大的突出特点,经有机改性后的纳米材料添加到溶液中,有更多与样本作用的位点,从而担当了有机官能团与样本分子相互作用的平台,不仅使样本的迁移速度发生变化,并且改变了电渗流,提高了分离选择性。Neiman等[9]分别制备了使用柠檬酸和巯基丙酸离子稳定的2种金纳米材料,添加到电解质溶液中,调整了芳香酸和芳香碱同分异构体的分离选择性,并且提高了柱效。本研究在缓冲液中加入纳米金提高脂蛋白分离效率及选择性。迄今为止,琼脂糖凝胶电泳是分离脂蛋白的常用实验技术,但耗时且分辨率低,不能分离出脂蛋白亚型。基于纳米技术的芯片电泳快速、高效分离了血清脂蛋白及其亚型,结果稳定,可望成为替代凝胶类型分离脂蛋白的全新方法。
血脂分析对于临床高脂血症的诊断及动脉粥样硬化性心血管病的危险评估和防治具有重要意义,并已经渗透应用于其他诸多临床相关专业疾病的研究。近年国外研究特别重视LDL亚组分分析,将高sdLDL、高TG及低HDL-C血症同时存在称为血脂“异常三联症”。芯片电泳分离经密度梯度超速离心制备的LDL,LDL峰高与峰面积随LDL浓度的增大而增加,显示2种方法存在一定的相关性[10]。本研究通过进一步条件优化,芯片电泳检测血清脂蛋白的结果显示,CHD组sdLDL、VLDL水平增高,HDL水平降低,与对照组比较差异均有统计学意义(P <0.01,P <0.001),与 Rizzo等[11]报道高 sdLDL、高 TG、低 HDL-C 为“动脉粥样硬化脂蛋白谱”一致。基于纳米技术的芯片电泳可快速、简便地测定脂蛋白及其亚型,对评价CHD的危险因素,实现对CHD的早期检测、预防及有效制定CHD防治策略具有重大意义。
[1]Han J,Craighead HG.Separation of long DNA molecules in a microfabricated entropic trap array[J].Science,2000,288(5468):1026-1029.
[2]Van Oudenaarden A,Boxer SG.Brownian ratchets:molecular separations in lipid bilayers supported on patterned arrays[J].Science,1999,285(5430):1046-1048.
[3]Huang LR,Cox EC,Austin RH,et al.Continuous particle separation through deterministic lateral displacement[J].Science,2004,304(5673):987-990.
[4]MacDonald MP,Spalding GC,Dholakia K.Micro fluidic sorting in an optical lattice[J].Nature,2003,426(6965):421-424.
[5]He L,Toh CS.Recent advances in analytical chemistrya material approach[J].Anal Chim Acta,2006,556(1):1-15.
[6]Wang H,Wang HM,Jin QH,et al.Microchip-based small,dense low-density lipoproteins assay for coronary heart disease risk assessment[J].Electrophoresis,2008,29(9):1932-1941.
[7]Zhuang G,Jin Q,Liu J,et al.A low temperature bonding of quartz microfluidic chip for serum lipoproteins analysis[J].Biomed Microdevices,2006,8(3):255-261.
[8]Chen JF,Jin QH,Zhao JL,et al.A signal process method for DNA segments separation in microchannel electrophoresis[J].Biosens Bioelectron,2002,17(6-7):619-623.
[9]Neiman B,Grushka E,Lev O.Use of gold nanoparticles to enhance capillary electrophoresis[J].Anal Chem,2001,73(21):5220-5227.
[10]汪 骅,王惠民,金庆辉,等.微流控芯片电泳分离血清中小而密低密度脂蛋白的研究[J].分析化学,2008,37(11):1531-1534.
[11]Rizzo M,Berneis K.Low-density lipoprotein size and cardiovascular risk assessment[J].QJM,2006,99(1):1-14.