全自动血细胞处理仪的研制
张长虹 吴 涛* 周 俊 姜瑞民
冰冻稀有血型红细胞可及时解决稀有血型患者的急诊输血[1-4]。由于冰冻红细胞具有保存期长、可大量贮存及解冻去甘油后质量可靠等优点,因而对公共突发事件及军队战时紧急大量用血具有重要意义[5-6]。
目前,机器制备冰冻红细胞主要采用进口115型和215型血流处理仪。215型血流处理仪是一种全自动多功能的密闭系统,拥有振荡混合平台及连续流动洗涤系统,可用于红细胞的甘油化及去甘油化[7-8]。去甘油洗涤仅需30~40 min(人工操作则需数小时)。215型血流处理仪实现了全封闭洗涤,管路与血袋连接通过无菌接驳机接驳完成,甘油化管路串联了无菌滤器,对环境要求较低,减少消毒剂对工作场地污染,操作简便,制备产品细菌培养试验阴性,为以后去甘油化冰冻红细胞终产品添加保存剂、仿照普通红细胞4℃较长期保存的研究奠定了基础[9]。其缺点为该设备需技术熟练人员进行操作,成本较高,机器价格及耗材昂贵难以推广[10]。因此,本研究对全自动血细胞处理仪进行研制和临床验证。
1 全自动血细胞处理仪的原理与设计思路
1.1 制备冰冻红细胞原理
长期保存红细胞则需要降低红细胞的代谢速度,其取决于保存温度。如果将血液保存在很低的温度下可降低或完全停止红细胞的代谢活动,从而避免代谢毒性产物的积累,达到红细胞延长保存期的目的[11]。血液在0 ℃以下时红细胞周围会形成冰晶,易刺破红细胞膜或损伤红细胞内部结构而引起溶血。保持红细胞在低温下长期保存而不受破坏的关键是冰冻保存红细胞,常用的方法是添加保护液防止红细胞内冰晶的形成,而甘油则是最常用的保护液。在制备冰冻红细胞过程中加入甘油保护剂是关键一步[12-14]。
1.2 解冻洗涤红细胞原理
由于甘油的渗透压较高,进入人体内会造成细胞溶血。因此,在使用解冻红细胞前必须对其进行清洗去除。目前通用的方法是在解冻后的红细胞中分阶段加入不同浓度的盐水,利用细胞内外渗透压的不同来置换出细胞内部甘油,在置换过程中细胞内的甘油浓度越来越低,而水分子含量越来越高,细胞内外渗透压差逐渐变小呈现降渗过程,直至细胞内外呈等渗状态后置换过程停止,清洗过程结束。目前实用的洗涤方法均属于降渗洗涤方式[15-16]。
血细胞处理仪的基本工作流程为:红细胞甘油化→冻融红细胞去甘油化→洗涤红细胞(如图1、图2、图3所示)。
2 设备基本结构及各项参数指标的检测
设备结构示意图如图4所示。
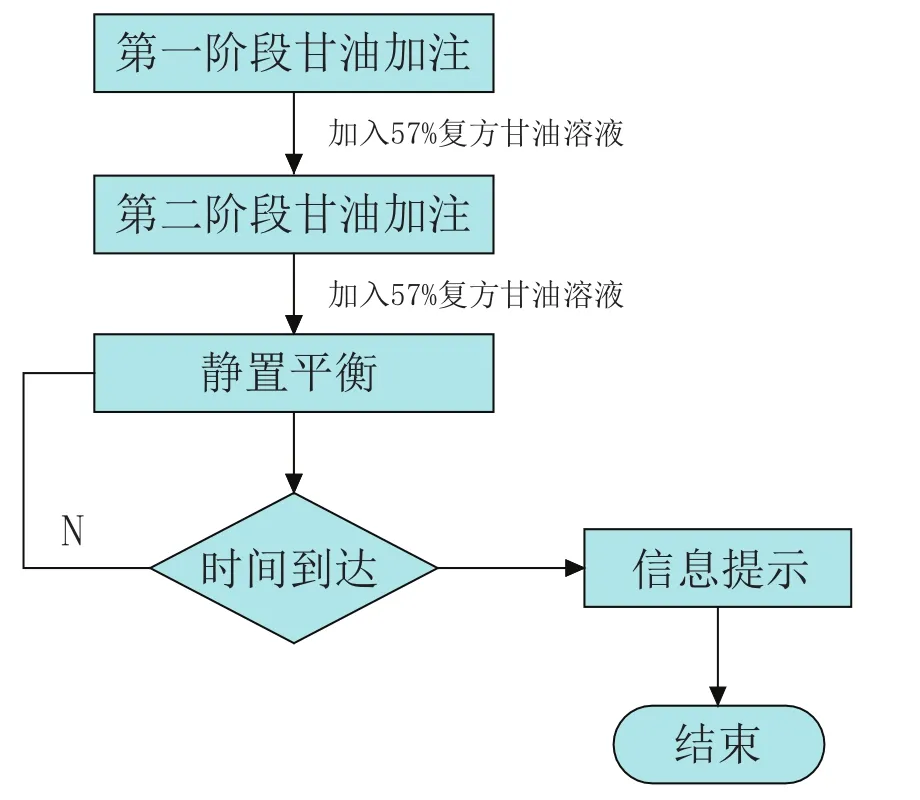
图1 红细胞甘油化工艺流程
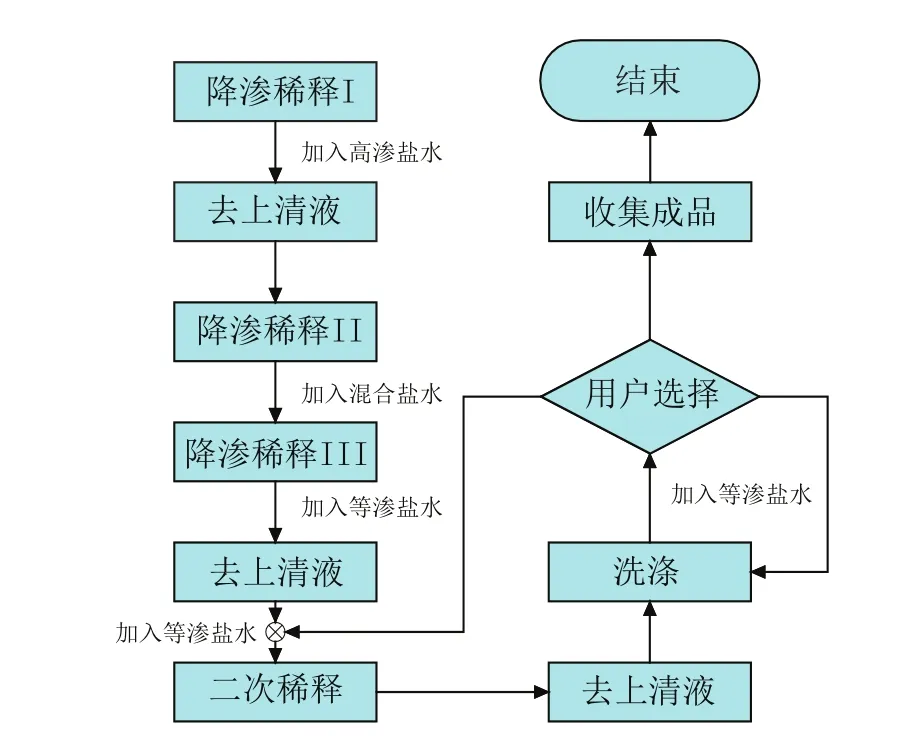
图2 冻融红细胞去甘油化工艺流程
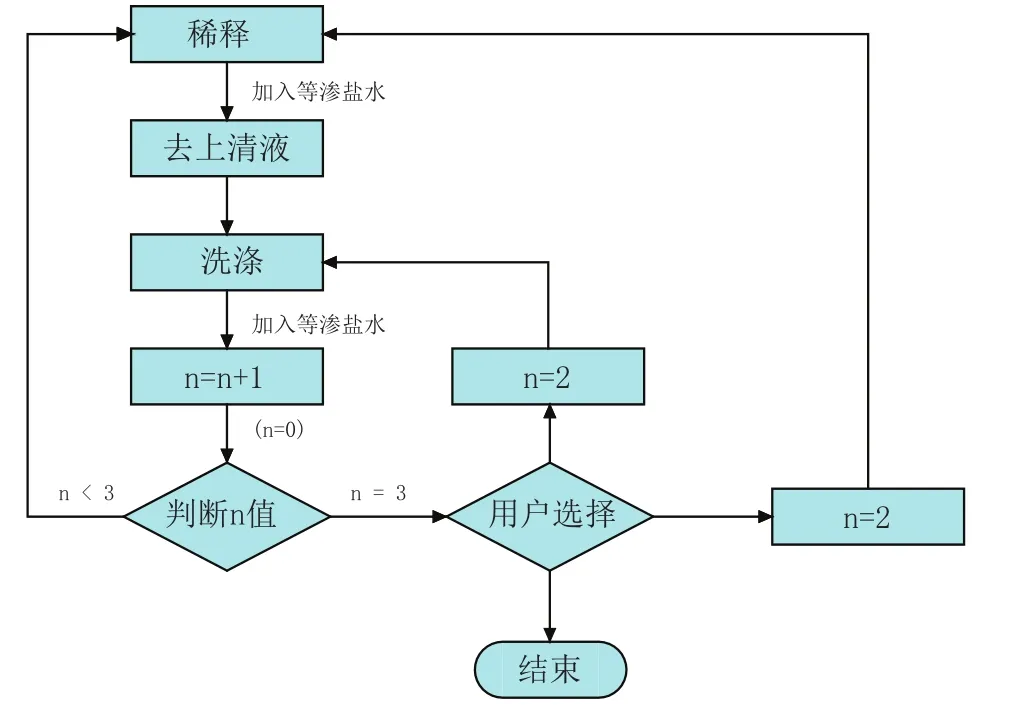
图3 洗涤红细胞工艺流程

图4 设备结构示意图
(1)操作面板。以中文、彩色图形方式显示工作全过程信息、各技术参数实时值、报警信息及故障处理提示,并提示操作步骤,使操作者能够直接控制血细胞处理仪的相关工作。
(2)清洗泵。清洗泵输送各种浓度清洗液至液体袋或离心杯的蠕动泵。
(3)转移泵。转移泵输送各种浓度清洗液至液体袋或将血液转移至离心杯及成品袋的蠕动泵。
(4)离心机。离心机工作时以5200 r/min的速度带动离心杯高速旋转。当输入含多种成份细胞液体时,根据各种细胞密度的不同,进行细胞成份分离。当离心杯发生破裂、漏液时,离心机内漏液感应器立即报警,停止离心机和泵的运行。
(5)管路空气探测器。在处理过程中,如探测出空管时血细胞处理仪将报警,以提示操作者的注意。
(6)管路压力监测器。用于实时监视管道内介质压力,当超出规定范围时会自动发出报警信息。
(7)阀门。血细胞处理仪阀门按照程序的命令开与闭,控制相应管路的开启和关闭。
(8)电子秤。提供可选择的成品重量作为补充功能。
2 仪器各项最佳性能参数的确定
(1)离心机转速:其工作转速为3000~5200 r/min,误差<±10%。
(2)转移泵转速:4~200 r/min,误差<±2 r/min。
(3)清洗泵转速:4~200 r/min,误差<±2 r/min。
(4)噪声:其运行噪声为75~100 dB。
(5)振动幅度:工作中振动幅度为0.2~0.5 mm。
(6)摇摆组件:摇摆组件承载重量为1000~4000 g时可正常运行。
(7)摇摆速度:12~20 r/min,误差<±2 r/min。
3 处理后红细胞的临床验证
对处理后的红细胞进行临床验证,是指其受试品的选择、分组、检测指标与方法、统计方法以及在不同工作条件下血细胞处理仪对红细胞处理后的实验室指标检测。选择在环境温度为-10~+60 ℃、相对湿度为10%~90%的条件下进行检测。
3.1 受试品的选择
选择在采血中心正常捐献的血液60袋(2 U/袋),并按照试验需求进行成分分离制备和保存。
3.2 分组
本试验采用随机、对照试验设计。由计算公式1计算样本量,其中N为每组的例数。

3.3 检测指标与方法
按照国家标准“GB 18469-2012全血与成分血质量要求”的检测指标进行检测。冰冻红细胞解冻洗涤之后肉眼观察其外观、容量,并立即留样检测血红蛋白含量,进行白细胞计数和无菌试验;并在第一时间对样本进行离心,分离上清检测游离血红蛋白及甘油残留量。采用血细胞计数仪检测血红蛋白含量,采用三波长法检测游离血红蛋白;使用Nageotte计数板检测残余白细胞数;采用渗透压法测定甘油的残余量(Digital Spectrometer仪器测定);采用常规无菌试验进行细菌检测。其中用血清比重反映甘油残留量,当甘油含量为1%(10 g/L)时,其克分子浓度为420 mmol/L,其渗透压为420 m O sm/L,对应的血清比重为1.0115。
采用与分离上清检测游离血红蛋白及甘油残留量相同的方法分离上清检测蛋白质含量和游离血红蛋白,计算溶血率。采用血细胞计数仪检测血红蛋白含量,采用脑脊液蛋白测定法检测洗涤红细胞上清蛋白含量,采用双波长法检测游离血红蛋白,采用常规无菌试验进行细菌检测。
4 制定血细胞处理仪注册产品标准
为了确保血细胞处理仪的产品质量和使用安全,使血细胞处理仪的生产有章可循,检验有据可依,根据国家标准委员会的规定,制定注册产品标准。本标准根据国家标准“GB 9706.1-2007医用电气设备 第一部分:安全通用要求”进行编写,编写格式按按照国家标准“GB/T1.1-2009标准化工作导则第一部分:标准的结构和编写”和“医疗器械标准管理办法”的要求进行编写。
5 结论
全自动血细胞处理仪的研制,可实现冰冻红细胞的全自动制备,其程序化可最大程度减少人为差错和事故的发生,保证产品质量。自动化操作减少了劳动强度,可做到一人多机操作,克服了手工洗涤操作步骤多、所需时间长、工作效率低及人为因素影响大等诸多问题。在全自动细胞处理仪封闭的系统中,通过蠕动泵控制甘油加入速度。在加入甘油的过程中采用配套的摇摆机,用于悬浮红细胞与甘油的混匀。摇摆机采用360o摇摆方式为创新之处,与往复式和翘板式摇摆机相比其混合效果更佳,同时摇摆速度可以根据需要进行调节。与国外同类其他设备耗材相比,研制的全自动血细胞处理仪设备及耗材可实现国产化,价格相对较低,便于国内不同级别的地方血站,尤其是军队血站在建立战备稀有血型库中推广使用。
[1]邹文涛,梁兵,田兆嵩.冰冻红细胞的制备方法、质量研究及临床应用[J].中国输血杂志,2006,19(3):254-257.
[2]李玉秋,时卉丽,孙晓红,等.冰冻红细胞的制备方法及临床应用[J].河北医药,2013,35(5):770-772.
[3]左江涛,聂继盛,张德梅,等.2009-2011年太原地区稀有血型志愿者资料库情况分析[J].中国药物与临床,201,13(4):463-465.
[4]王初,肖振山.加强稀有血型献血者应急队伍建设和管理[J].吉林医药学院学报,2012,33(4):246-247.
[5]王赤林,谢毓滨,邱明,等.红细胞冰冻前的最佳保存期探讨[J].中国组织工程研究,2012(32):6011-6013.
[6]李宁,沃德勒,李刚,等.应急采供血方案的浅谈与思考[J].医学信息,2012,25(11):243-244.
[7]罗广平,赵阳,陈扬凯.ACP215型血液处理仪制备冰冻红细胞的方法学评价[J].广州医药,2008,39(3):35-37.
[8]赵晓薇.全自动细胞处理系统制备冰冻红细胞的评价[J].吉林医药学院学报,2012,33(4):261-262.
[9]Lagerberg JW,Truijens-de Lange R,de Korte D,et al.Altered processing of thawed red cells to improve the in vitro quality during postthaw storage at 4 degrees C[J].Transfusion,2007,47(12):2242-2249.
[10]杨冬燕,段恒英,王娟娟,等.全自动细胞处理系统制备冰冻红细胞的关键控制点及效果评价[J].重庆医学,2009,38(9):1078-1079.
[11]马庆,张嘉敏,李勤,等.深低温长期保存方法延缓红细胞衰老的研究[J].临床输血与检验,2013,15(2):112-115.
[12]王赤林,袁继荣,李双.冰冻红细胞制备过程中若干问题探讨[J].中国输血杂志,2004,17(1):21-22.
[13]陈婉屏,杨文萍.ACP215全自动细胞处理仪制备冰冻红细胞技术应用[J].临床血液学杂志(输血与检验版),2011,24(3):351-352.
[14]梁世艳,张支凤,李华领,等.Rh(D)阴性冰冻红细胞库的建立及临床应用[J].卫生职业教育,2012,30(22):134-135.
[15]王万仲.手工密闭式制备冰冻解冻去甘油红细胞方法研究[J].中国卫生产业,2012,9(1):96-98.
[16]王惟.不同保存时间的悬浮红细胞制备冰冻红细胞质量分析[J].中外医疗,2012,31(10):167.

