J亚群禽白血病病毒分离株HLJ09SH01株感染性克隆的构建及其致病性研究
纪晓琳,王 琦,高玉龙,王永强,秦立廷,祁小乐,高宏雷,王笑梅
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/禽传染病研究室,黑龙江哈尔滨150001)
J亚群禽白血病病毒(Avian leukosis virus sabgroup J)ALV-J属于反转录病毒中的Al-pharetrovirus家族,其前病毒基因组结构为5'-LTR-leadergag/pol-env-rTM-DR1-E-LTR-3'。1988年从英国肉鸡中分离到第一株ALV-J原型病毒HPRS-103,其宿主范围、病毒囊膜干扰和交叉中和试验与A、B、C、D、E亚群不同,而独立成为一个亚群[1-2]。HPRS-103主要引起肉鸡产生以骨髓瘤为主的各种类型肿瘤[1-2]。1997年 Flady报道了美国也出现了ALV-J感染肉鸡群的现象[3]。1999年,ALV-J首次在中国肉鸡群中被分离到[4],随着其在中国鸡群中的传播,宿主范围逐渐扩大,能够感染肉鸡和蛋鸡,并在蛋鸡群中大规模流行[5]。ALV-J能够导致某些蛋鸡群中60%的鸡发生肿瘤,并导致超过20%的被感染鸡死亡,或者导致蛋鸡产蛋率严重下降,临床上引起包括血管瘤、髓细胞瘤、组织肉瘤、成红细胞瘤等多种类型的肿瘤,给养殖业造成一定的经济损失[6-7]。
反转录病毒的RNA聚合酶缺乏校对机制,其基因组有一个插入宿主基因组的过程,从而造成ALV-J在遗传上的多变性。在分离ALV-J过程中,同时可以分离出ALV其他亚群,给研究其致病机理造成困难。本研究构建了单一来源的ALV-J的感染性克隆rHLJ09SH01,并进行蛋鸡和肉鸡的致病性试验,为研究ALV-J对蛋鸡和肉鸡致病力差异奠定了基础。
1 材料和方法
1.1 病毒株、细胞、载体和实验动物 ALV-J HLJ09SH01分离株为本实验室分离鉴定;DF-1细胞、pBluescript IIKS(+)载体和DH5a菌种为本实验室保存;11日龄SPF来航蛋鸡和商品系肉鸡由哈尔滨兽医研究所实验动物中心提供。
1.2 主要试剂 各种限制性内切酶、PrimeSTARTMHS DNA Polymerase、DNA Marker、dNTP 等 购 自TaKaRa公司;质粒提取试剂盒、核酸凝胶回收试剂盒购自Axygen公司;Plasmid M idiKits购自QIAGEN公司;反转录酶活性检测试剂盒购自Roche公司;兔抗鸡FITC-IgG购自Sigma公司。
1.3 引物设计 以GenBank中登录的ALV-J原型株(Z46390)为参考,设计合成用于扩增前病毒基因组的引物(表1)。
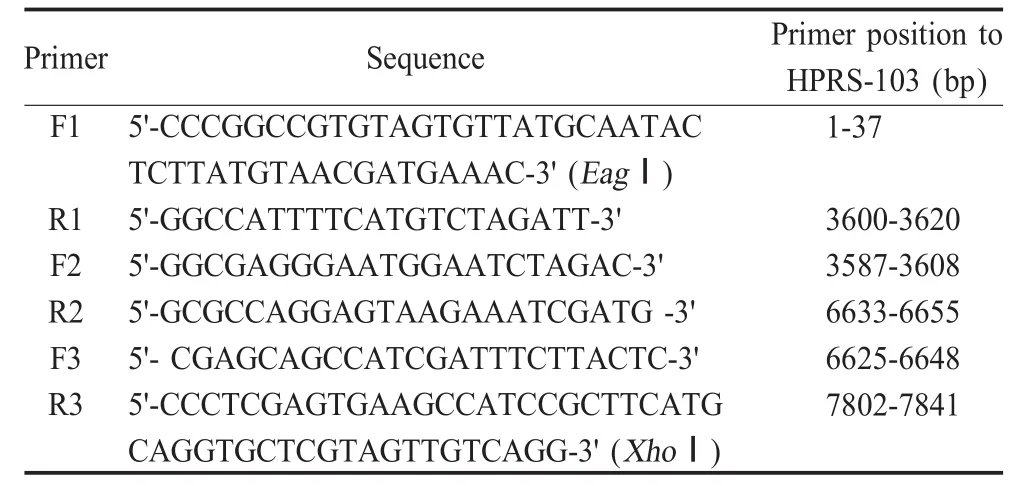
表1 扩增pBlue-ALV-J前病毒基因组(pre-DNA)所用引物Table1Primers used for ALV-J pre-DNA amplification
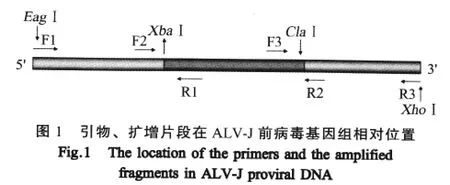
1.4 HLJ09SH01株前病毒cDNA克隆的构建 根据已完成的ALV-JHLJ09SH01株前病毒基因组的序列(HQ634806),经MapDraw软件对拼接的序列进行分析,采用PCR方法分3段扩增SD1009株的前病毒cDNA(图1),PCR产物经克隆酶切后顺次连接,获得1个含有完整ALV-J前病毒cDNA的重组质粒,命名为pBlue-HLJ09SH01。
1.5 细胞转染及病毒拯救 采用QIAGEN Plasm id M idi Kits制备纯化 pBlue-HLJ09SH01,由 LipofectctamineTM2000分别介导转染约80%的单层DF1细胞,同时以正常的DF1细胞为对照,转染后72h收获病毒,反复冻融3次后连续在DF1中传代。
1.6 病毒粒子的鉴定
1.6.1间接免疫荧光(IFA)检测将第7代拯救病毒按常规方法接种于约60%单层的DF1细胞96孔板中,7d后按常规方法进行IFA检测,一抗为抗ALV-J的多克隆抗体,二抗为兔抗鸡FITC-IgG。同时设不接种病毒细胞对照。
1.6.2ALV抗原检测按照IDEXX Avian Leukosis Virus Antigen Test(ALV-Ag)试剂盒操作方法检测病毒的P27抗原。
1.6.3反转录酶活性检验采用Roche的Reverse transcriptase assay试剂盒按照试剂盒说明书对拯救病毒的第7代进行反转录酶活性的检测。
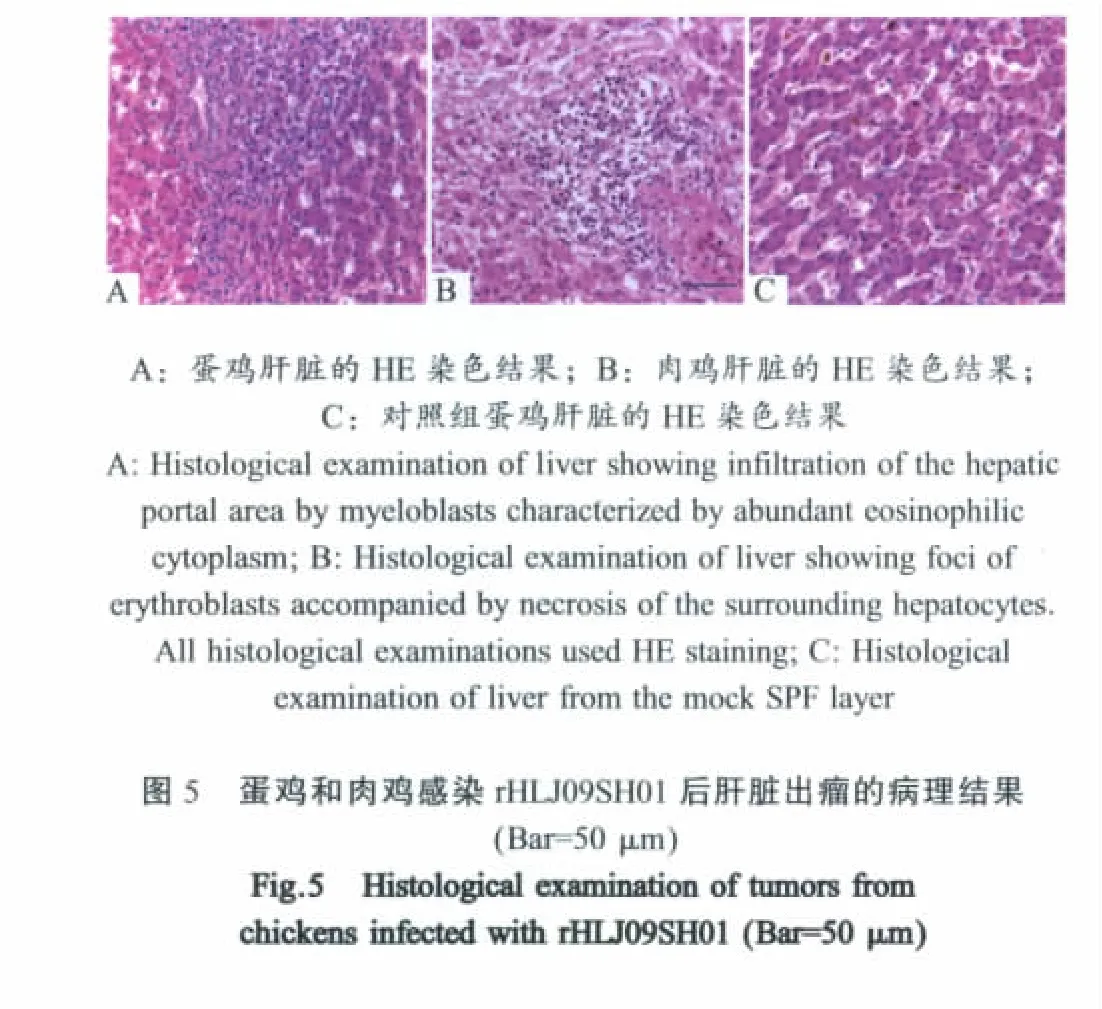
1.7 致病性试验 将0.25m L的rHLJ09SH01(102.5/m L TCID50)经鸡胚静脉接种11日龄SPF蛋鸡鸡胚和肉鸡鸡胚,待孵育出壳后,分别饲养32周。在饲养过程中,对病死鸡进行解剖,各脏器样品进行HE染色,确定肿瘤类型。32周后统一迫杀并对肿瘤进行观察。
2 结 果
2.1 ALV感染性克隆的构建 以细胞培养ALV HLJ09SH01分离株的DNA为模板,分别采用3对特异性引物,对ALV前病毒DNA分3段进行PCR扩增(图2);并以该前病毒cDNA为模板,F3、R3为引物,PCR扩增。以ClaⅠ和XhoⅠ双酶切PCR产物及pBluescript IIKS(+),经连接和转化后,挑取白色菌落进行鉴定,阳性重组质粒命名为pbw-c。以分离株HLJ09SH01的前cDNA为模板,F1、R1为引物进行PCR扩增,产物与pbw-c以EagⅠ和XBaⅠ双酶切,经连接和转化后,挑取单一菌落鉴定,阳性重组质粒命名为pbw-c-a。再以分离株HLJ09SH01的前cDNA为模板,F2、R2为引物进行PCR扩增,将产物与pbw-c-a分别以XbaⅠ和ClaⅠ进行双酶切,经连接和转化后,挑取单一菌落鉴定,将阳性重组质粒命名为pbw-c-a-b。以ClaⅠ和XhoⅠ双酶切鉴定pbw-c,以EagⅠ和KpnⅠ双酶切鉴定pbw-c-a,以EagⅠ单酶切鉴定pBlue-HLJ09SH01,均获得与预期一致的片段,表明构建了pBlue-HLJ09SH01。
2.2 拯救病毒rHLJ09SH01的鉴定
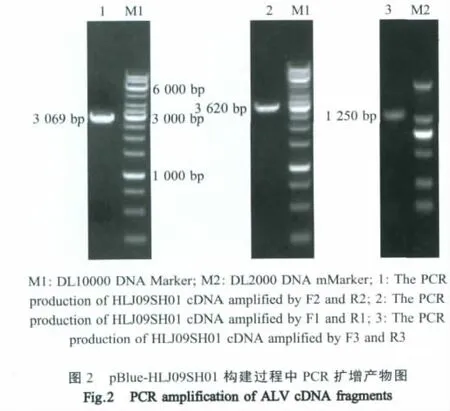
2.2.1IFA鉴定rHLJ09SH01与抗ALV-J多克隆抗体呈现阳性反应,感染组DF-1细胞表面以及胞浆有明显绿色荧光,对照组细胞没有绿色荧光(图3),表明拯救了病毒。
2.2.2试剂盒检验以IDEXX Avian Leukosis Virus Antigen Test(ALV-Ag)检测第7代拯救病毒,并绘制标准曲线。通过ELISA检测,取多次检测的平均数为1.306,阳性孔在OD650nm吸光度平均值为0.368,表明拯救了病毒。
2.2.3反转录酶试剂盒检验拯救病毒采用Roche的Reverse transcriptase assay试剂盒,通过HIV绘制标准曲线,再通过吸光度确定第7代拯救病毒的反转录酶活性,通过ELISA检测,取多次检测的平均数,ELISA在OD450nm处吸光度值为3.128,所对应的反转录酶活性为1.5281,HIV标准品反转录酶活性分别为0.0625、0.125、0.25、0.5和1,并以其绘制标准曲线。表明拯救病毒具有反转录酶活性。
2.3 rHLJ09SH01在DF-1培养液的滴度 将第7代病毒液接种单层DF-1(106个)细胞,于感染后1d、2d、3d、4d、5d、6d和7d分别取细胞上清,通过检测反转录酶活性,反映rHLJ09SH01在体外的生长复制水平(图4)。
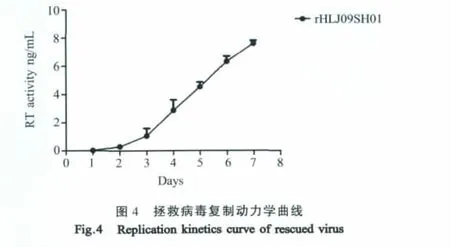
2.4 rHLJ09SH01的致病性 感染rHLJ09SH01的蛋鸡中存在57.9%的鸡发生肿瘤(11/19),被感染肉鸡中有83.3%鸡发生肿瘤(10/12),对照组没有鸡出现肿瘤。肉鸡和蛋鸡发生肿瘤的位置均在肝脏、肾脏、肺脏和小肠等器官。剖检可见明显的肿瘤,病理切片可以观察有大量瘤细胞浸润正常细胞(图5)。
3 讨论
针对目前分离的ALV-J存在与其他病毒或ALV其他亚群交叉感染的情况,很难纯化得到单一的病毒。构建单一来源ALV-J的感染性克隆是获得病毒纯化培养的有效方法。由于反转录病毒的感染性克隆不需要人工插入启动子,为了排除质粒瞬时转染蛋白的可能性,本研究将转染后的病毒接种DF1细胞,并维持7d,依次传代,每一代次均在DF1中维持7d,再进行病毒活性检测,最终确定获得拯救病毒。
本研究在蛋鸡分离ALV-J的基础上构建了感染性克隆,并拯救出病毒。为进一步探究拯救病毒是否具有天然病毒的致病性,进行了rHLJ09SH01感染性蛋鸡和肉鸡的致病性试验。结果表明,rHLJ09SH01可以导致蛋鸡和肉鸡发病,分别引起57.9%的蛋鸡和83.3%的肉鸡发生肿瘤。虽然rHLJ09SH01是蛋鸡来源的ALV-J,但仍可以导致肉鸡发病,并且肉鸡发生肿瘤的比率高于SPF蛋鸡,可能是因为本研究持续进行了238d,已远远超过正常商品代肉鸡的饲养周期,肿瘤的发生本身是一个多因素的过程,所以rHLJ09SH01致商品代肉鸡的出瘤率高于SPF蛋鸡。
目前鲜有关于ALV-J致肉鸡发病的报道,本研究结果表明,国内流行的ALV-J也可以导致肉鸡发病。在本研究中,rHLJ09SH01导致肉鸡发病的情况发生在人工感染后70d,ALV-J导致商品代肉鸡发病的时间超过其正常饲养周期,虽然父母代肉鸡饲养周期较长,但其饲养数量较少,净化及预防措施相对完善,这可能是目前鲜有ALV-J感染肉鸡的报道的原因。
[1]Payne L N,Gillespie A M,Howes K.Induction of myeloid leukosis and other tumours with the HPRS-103strain of ALV[J].Vet Rec,1991,129:447-448.
[2]Payne L N,Gillespie A M,Howes K.Myeloid leukaemogenicity and transm ission of the HPRS-103strain of avian leukosis virus[J].Leukem ia,1992,6:1167-1176.
[3]Fadly A M,Smith E J.Isolation and some characteristics of a subgroup J-like avian leukosis virus associated with myeloid leukosis in meat-type chickens in the United States[J].Avian Dis,1999,43:391-400.
[4]Du Y,Cui Z,Qin A.Subgroup J of avian leukosis viruses in China[J].China Poult Sci,1999,3:1-4.
[5]Gao Yu-long,Yun Bing-ling,Qin Li-ting,et al.Molecular epidemiology of avian leukosis virus subgroup j in layer flocks in china[J].JClin M icrobiol,2012,50:953-960.
[6]Cheng Zi-qiang,Liu Jian-zhu,Cui Zhi-zhong,et al.Tumors associated w ith avian leukosis virus subgroup J in layer hens during 2007to 2009in China[J].J Vet Med Sci,2010,72:1027-1033.
[7]Gao Yu-long,Qin Li-ting,Pan Wei,et al.Avian leukosis virus subgroup J in layer chickens,China[J].Emerg Infect Dis,2010,16:1637-1638.

