H7N9禽流感病毒等温扩增快速检测方法的建立
董志珍,郑文杰,王乃福,赵祥平,吴冬雪,王玉玲,马 晶,贾润清,王建华,张晓光
(1.天津出入境检验检疫局动植物与食品检测中心,天津 300456;2.中国疾病预防控制中心病毒病预防控制所传染病预防控制国家重点实验室,北京 100052)
H7N9禽流感是由H7N9亚型禽流感病毒引起的禽类疾病,原本属于低致病性流感病毒,长期以来仅有其来源于野鸟的报道。但2013年3月下旬,H7N9亚型禽流感病毒跨越种属,人类感染H7N9病毒的患者在上海、江苏,陆续又在中国多个省份被发现,这是该病毒全球首次感染人类。截止5月11日,全国内地共报告人感染H7N9禽流感确诊病例130例,其中死亡人数33人,H7N9禽流感已经成为我国及周边国家和地区公共卫生机制新的考验。同时,由于H7N9禽流感的爆发,国内家禽养殖业受到巨大影响,周边国家越南和印尼已经禁止从我国进口家禽,国家和家禽养殖户蒙受巨额经济损失。据统计,此次人感染H7N9禽流感病毒出现前,全球共检出25株H7N9亚型流感病毒,均来自野鸟,从未在家禽中发现,因此快速、准确的检测家禽样品中是否含有H7N9亚型禽流感病毒将有助于控制H7N9禽流感在人群间的传播,并为我国的家禽养殖业动物及其产品的正常贸易提供强有力的技术支持。
通常,禽流感的诊断主要依靠流行病学与临床诊断,确诊依赖于病毒分离、病毒抗原与血清抗体等监测。病毒分离和血凝抑制试验是检测AIV和鉴定其亚型的标准方法,但费时费力[1]。此次H7N9禽流感病毒在人群间传播,国家流感中心及北京出入境检验检疫局分别建立了用于H7N9禽流感病毒检测的荧光定量PCR检测方法[2],该方法快速,灵敏度高,但该方法对人员素质及设备要求都很高,难于在基层诊断实验室普及应用。Notomi 等开发了一种恒温核酸扩增方法,即环介导等温扩增法(loop -mediated isothermal am p l if ic at io n,LAMP),其特点是在等温条件(65℃左右)下作用60 min 左右即可完成核酸扩增反应,更为重要的是此方法不需要贵重的仪器和试剂[3],在水浴锅中就能完成反应,特别适合在野外现场和基层部门应用[4]。近年来,LAMP 法已被成功地用于诊断发生于人类和动物的病毒性疾病,成为检测多种致病病毒的有效工具[5-6]。我们依据H7N9 亚型禽流感病毒的HA基因和NA基因序列保守区域设计了LAMP 引物,以所构建的阳性质粒为模板,建立了一种H7N9 禽流感病毒的LAMP早期快速检测方法。
1 材料和方法
1.1 材料
禽流感H7N9(安徽株)灭活病毒由国家流感中心舒跃龙教授惠赠;总RNA提取试剂盒、DNA提取试剂盒、Bst DNA聚合酶、M-MULV反转录酶、RNA酶抑制剂购自NEB公司; 质粒小量提取试剂盒、大肠杆菌TOP10感受态细胞购自TIANGEN公司;Betaine(甜菜碱)、MgSO4购自Sigma公司。
1.2 引物的设计与合成
根据登录于GISAID数据库的H7N9禽流感HA基因和NA基因序列,应用生物学软件进行序列比对,在HA和NA的保守区利用PrimerExplorer V4设计了2对引物(外引物和内引物)。荧光定量PCR所用引物和探针为国家流感中心公布,所有探针、引物的合成修饰由英俊公司完成,序列见表1。

表1 引物和探针序列
1.3 RNA的提取及cDNA的制备
取经DEPC 水处理过的EP管, 加入1 mL Trizol 和200mL灭活病毒液,混匀后室温放置5 min;加入200 mL 氯仿,用力摇晃30 s,室温静置3 min,4℃离心15 min,液体分层;取上层液移入干净的EP 管, 加入500 mL 异丙醇,-20℃静置30min,4℃离心15 min;移去上层悬液;加入1 mL 75%的DEPC 乙醇,涡旋振荡,4℃离心10 min;去上清,空气中干燥5 min; 向试管中加入50 mL DEPC 水。参照M-MuLV 反转录酶过程进行反转录, 得到cDNA,-20℃备用。
1.4 阳性重组质粒的构建
利用针对H7N9禽流感HA基因和NA基因的特异性引物,将cDNA在50mL 体系中进行PCR扩增,得到的PCR 产物纯化后克隆到pGEM-T easy载体中并转化至大肠杆菌TOP10 感受态细胞中,从纯化扩增的重组菌中提取质粒,进行酶切鉴定,HA重组质粒用EcoRⅠ,NotⅠ双切,NA重组质粒用sfi I单切鉴定,选取阳性重组质粒进行测序,从而为检测提供阳性质粒,并利用此阳性质粒对LAMP 方法进行优化。
1.5 H7N9亚型禽流感病毒的环介导等温扩增方法检测
1.5.1 H7N9亚型禽流感病毒HA基因区的检测
经过摸索和优化反应条件后,建立如下扩增反应体系: 2mL cDNA样品、5mL Bst DNA 聚合酶缓冲液(10×)、2mL Bst DNA 聚合酶(8000U/ L)、5mL dNTP(10mmol/L)、3mL Betaine(5mol/L)、6mL Mg SO4(25mmol/L)、对应于HA基因的引物 FIP和 BIP各 4mL、F3和 B3各 0.5mL、6mL H2O。混匀,65 ℃,水浴1.5h。
1.5.2 H7N9亚型禽流感病毒NA基因区的检测
方法与HA 基因区的检测相同, 使用的引物为对应于NA 基因区的4条特异性引物。
1.6 扩增产物的检测
LAMP 反应结束后,取5mL扩增产物进行1.5%琼脂糖凝胶电泳;其余扩增产物采用荧光染料法同步检测,向扩增管中加入2mL 50倍稀释的SYBR Green Ⅰ染料,在紫外灯和日光下观察反应管颜色变化。回收HA 和NA 基因的阳性产物, 并以此为模板进行普通PCR 扩增,扩增产物送上海生工测序。
1.7 H7N9禽流感病毒HA和NA基因的检测灵敏度
取阳性质粒DNA,经紫外分光光度计测定浓度,10倍系列稀释后,进行H7N9禽流感病毒HA和NA基因的灵敏度检测试验。具体试验方案参照LAMP的常规操作程序进行。
1.8 特异性试验
分别以H1型、H3型、H5型禽流感病毒和新城疫病毒(NDV)核酸作为待测样品,以所提取的H7N9亚型禽流感病毒质粒DNA为阳性对照,以经DEPC处理的水为阴性对照,检验方法的特异性。
1.9 H7N9禽流感病毒的荧光定量PCR检测
H7N9 亚型禽流感病毒核酸的定量检测按国家流感中心发布的“H7N9禽流感病毒荧光定量检测标准操作规程”内容进行。同时,进行LAMP检测作为平行对照,对结果进行分析和比较。
2 结果
2.1 H7N9 亚型禽流感病毒HA基因和NA基因的扩增
取灭活病毒液,提取病毒基因组后,参照M-MuLV 反转录酶过程进行反转录, 得到cDNA,利用特异性引物对H7N9 亚型禽流感病毒HA基因和NA基因进行扩增,结果如图1所示,经扩增后得到HA基因1683bp,NA基因1398bp,与理论扩增值相符。
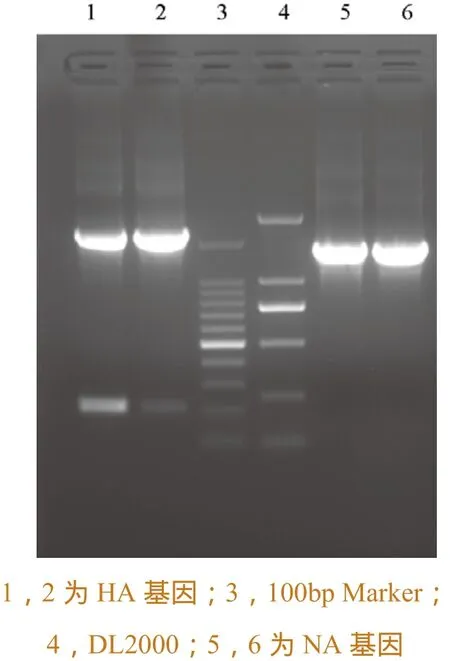
图1 HA基因和NA基因扩增图
2.2 阳性重组质粒的鉴定
将扩增后的HA 和NA基因,克隆到pGEM-T easy载体中并转化至大肠杆菌TOP10 感受态细胞中,从纯化扩增的重组菌中提取质粒,进行酶切鉴定,HA重组质粒用EcoRⅠ,NotⅠ双切,NA重组质粒用sfi I单切,结果如图2所示。构建的HA和NA重组质粒经酶切后均得到与理论相符的目的条带。取构建好的阳性质粒测序,测序结果显示扩增序列与登录于GISAID数据库的H7N9序列一致性为100%,表明所构建的质粒确实含有目的基因片段,可以作为阳性质粒使用。
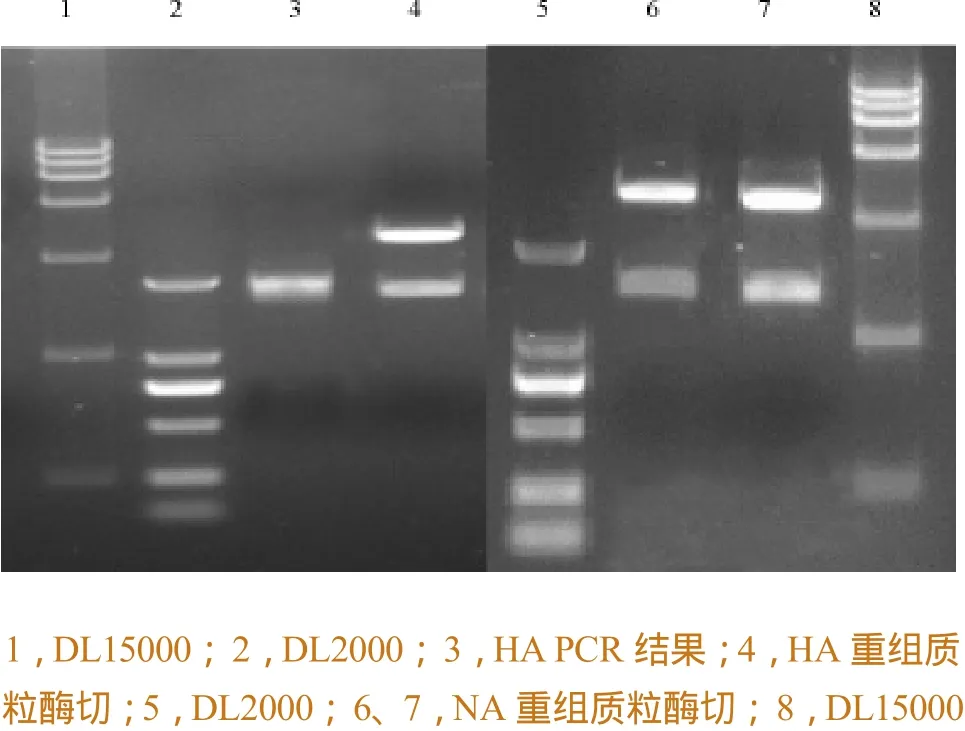
图2 HA和NA重组质粒酶切图
2.3 H7N9亚型禽流感病毒LAMP方法的检测
2.3.1 凝胶电泳结果观察
经过摸索和优化反应条件后,建立针对H7N9亚型禽流感病毒HA基因区和NA基因区的LAMP检测方法,检测结果如图3所示,HA基因区(2、3)和NA基因区(6)的扩增结果中核酸电泳条带呈阶梯状分布,与理论结果相符,阴性对照(4、7)未见特异性产物出现。
2.3.2 染色结果观察
LAMP方法扩增产物中加入2mL 50倍稀释的SYBR Green Ⅰ进行染色,在紫外灯和日光下观察反应管颜色变化。图4所示,HA和NA基因阳性扩增管在可见光下呈黄绿色,阴性对照为橘红色。图5中,HA和NA基因阳性扩增管在紫外光下可见荧光产生,阴性对照管内无荧光产生。回收HA和NA 基因的阳性产物,进行普通PCR 扩增后测序得知,扩增序列与GISAID数据库中的H7N9序列一致,表明LAMP方法特异性的扩增检测H7N9病毒的HA基因和NA基因。
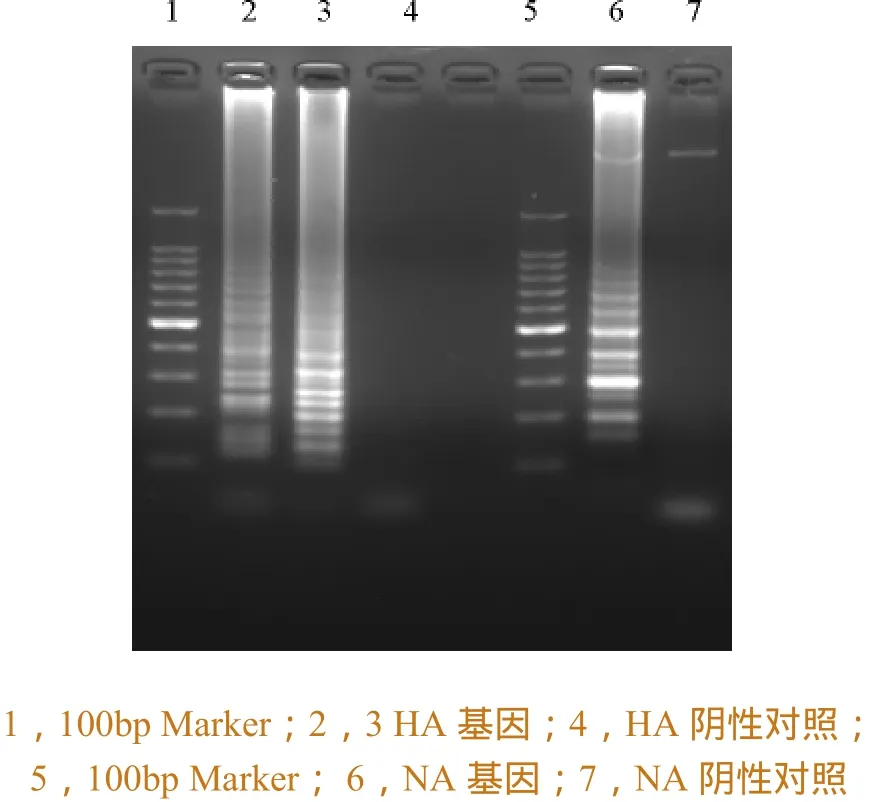
图3 LAMP扩增电泳结果

图4 LAMP扩增可见光结果

图5 LAMP扩增紫外光结果
2.4 HA和NA基因的灵敏度试验
取阳性质粒DNA,经紫外分光光度计测定浓度,10倍系列稀释后,进行H7N9禽流感病毒HA和NA基因的灵敏度检测试验。图6和图7中所示H7N9 禽流感病毒HA和NA 基因10 拷贝以上的稀释度均显示了典型的LAMP 扩增带型,说明该检测方法的灵敏度可达到10 个拷贝的水平。
2.5 特异性试验
分别以H1型、H3型、H5型禽流感病毒和新城疫病毒(NDV)核酸作为待测样品,以所提取的H7N9亚型禽流感病毒质粒DNA为阳性对照,以经DEPC处理的水为阴性对照,检验方法的特异性。结果如图8所示,阳性对照和阴性对照均成立,以H7N9亚型禽流感病毒所构建的质粒DNA呈阳性,其他试验样品呈阴性,表明试验所用引物对H7N9亚型禽流感病毒特异性良好。
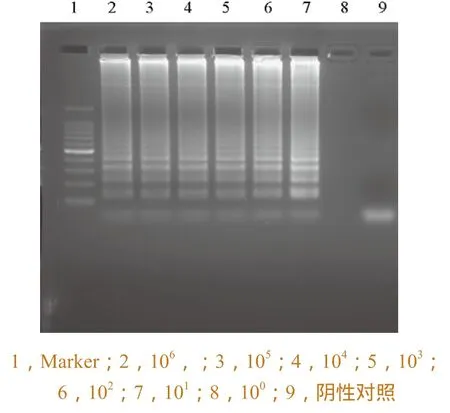
图6 HA基因检测灵敏度
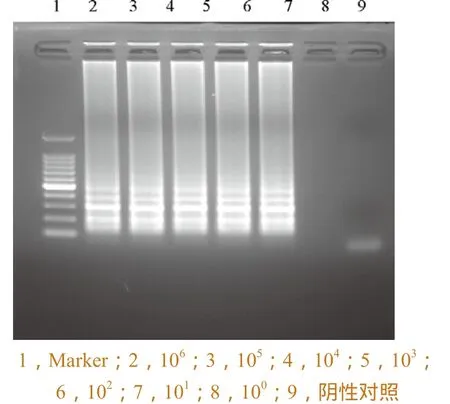
图7 NA基因检测灵敏度
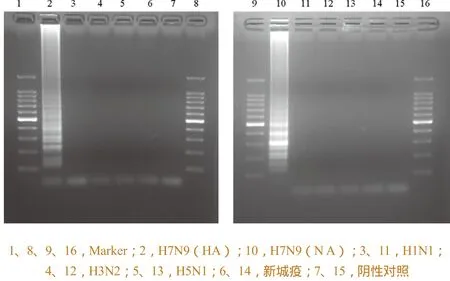
图8 特异性试验
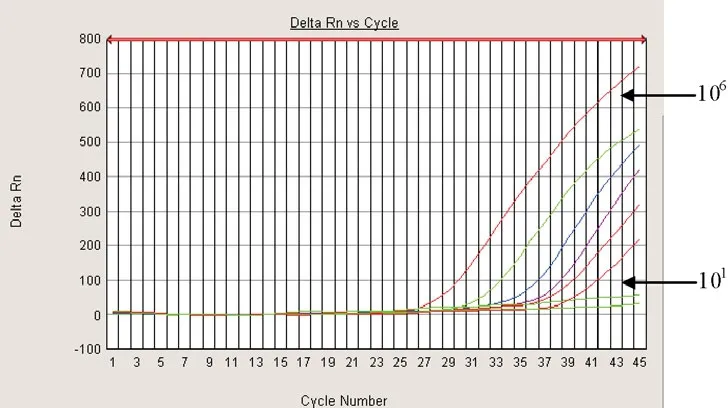
图9 荧光定量PCR在H7N9禽流感病毒检测中的灵敏度测试
2.6 荧光定量PCR与所建立的LAMP方法的对比
分别以荧光定量PCR方法和LAMP方法检测构建好的阳性重组质粒,荧光定量PCR方法检测结果如图9所示,灵敏度达到10个拷贝水平,与所建立的LAMP方法检测灵敏度相同。
3 讨论
环介导等温扩增技术( LAMP) 是一种新的核酸等温扩增技术,原理是在目的基因片段上的多个位点上设计4条或6条引物,通常只要4条引物即可完成目的基因的扩增,如果加入另外两条环引物,可以有效的加速整个反应过程,但反应体系内引物的增多也会增加引物二聚体的形成。LAMP 反应结果判别方法多样, 目前常用的有电泳法、荧光法、浊度法和钙黄绿素法[7]。浊度法和钙黄绿素法是基于LAMP 反应产生的大量焦磷酸盐副产物进行检测的方法, 因此这2种方法均存在一定程度的背景干扰,且干扰强度随反应时间延长而增加[8];电泳法和荧光法利用双链嵌合染料直接检测扩增产物,因此背景更低,其中荧光法的阳性、阴性可用肉眼区分,对操作人员的技术要求低,更适合于现场快速检测[9]。
本文采用LAMP技术建立了检测H7N9亚型禽流感病毒核酸的检测方法, 通过与中国疾控中心推荐的H7N9亚型禽流感病毒实时荧光RT - PCR 法相比较,两种方法的检测灵敏度相当,将106复制的病毒量质粒进行10倍系列稀释后,实时RT- PCR 检测和本文建立的LAMP方法检测灵敏度均为10个拷贝;从检测时间上看LAMP完成1次检测可在1.5h内完成,而实时RT- PCR法则需要3h。从所需仪器上看实时RT - PCR 需要荧光定量PCR 仪,而LAMP只需恒温水浴锅。
综上所述,本研究建立的H7N9亚型禽流感病毒核酸LAMP检测方法具有特异性强、灵敏度高、方便快捷等特点,可在基层或小型实验基地进行,同时也可应用于现场检测、卫生评价、临床诊断等方面,为H7N9亚型禽流感病毒检测提供了一种新的技术与方法。
[1]Imai M, Ninomiya A, Minekawa H, et al. Development of H5-RT-LAMP(loop-mediated isothermal ampli fi cation)system for rapid diagnosis of H5 avian influenza virus infection[J]. Vaccine, 2006,24(44/46):6679-6682.
[2]Gao R, Cao B, Hu Y, et al.Human infection with a Novel Avian-Origin Influenza A (H7N9) Virus[J].N Engl J Med,2013 ,368(20):1888-1897.
[3]孙晓智. 口蹄疫病毒环介导等温扩增检测方法的建立与评价[D].内蒙古农业大学硕士学位论文, 2007,5:1-78.
[4]李启明, 马学军, 周蕊环, 等. 环介导逆转录等温扩增技术(RTLAMP)在丙型肝炎病毒基因检测中的应用[J]. 病毒学报, 2006,22(5):334-337.
[5]Manmo han P, Guillermo P, Shing oInoue, et al.Real-time reverse transcription loop-mediated isothermal ampli fi cation for rapid detection of West Nile virus [J].J Clin Microbiol, 2004,42( 1) : 257- 263.
[6]Dukes J P, King D P, Alexandersen S.Novel reverse transcription loop-mediated isothermal amplification for rapid detection of foot- and-mouth disease virus [J].Arch Virol,2006, 151(6): 1093- 1106.
[7]Nagamine K, Watanabe K,Ohtsuka K, et al.Loop-mediated isothermal amplification reaction using a nondenatured template[J].Clin Chem, 2001, 47 ( 9) : 1742-1743.
[8]Iwamoto T, Sonobe T, Hayashi K.Loop-mediated isothermal ampli fi cation for direct detection of Mycobacterium tuberculosis complex, M.avium, and M.intracellulare in sputum samples[J].J Clin Mi crobiol, 2003, 41(6) : 2616-2622.
[9]Tomita N, Mori Y, Kanda H , e t al .Loop-mediated isothermal amplification (LAMP) of gene sequences and simple visual detection of products [J].Nat Protoc, 2008, 3(5) : 877-882.

