基于两种不同自由基的高级氧化法深度处理造纸废水的对比研究
郭 鑫 马邕文,,* 万金泉, 黄明智 王 艳
(1.华南理工大学轻工与食品学院,广东广州,510640;2.华南理工大学环境科学与工程学院,广东广州,510006)
造纸废水中的污染物浓度高且成分十分复杂,大多具有苯环结构,可生化性差,处理难度较大。因此造纸废水的综合治理一直是国内外环保研究的热点以及需要迫切解决的大问题。
许多工艺通过二级生化处理使造纸废水有机物得到了一定程度的降解[1-3]。但经过二级处理的造纸废水仍存在CODCr值偏高、色度较大等问题,因此需对其进行深度处理以保证达标排放以及回用。
高级氧化法在处理有毒有害及难降解有机废水中极具应用潜力。Fenton法是难降解有机物处理过程中研究最多的一种高级氧化工艺,是利用激发产生氧化性极强的羟基自由基 (·OH),反应破坏有机物分子结构,其实质是 H2O2在 Fe2+的催化作用下生成·OH。·OH具有强氧化性和很强的亲电加成性能,可将大多数有机物氧化分解成小分子物质 [见反应方程式 (1)~(9)[4]],可有效处理酚类、芳胺类、芳烃类、农药、制浆造纸、染料及核废料等难降解有机废水。Fenton法具有操作过程简单、反应物易得、费用低、无需复杂设备、对环境友好、可产生絮凝等优点而日益受到国内外的关注[5-6]。Perez等人[7]采用Fenton试剂产生氧化性极强的·OH氧化降解制浆造纸废水中的有机物时发现此方法能降低废水中的色度及CODCr值。Xu等人[8-9]分别采用了 Fenton和光-Fenton两种工艺处理二次纤维制浆废水时发现,两种方法均能降低水样的CODCr和色度。
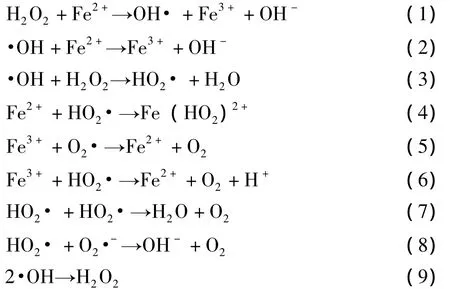
近年来,基于硫酸根自由基的高级氧化法降解水中难降解有机物的研究开始发展起来。过硫酸钠(PS)因其氧化性强,室温下稳定性高、水溶性好、价格相对较低等优点得到了很大关注。PS氧化主要是通过激发其产生硫酸根自由基来降解有机物,见反应方程式 (10)、(11)[10]。

Huang 等 人[11-12]、Liang 等 人[13]、Waldemer 等人[14]、Yang等人[15]通过热活化 PS降解苯、甲苯、苯乙烷、甲基叔丁基醚、酸性橙AO7等物质发现,降解率随温度的升高而增大,且一级动力学常数也随之增大;Gayathri等人[16]通过钴离子活化产生硫酸根自由基降解染料时亦可以得到良好的矿化效果;Yang等人[17]通过将活化的过硫酸钠应用于渗滤液处理时发现,在相同实验条件下,与Fenton法相比能达到更高的CODCr去除率。
目前硫酸根自由基的研究多为实验室的模拟水,物质单一,实际废水成分复杂多样。这种新型的高级氧化法应用于实际废水的研究还比较少,造纸废水中的应用尚未见报道。因此,本实验以实际产生的造纸废水二级出水为研究对象,利用Fe2+活化过硫酸钠产生硫酸根自由基,并在相同实验条件下与传统的Fenton反应作比较,对比了两种高级氧化法的处理效果,考察了诸多因子对处理效果的影响及反应过程的规律。
1 实验
1.1 实验原料及仪器
废水:取自广州市某造纸厂废水生化处理曝气池出水。主要水质指标见表1。

表1 废水主要指标
试剂:过硫酸钠 (天津市科密欧化学试剂有限公司),30%双氧水 (江苏强盛功能化学股份有限公司),还原铁粉 (天津市科密欧化学试剂有限公司),七水合硫酸亚铁 (天津市科密欧化学试剂有限公司),浓硫酸 (广州市东红化工厂),氢氧化钠 (南京化学试剂有限公司),碳酸氢钠 (天津市科密欧化学试剂有限公司),邻菲罗啉 (南京化学试剂有限公司),碘化钾 (天津市科密欧化学试剂有限公司),草酸钛钾 (阿拉丁试剂上海有限公司)。
仪器:Unic UV-2100紫外可见分光光度计;韶关明天COD消解仪;Mettler Toledo Seven Go pH计;电子分析天平。
1.2 实验方法
取100 mL水样于250 mL锥形瓶中,用稀硫酸(10%)调节pH值在3.0左右,加入一定量的硫酸亚铁粉末,然后快速加入氧化剂 (PS或H2O2),急速混合并开始计时。到设定的时间取出一定量的水样加入NaOH溶液,调节pH值为9.5左右以终止反应。然后在3500 r/min下离心30 min,取上清液留待检测。实验均在室温下进行,通常情况下反应3 h,每组至少做2个平行实验。
1.3 分析方法
采用韶关明天COD微波消解仪将废水加热至160℃消解25 min,待冷却后用回流滴定法计算水样的CODCr值,计算降解率。
色度采用Unic UV-2100紫外可见分光光度计测定其在350~600 nm范围内的吸光度[18],并通过Origin 8.5拟合求其峰面积,通过峰面积与色度的换算公式求出色度值,计算其色度去除率。峰面积与色度换算公式通过色度标准曲线得出:
A=8.6691Abs+4.1538
其中,A为检测废水的色度;Abs为检测废水350~600 nm的扫描面积,通过Origin 8.5拟合求出的峰面积。
Fe2+浓度用邻菲罗啉分光光度法测定。
H2O2浓度用钛盐光度法测定。
PS浓度的测定[19]:取适量溶液到50 mL比色管,稀释。然后顺序加入NaHCO3、KI、蒸馏水稀释到刻度。摇动,显色15 min。于352 nm处测定吸光度,通过标准曲线换算为浓度值。
2 结果与讨论
2.1 pH值对降解率的影响
1 mg/L CODCr的理论需O2质量浓度为1 mg/L。1 mg/L CODCr理论需 H2O2为 2.125 mg/L,因此200 mg/L CODCr所需H2O2的理论用量约为425 mg/L。每12 moL S2分解产生约1 moL O2,则1 mg/L CODCr所需 S2约为12 mg/L。因此,理论上当S2∶12CODCr=1时,投加的 PS刚好氧化全部CODCr。但由于体系中存在竞争消耗氧化剂的物质,因此实际CODCr降解率总是低于100%。
设定 H2O2的用量为 425 mg/L,PS用量为S2∶12CODCr=1,Fe2+用量为8 g/L,室温条件下反应3 h。在此设定条件下调节 pH值分别为3.0、7.0、8.1、10.0进行实验,考察 pH 值对两种氧化体系CODCr降解率和色度去除率的影响 (见图1)。

图1 pH值对不用氧化体系CODCr降解率和色度去除率的影响
由图1可以看出,两种自由基氧化降解的CODCr降解率和色度去除率均随pH值的升高而降低。在pH值为3.0时两种自由基氧化降解的效果皆最好,CODCr降解率分别达到了62.1%和59.4%,色度去除率分别达到了84.4%和82.5%,且从图1可以看出,Fenton氧化降解的CODCr降解率和色度去除率稍高于PS氧化降解的CODCr降解率和色度去除率。Fenton氧化需在强酸性条件下反应能达到良好的处理效果,当pH值上升至5时,处理效果明显下降。从图1中亦可看出,Fenton氧化时,pH值从3.0上升至7.0时,CODCr降解率骤然下降,从 pH值为3.0时的62.1%下降至pH值为7.0时的7.5%;色度去除率亦从pH值为3.0时的84.4%降至pH值为7.0时的17.1%,下降趋势十分明显。再继续升高pH值至碱性,Fenton氧化的CODCr降解率和色度去除率皆下降至10%以下。而SO-4·对pH值的适用范围较广,在酸性和中性条件下均能达到一定的处理效果。从图1可以看出,PS氧化的pH值从3.0上升至7.0再上升至10.0时,CODCr降解率从pH值为3.0时的59.4%到pH值为7.0时的47.3%再降至pH值为10.0时的9.3%,下降速率较Fenton氧化平缓;pH值从3.0上升至7.0时色度去除率变化不明显,仅从pH值为3.0时的82.5%下降至pH值为7.0时的77%,但继续升高 pH值至10.0时,色度去除率突然下降至15.5%。这说明了硫酸根自由基降解有机物的pH值范围为酸性至中性,在弱酸性条件下亦能达到一定的处理效果,而酸性条件更有利于硫酸根自由基的生成。据有关报道[12],过硫酸根离子非催化反应的活化能是140 kJ/mol,而酸催化反应的活化能仅为108.8 kJ/mol。这也与实验结果相符。更有最新报道表明,SO-4·在强碱性 (pH值>10)条件下亦能达到一定的降解效果[20]。
2.2 亚铁离子用量对降解率的影响
实验设定H2O2的用量为425 mg/L,PS用量为S2∶12CODCr=2[21],室温条件下反应 3 h。在 pH值为3.0和不调节pH值条件下分别设定Fe2+的用量为2、4、6、8、10、12 g/L进行实验,考察比较Fe2+用量对两种不同自由基氧化体系CODCr降解率和色度去除率的影响。
室温时,Fe2+用量对两种氧化体系CODCr降解率和色度去除率的影响如图2所示。在未调节pH值(图2(c)(d)所示)和调节初始pH值为3.0(图2(a)(b)所示)时,两种氧化体系CODCr降解率和色度去除率均在Fe2+达到最佳用量前随Fe2+用量的增加而升高之后下降。

图2 Fe2+用量对不同氧化体系CODCr降解率和色度去除率的影响
在未调节 pH值和调节初始 pH值为3.0时,Fenton氧化体系的Fe2+用量从2 g/L增加到6 g/L时,CODCr降解率从1.4%和14.8%上升到 9.1%和67.5%,色度去除率从1.4%和16.2%上升到10.3%和87.2%。继续增加Fenton氧化体系Fe2+用量时,CODCr降解率和色度去除率迅速下降。CODCr降解率在未调节pH值和调节初始pH值为3.0时,从Fe2+用量6 g/L时的9.1%和67.5%下降至12 g/L时的5.8%和42.4%,而色度去除率在未调节pH值和调节初始pH值为3.0时,亦从Fe2+用量6 g/L时的10.3%和87.2%下降到12 g/L时的 -0.9%和49%。未调节pH值时色度去除率下降至负值,溶液明显浑浊,说明过大的Fe2+用量对Fenton氧化产生了极大的副作用,Fe2+被氧化成Fe3+造成溶液浑浊。
在未调节pH值和调节初始pH值为3.0时,PS氧化体系的 Fe2+用量从2 g/L增加到8 g/L时,CODCr降解率和色度去除率皆随用量的增加而升高。CODCr降解率从2 g/L时的14.1%和31.7%上升到8 g/L时的39.3%和75.6%,色度去除率从2 g/L时的13.8%和53.9%上升到8 g/L时的58.1%和93.2%。而在Fe2+用量6 g/L时,PS氧化体系的CODCr降解率和色度去除率也分别达到了未调节pH值时的35.3%和 46.3% 及 pH 值为 3.0 时的68.4%和85%。此时,在调节初始pH值为3.0的条件下PS氧化同Fenton氧化具有相当的处理效果,在未调节初始pH值时,PS氧化显示出更好的处理效果。
因此,适量的Fe2+用量可以促进两种氧化体系有机污染物的降解,过量时会对降解起到抑制的作用。有研究证明[22-23],过量的Fe2+会与有机物竞争消耗自由基从而抑制有机物的降解,如反应方程式 (12)和 (13)所示。且实验发现在两种自由基氧化体系中,Fe2+用量对Fenton氧化反应影响更为敏感。综合考虑Fe2+用量对两种氧化体系CODCr降解率及色度去除率的影响关系,后续选取Fe2+用量为6 g/L进行对比实验。
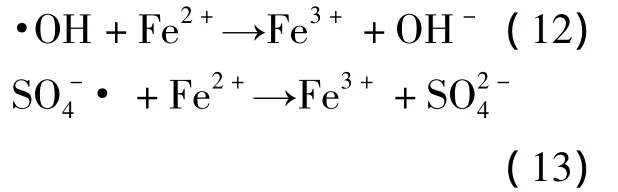
2.3 氧化剂用量对降解率的影响
实验设定Fe2+用量恒定为6 g/L,在调节初始pH值为3.0和不调节pH值的条件下分别设定Fenton氧化体系中 H2O2的用量为 40、80、160、240、320、400、560和800 mg/L,PS氧化体系中S2O2-8∶12CODCr=0.25、0.5、1、1.5、2、2.5、3、4,室温条件下反应3 h,比较两种氧化体系中氧化剂用量对CODCr降解率和色度去除率的影响。
室温时,氧化剂用量对两种氧化体系CODCr的降解率和色度去除率的影响如图3所示。增加氧化剂的用量,两种氧化体系CODCr降解率和色度去除率均随之增加。
由图3(a)~3(b)可以看出,在未调节pH值和调节初始pH值为3.0时,Fenton氧化的CODCr降解率从H2O2用量40 mg/L时的0.6%和10.9%上升到640 mg/L时的10.1%和68.9%,之后下降到800 mg/L时的7.7%和57.6%;PS氧化的 CODCr降解率从S2O2-
8∶12CODCr=0.25 时的 4.7% 和 27.8%上升到S2O2-8∶12CODCr=2时的35.6%和68.7%,之后变化甚微。由图3(c)~3(d)可以看出,在未调节pH值和调节初始pH值为3.0时,Fenton氧化的色度去除率从H2O2用量 40 mg/L时的 -3.5%和38.4%上升到640 mg/L时的5.6%和95.8%,之后下降到800 mg/L时的3.8%和76.3%;PS 氧化的色度去除率从S2O2-8∶12CODCr=0.25 时的9.1%和22.9%上升到 S2O2-8∶12CODCr=2时的52.9%和92.6%。
这说明,过量的H2O2会对Fenton氧化起抑制作用,通过H2O2氧化Fe2+到Fe3+从而减少催化剂Fe2+的量以阻碍催化反应进行。Fenton氧化体系氧化剂达到最佳用量后,在调节初始pH值为3.0的酸性条件下迅速下降,而未调节pH值的碱性条件
下下降较为缓慢。在PS氧化体系中,当氧化剂达到一定用量时,反应效果变得不明显,是由于PS本身可以氧化降解有机物,但缺少活化剂的帮助,降解率缓慢升高,且在初始pH值为3.0时的酸性条件较未调节pH值的碱性条件变化更为缓慢。
因此,考虑到两种自由基氧化体系氧化剂用量和CODCr降解率及色度去除率的影响关系,选取Fenton氧化体系中H2O2用量为640 mg/L,PS氧化体系中PS的用量为S2O2-8∶12CODCr=2进行对比实验。
2.4 降解过程变化规律
图4分别考察了在180 min内未调节pH值的弱碱性条件和初始pH值为3.0时的酸性条件下·OH和SO-
4·两种不同自由基体系氧化降解造纸废水的CODCr降解率和色度去除率随时间的变化状况。
从图4(a)可以看出,两种氧化体系CODCr降解率均随时间的增加而增加。Fenton氧化和PS氧化均在前3~5 min反应速率很快,之后趋于缓慢。在调节初始pH值为3.0的酸性条件下,Fenton氧化在5~40 min时的CODCr降解率甚至超过了PS氧化的CODCr降解率,但在40 min后Fenton氧化几乎变化不大,而PS氧化仍在继续增加,在反应终止时间时呈现出大于Fenton氧化的CODCr降解率。在未调节pH值的弱碱性条件下,Fenton氧化的效果几乎为0,而PS氧化呈现出优于Fenton氧化的CODCr降解率。

图3 氧化剂用量对不同氧化体系CODCr降解率和色度去除率的影响
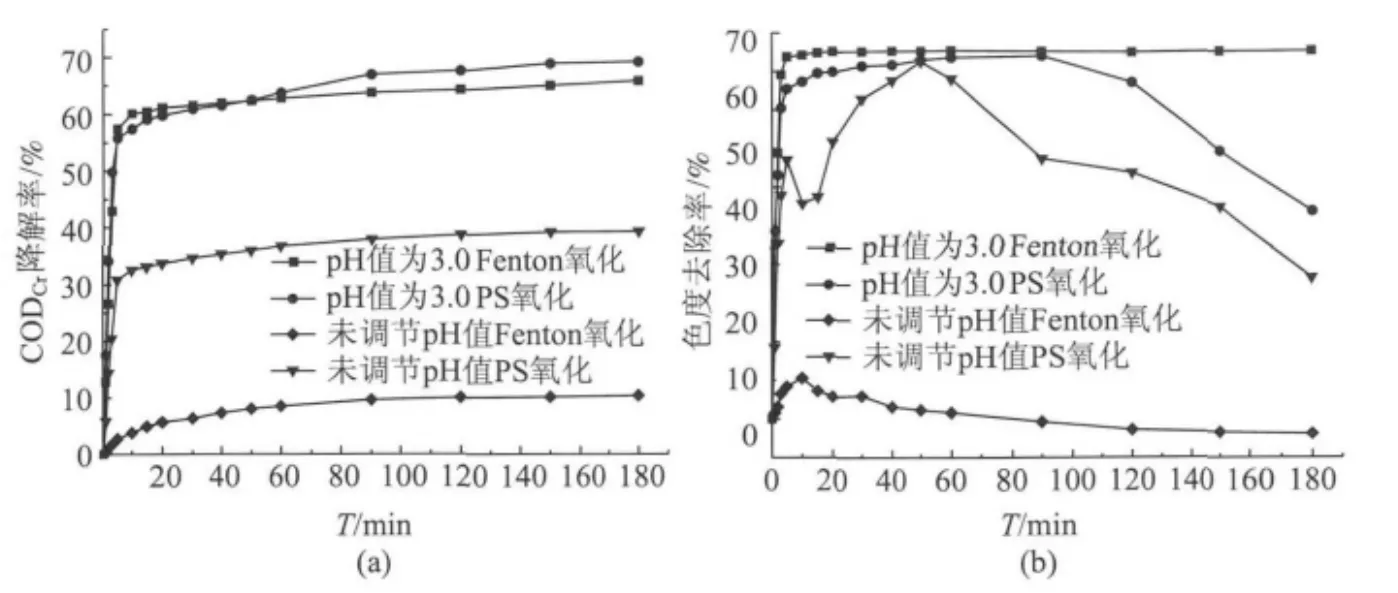
图4 不同氧化体系CODCr降解率和色度去除率随时间变化状况
从图4(b)可以看出,在未调节pH值的弱碱性条件下和调节初始 pH值为3.0的酸性条件下,Fenton氧化的色度去除率均在10 min时达到最大,之后趋于平缓或下降。而PS氧化的色度去除率分别在50 min和90 min时达到顶峰然后逐渐减少。这可能都是由于Fe2+被部分氧化剂或者空气中的氧气氧化成为Fe3+呈现出黄色,导致色度增加。
2.5 降解过程动力学
利用Origin 8.5对两种不同自由基氧化过程随时间变化规律做多次拟合,得到图5所示的降解过程动力学模式。
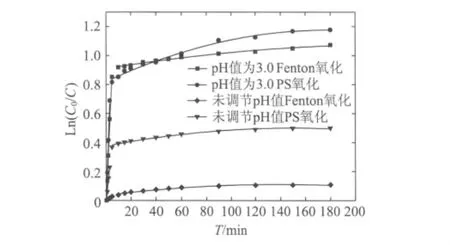
图5 不同氧化体系CODCr降解动力学模式
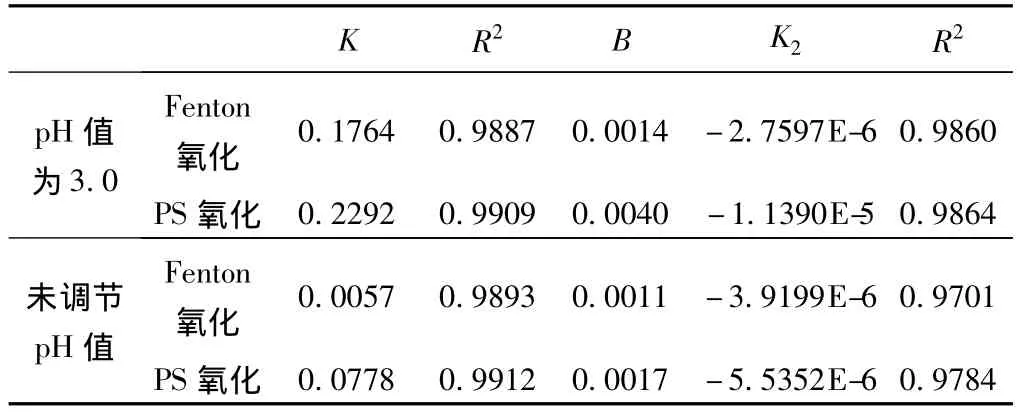
表2 不同氧化体系动力学速率常数
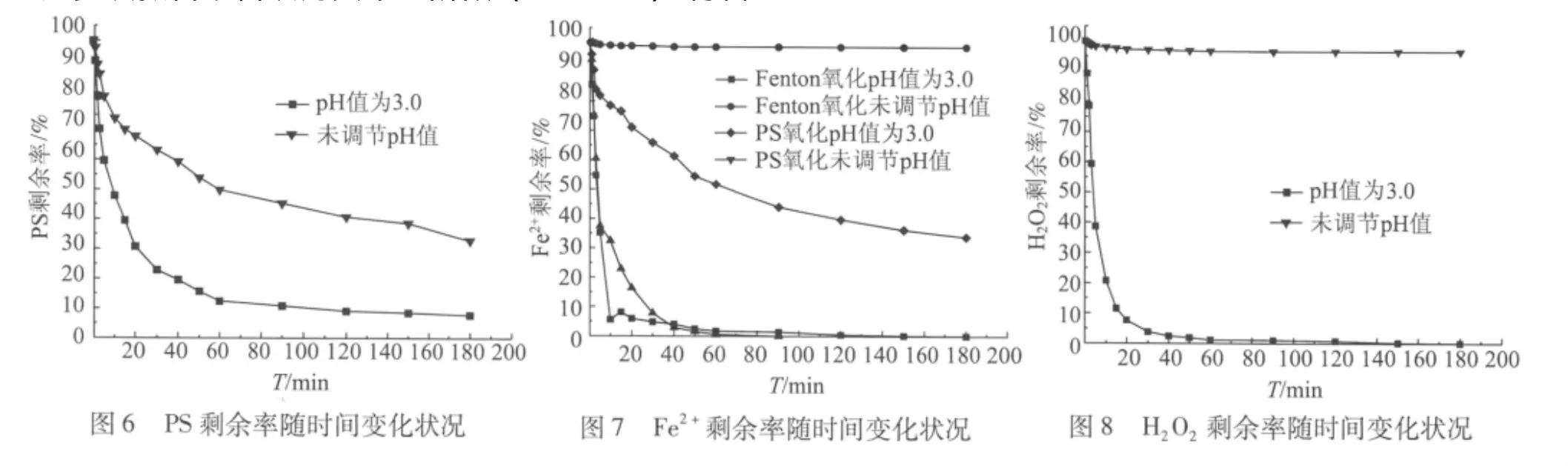
由前期实验得知,PS氧化降解造纸废水CODCr的前3 min符合一级动力学反应模式y=B+K1x,而第二阶段经过对数据的多次拟合,皆认为其符合二级动力学方程y=C1+B1x+B1’x2。由图5可以看出,在反应的第一阶段,反应速率很大,仅在3 min时,未调节pH值和初始pH值为3.0的条件下CODCr降解率就分别达到了20.4%和49.8%。在反应的第二阶段,由于第一阶段S2的大量消耗,使得第二阶段SO4-·的量急剧减少 (如图6所示),加之Fe2+的持续消耗(如图7所示),导致反应趋于平缓,反应速率骤减。
Fenton氧化降解造纸废水CODCr随时间变化规律经过多次拟合,皆认为其第一阶段 (0~5 min)符合一级动力学方程y=B+K2x,而第二阶段 (10~180 min)符合二级动力学方程y=C2+B2x+B2’x2。由图5可以看出,反应的第一阶段,在初始pH值为3.0的酸性条件下,反应速率很大,在5 min时CODCr的降解率就达到了57.4%;在反应的第二阶段,由于第一阶段氧化剂和催化剂的大量消耗 (如图7和图8所示),导致反应变化相对PS氧化更为微弱,反应速率迅速下降。而在未调节pH值的弱碱性条件下,第一阶段和第二阶段反应速率皆较小。
两种自由基的氧化理论也都可认为与Bassmann的高价铁理论[24]相似。Bossmann指出:Fenton试剂氧化反应·OH反应机理为二级动力学反应,而高价铁Fe(VI)反应机理为一级动力学反应。
在初始pH值为3.0时,Fenton氧化体系和PS氧化体系的第一阶段反应速率常数K1分别是第二阶段反应速率常数B1的57.3倍和126倍;而在未调节pH值时,Fenton氧化体系和PS氧化体系的第一阶段反应速率常数K2分别是第二阶段反应速率常数B2的45.8 倍和5.2 倍。
3 结论
3.1 Fenton氧化反应在强酸性条件下能有效降解造纸废水中有机污染物,pH值上升降解效率迅速下降。PS氧化反应在酸性至中性、甚至弱碱性条件下均能有效降解造纸废水中有机污染物,初始pH值对CODCr降解率及色度去除率的影响如下:pH值3.0≥pH值7.0>pH值8.1>pH值10.0。pH值范围的增大在高级氧化技术实际工程应用方面具有重要的意义。
3.2 在室温条件下,适量的催化 (活化)剂用量可有效地催化 (活化)氧化剂并产生氧化性更强的自由基,从而氧化降解难降解有机污染物。相同Fe2+用量的两种氧化体系可以产生相当的处理效果,且两种氧化体系中Fe2+用量对Fenton氧化反应影响更为敏感。
3.3 室温下,两种氧化体系的CODCr降解率和色度
去除率随氧化剂用量的增加而增加,但达到适宜用量后Fenton氧化的CODCr降解率和色度去除率呈现下降趋势,而PS氧化的CODCr降解率和色度去除率开始趋于平缓。
3.4 两种氧化体系的CODCr降解率和色度去除率随时间变化规律及动力学模式表明,这两种氧化体系氧化降解造纸废水二级出水都是分两段进行的。PS氧化体系第一阶段 (前3 min)是快速反应阶段,符合一级动力学过程;第二阶段 (5 min后)是二级动力学过程,此阶段反应趋于缓慢。而Fenton氧化体系第一阶段 (0~5 min)反应相当迅速,此阶段符合一级动力学过程;第二阶段 (10 min后)是二级动力学过程,此阶段反应几乎为0。因此,PS氧化反应较Fenton氧化反应相对缓慢些,且整个过程呈缓慢上升趋势,更利于氧化剂的完全利用。
[1]CHEN Zhi-qiang.The Practice of Paper Industrial Wastewater Treatment with Anaerobic and Aerobic Technology[J].China Pulp & Paper,2003,22(7):27.
陈志强.采用厌氧-好氧技术处理制浆造纸废水[J].中国造纸,2003,22(7):27.
[2]Chen Yuancai,Zhan Huaiyu,Chen Zhonghao,et al.Study on the treatment of the sulfate pulp CEH bleaching effluents with the coagulation-anaerobic acidifcation-aeration package reactor[J].Water Research,2003,37:2106.
[3]Martin Fox,Tatsuya Noike.Wet oxidation pretreatment for the increase in anaerobic biodegradability of newspaper waste[J].Bioresource Technology,2004,91:273.
[4]Barb W G,Baxendale J H,Philip George,et al.Reaction of ferrous and ferric ions with hydrogen peroxide[J].Nature,1949,163(4148):692.
[5]Lunar L,Sicilia D,Rubio S,et al.Identification of metal degradation products under Fenton reagent treatment using liquid chromatography mass spectrometer[J].Water Res.,2000,34(13):3400.
[6]Durán A,Monteagudo J M,Amores E.Solar photo-Fenton degradation of reactive blue 4 in a CPC reactor[J].Applied Catalysis B:Environmental,2008,80(1/2):42.
[7]Perez M,Torrades F,Garcia-hortal J A,et al.Removal of organic contaminants in paper pulp treatment effluents under Fenton and photo-Fenton conditions[J]. Applied Catalysis B:Environmental,2002,36(1):63.
[8]徐美娟,王启山,刘善培,等.Fenton和光-Fenton反应处理二次纤维制浆废水的研究[J].中国造纸学报,2006,21(4):34.
[9]Xu Meijuan,Wang Qishan,Hao Yueli.Removal of organic carbon from wastepaper pulp effluent by lab-scale solar photo-Fenten process[J].Journal of Hazardous Materials,2007,148(1/2):103.
[10]Kolthoff I M,Medalia A I,Raaen HP.The reaction between ferrous iron and peroxides.IV.Reaction with potassium persulfate[J].J.Am.Chem.Soc.,1951,73:1733.
[11]Huang K C,Zhao Z Q,Hoag G E,et al.Degradation of volatile organic compounds with thermally activated persulfate oxidation[J].Chemosphere,2005,61(4):551.
[12]Huang K C,Couttenye R A,Hoag G E.Kinetics of heat-assisted persulfate oxidation of methyl tert-butyl ether(MTBE)[J].Chemosphere,2002,49(4):413.
[13]Liang C J,Bruell C J.Thermally activated persulfate oxidation of trichloroethylene:Experimental investigation of reaction orders[J].Industrial& Engineering Chemistry Research,2008,47(9):2912.
[14]Waldemer R H,Tratnyek P G,Johnson R L,et al.Oxidation of chlorinated ethenes by heat-activated persulfate:Kinetics and products[J]. EnvironmentalScience & Technology, 2007, 41(3):1010.
[15]Yang S Y,Wang P,Yang X,et al.Degradation efficiencies of azo dye Acid Orange 7 by the interaction of heat,UV and anions with common oxidants:Persulfate,peroxymonosulfate and hydrogen peroxide[J].Journal of Hazardous Materials,2010,179(1/3):552.
[16]Gayathri P,Praveena Juliya Dorathi R,Palanivelu K.Sonochemical degradation of textile dyes in aqueous solution using sulphate radicals activated by immobilized cobalt ions[J].Ultrasonic Sonochemistry,2010,17(3):566.
[17]Yang Deng,Casey M E.Sulfate radical-advanced oxidation process(SR-AOP)for simultaneous removal of refractory organic contaminants and ammonia in landfill leachate[J].Water Research,2011,45:6189.
[18]LI Hai-ming,HE Bei-hai,CHEN Yuan-cai,et al.The Chromaticity Measurement Methods Used for Wastewater from the Pulp and Paper Industry[J].China Pulp & Paper,2006,25(7):23.
李海明,何北海,陈元彩,等.制浆造纸工业废水色度的检测方法及其应用研究[J].中国造纸,2006,25(7):23.
[19]Liang C J,Huang C F,Monhanty N,et al.A rapid Spectrophotometric determination of persulfate anion in ISCO[J].Chemosphere,2008,73(9):1540.
[20]Guan Yinghong,Ma Jun,Li Xuchun,et al.Influence of pH on the Formation of Sulfate and Hydroxyl Radicals in the UV/Peroxymonosulfate System[J].Environ.Sci.Technol.,2011,45:9308.
[21]GUO Xin,MA Yong-wen,WAN Jin-quan,et al.Advanced Treatment of Papermaking Wastewater by Sulfate Radical based Advanced Oxidation Process[J].China Pulp & Paper,2012,31(9):32.
郭 鑫,马邕文,万金泉,等.基于硫酸根自由基的高级氧化方法深度处理造纸废水的研究[J].中国造纸,2012,31(9):32.
[22]Chamarro E,Marcoa,Esplugass.Use of Fenton reagent to improve organic chemical biodegradability[J].Water Research,2001,35(4):1047.
[23]Lee Y C,Lo S L,Chiueh P T,et al.Microwave-hydrothermal decomposition of perfluorooctanoic acid in water by iron-activated persulfate oxidation[J].Water Research,2010,44(3):886.
[24]Bossmann Stefan H,Oliver Esther,et al.New Evidence against Hydroxyl Radicals as Reactive Intermediates in the Thermal and Photochemically Enhanced Fenton Reactions[J].J.AM.Chem.Soc.,1998,102:5542. CPP

