大孔吸附树脂纯化玉竹总黄酮工艺研究
钟方丽 王晓林 王志敏 陈 帅
(吉林化工学院化学与制药工程学院,吉林 吉林 132022)
玉竹又名葳蕤、萎蕤、女萎,是黄精属植物玉竹(Rhizoma Polygonati Odorati.)的地下根茎,在《神农本草经》、《本草正义》中均有记载,该药在中国已有几千年的用药历史,性平,味甘,具有养阴润燥、生津止渴的功能,用于热病口燥咽干、干咳少痰、心烦心悸、糖尿病等疾病的治疗[1,2]。药理学研究[3]表明,玉竹还有强心、扩张血管、降血压、抗肿瘤和增强免疫功能等作用。经研究[4]发现,玉竹中含量较高的是多糖类化合物,一般含量为6.51%~10.27%,此外,还有甾体皂苷、黄酮、生物碱、甾醇、强心苷等活性成分,具有较高的食用与药用开发价值。玉竹中所含的黄酮及黄酮苷又称黄碱素类化合物,是存在于植物界的一类天然色素,为许多中草药的有效成分[5],玉竹总黄酮能清除二苯基苦味肼基自由基(DPPH),能增强衰老模型小鼠血液中SOD活性,降低肝组织中 MDA含量[6]。
大孔吸附树脂分离技术是利用大孔吸附树脂的多孔结构和选择性吸附功能从中药提取液中分离精制有效成分或有效部位的技术。D-101型大孔吸附树脂是一种非极性树脂,已广泛应用于天然植物(如桑叶、山楂、槐角、滁菊花)的黄酮类化合物的分离纯化[7],但未见有关玉竹总黄酮纯化工艺研究的报道。本试验拟使用6种不同型号的大孔吸附树脂分别对玉竹总黄酮进行纯化,并优化D-101型大孔吸附树脂纯化玉竹总黄酮的工艺条件,旨在为生产中更有效利用玉竹、发挥其最大经济效益提供试验依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
玉竹:中药饮片,安徽省亳州市华申药业有限公司;
芦丁对照品:中国药品生物制品检定所;
大孔吸附树脂:LSA-21、LSA-10、AB-8、LX-36、D-101、LSA-33型,西安蓝晓科技有限公司;
硝酸铝、氢氧化钠、亚硝酸钠、无水乙醇:分析纯,天津市大茂化学试剂厂。
1.1.2 主要仪器设备
紫外-可见分光光度计:752N型,上海精密科学仪器有限公司;
旋转蒸发仪:RE-52AA型,上海亚荣生化仪器厂;
循环水真空泵:SHZ-D型,河南省巩义市英峪仪器一厂;
电热鼓风干燥箱:CS101-AB型,中国重庆实验设备厂;
电子天平:JY2002型,上海精密科学仪器有限公司。
1.2 方法
1.2.1 总黄酮含量测定方法
(1)标准曲线的制备:精密称取芦丁对照品(于105℃干燥至恒重)10.0mg,置于50mL容量瓶中,加入50%乙醇溶液,超声使之溶解,并用50%乙醇溶液定容至刻度,制得芦丁对照品溶液(0.20mg/mL)。精密吸取上述芦丁对照品溶液0,2.0,4.0,6.0,8.0,10.0,12.0mL分别 置于50mL 容量瓶中,加入5%NaNO2溶液0.4mL,摇匀,放置6min,加入10%Al(NO3)3溶液0.4mL,摇匀,放置6min,加入4%NaOH溶液4.0mL,加入50%乙醇溶液定容至刻度,摇匀,放置15min。以50%乙醇溶液为空白对照,按照紫外分光光度法于512nm波长处测定不同浓度芦丁对照品溶液的吸光度。以吸光度A为纵坐标,芦丁对照品溶液的浓度C为横坐标,进行直线回归,制备标准曲线[8],回归方程为A =0.010 72C+0.009 79,R =0.999 8,结果表明芦丁在0.0~48.0μg/mL浓度范围内呈良好的线性关系。
(2)样品含量测定:吸取相应的玉竹总黄酮样品液、树脂吸附后的溶液和解吸液各适量,分别置于容量瓶中,按1.2.1(1)的方法,于512nm处测定吸光度,以不加供试品的平行样为空白。根据标准曲线计算样品中总黄酮的含量。
1.2.2 大孔吸附树脂的预处理 取6种树脂LSA-21、LSA-10、AB-8、LX-36、D-101、LSA-33各10g加入柱中,先以95%乙醇连续洗涤数次约2h,至流出液加水(1∶5)不浑浊为止,后用蒸馏水洗至无醇味;然后用5%HCl浸泡4h后以4~6BV/h洗涤2h后用蒸馏水洗至中性;最后用2%NaOH溶液浸泡6h后以4~6BV/h洗涤2h后用蒸馏水洗至中性,处理完毕后置于密闭容器中备用[9]。
1.2.3 玉竹总黄酮样品液的制备 称取干燥的玉竹120g于圆底烧瓶中,加入960mL 80%的乙醇热回流3次,每次2h,过滤,合并以上3次的滤液,浓缩,80%乙醇定容于容量瓶中作为玉竹总黄酮样品液,待用。
1.2.4 大孔吸附树脂的选择 各取2g 6种处理后的树脂至100mL具塞三角瓶中,再加入0.635 9mg/mL的玉竹总黄酮样品液40mL[10],间隔10min振摇1次,每次约30s,共2h,静止48h,分别精密吸取6种树脂吸附后的溶液1.0mL,按1.2.1(1)的方法,于512nm处测定吸光度A,将静态吸附的树脂抽滤至干,然后将上述树脂加入到具塞三角瓶中,于室温条件下加入100mL 95%乙醇进行解吸,间隔10min振摇1次,每次约30s,共2h,静置48h,分别精密吸取各解吸液5.0mL,按1.2.1(1)的方法,于512nm 处测定吸光度A,从而计算各种树脂对玉竹总黄酮的吸附率和解吸率。计算公式见式(1)~ (3)[11]:
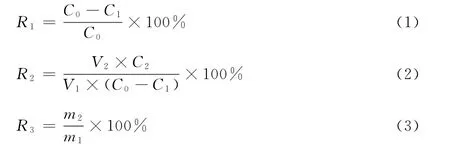
式中:
R1—— 吸附率,%;
R2—— 解吸率,%;
R3—— 纯度,%;
C0——起始玉竹总黄酮样品液中总黄酮的浓度,mg/mL;
C1——吸附48h后玉竹总黄酮样品液中总黄酮的浓度,mg/mL;
C2——解吸液中玉竹总黄酮的浓度,mg/mL;
V1—— 玉竹总黄酮样品液的体积,mL;
V2—— 解吸液的体积,mL;
m1——解吸液干燥后干浸膏的质量,mg;
m2—— 解吸液中总黄酮的质量,mg。
1.2.5 静态吸附和解吸的单因素试验
(1)吸附时间的确定:称取D-101型大孔树脂2g,共称取7份,置于6个干燥的100mL三角瓶中,各加入20mL 0.356 5mg/mL的玉竹总黄酮样品液,分别振荡吸附1,2,3,4,5,6,7h,每10min振摇1次,每次振摇30s,过滤,各取吸附后液4.0mL于7个10mL容量瓶中,测定溶液中总黄酮的含量,计算吸附率。
(2)解吸液乙醇浓度的确定:称取D-101型大孔树脂2g,共称取5份,置于5个干燥的100mL三角瓶中,各加入20mL供试品溶液,振荡吸附3h,每10min振摇1次,每次振摇30s。吸附结束后用蒸馏水洗涤并用吸水纸吸干残留于树脂上的液体,然后向装有树脂的三角瓶中分别加50mL 10%,30%,50%,70%,90%的乙醇,振摇解吸,过滤,过滤后的解吸液各取4.0mL于5个10mL容量瓶中,测定溶液中总黄酮的含量,计算解吸率。
(3)解吸液乙醇用量的确定:称取D-101型大孔树脂2g,共称取7份,置于7个干燥的100mL三角瓶中,各加入20mL供试品溶液,振荡吸附3h,每10min振摇1次,每次振摇30s。然后向装有树脂的三角瓶中分别加入20,30,40,50,60,70,80mL的90%乙醇,振摇解吸,过滤,过滤后的解吸液分别移取4.0mL于7个25mL容量瓶中,测定溶液中总黄酮的含量,计算解吸率。
(4)解吸时间的确定:称取D-101型大孔树脂2g,共称取7份,置于7个干燥的100mL三角瓶中,各加入20mL供试品溶液,振荡吸附3h,每10min振摇1次,每次振摇30s。吸附结束后用蒸馏水洗涤并用吸水纸吸干残留于树脂上的液体,然后向装有树脂的三角瓶中分别加入70mL 90%的乙醇,分别振摇解吸1.0,1.5,2.0,2.5,3.0,3.5,4.0h,过滤后的解吸液各移取4.0mL于7个10mL容量瓶中,测定溶液中总黄酮的含量,计算解吸率。
(5)吸附液pH的确定:称取D-101型大孔树脂2g,共6份,置于6个干燥的100mL三角瓶中,各加入20mL 0.356 5mg/mL的玉竹总黄酮样品液,分别用5%HCl和5%NaOH调pH 为4,5,6,7,8,9,然后振荡吸附3h,每10min振摇1次,每次振摇30s,过滤,过滤后的吸附后液,各取4mL于6个10mL容量瓶中,测定溶液中总黄酮的含量,计算不同吸附pH的吸附率。
1.2.6 静态吸附和解吸的正交试验 在单因素试验基础上,以解吸率为考察指标,选择主要考察因素进行正交试验以进一步优化工艺。在所有试验中,每次试验取用的大孔树脂为2g。
2 结果与分析
2.1 大孔吸附树脂的选择结果
在相同的试验条件下,6种不同型号的大孔吸附树脂经过静态吸附与解吸附试验,分别得到各种树脂对玉竹总黄酮的静态吸附率及解吸率,结果见表1。
由表1可知,LSA-33型树脂的吸附率最高,LX-36型树脂的吸附率最低,但6种树脂的吸附率差别较小;从解吸率角度看,D-101型树脂的解吸率最高,达到了40.50%,而LSA-33和LSA-10型树脂的解吸率只有20%左右,试验结果表明D-101型大孔树脂对玉竹总黄酮的解吸率最高。故选用D-101型大孔树脂作为进一步试验所用的树脂型号。
2.2 静态吸附和解吸工艺的优化
根据单因素试验结果,确定了吸附液pH值、吸附时间、解吸液浓度、解吸液用量/树脂质量(V/m)及解吸时间的水平值,各因素的水平表设计见表2,正交试验结果见表3。
由表3可知,D-101型大孔树脂纯化玉竹总黄酮的最佳试验条件为A2B4C2D1E3,即最佳纯化工艺为吸附时间5h,解吸时间3.5h,解吸液用量/树脂质量25(V/m),解吸液乙醇浓度60%,最佳样品液pH值8,在该条件下,大孔树脂纯化玉竹总黄酮的静态解吸率最大。
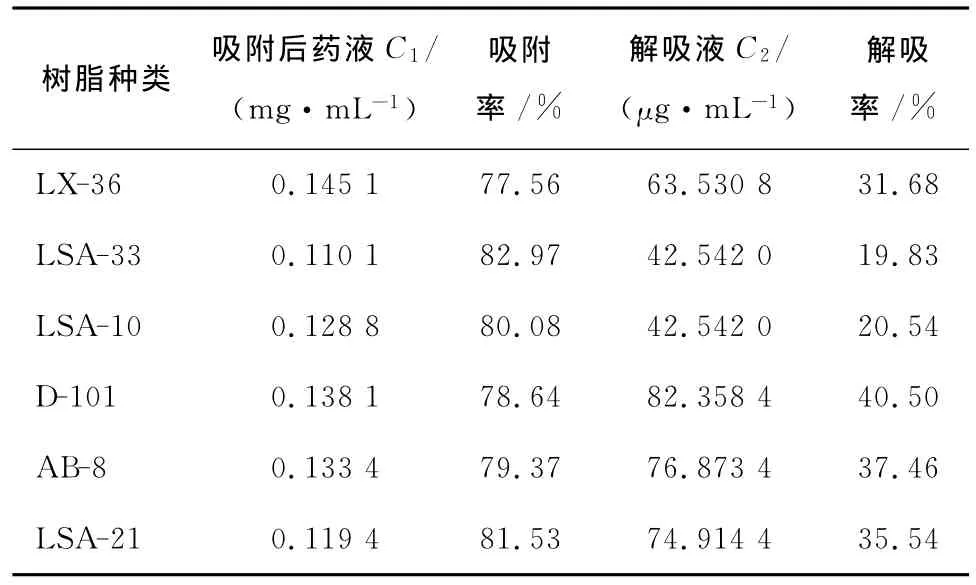
表1 6种大孔树脂对玉竹总黄酮的吸附率与解吸率的测定结果Table 1 Experimental result of adsorption and desorption rate of total flavonods with six types macroporous resins
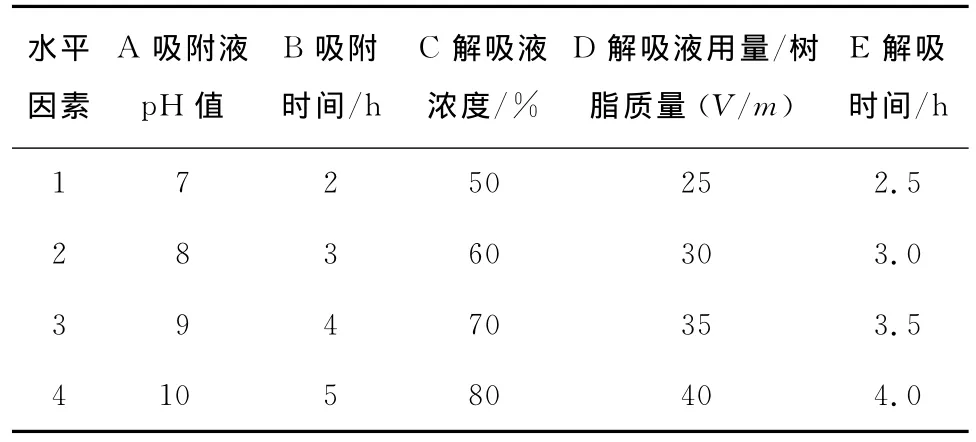
表2 因素水平表Table 2 Table of factors and levers
2.3 工艺验证性实验
为了考察上述优化工艺的稳定性,进行了3次验证性实验结果见表4。由表4可知,3次实验的吸附率和解吸率分别为 81.15%,80.25%,81.58% 和 48.29%,49.78%,48.17%,平均吸附率和解吸率分别为80.99%和48.75%,具有较好的重现性。
2.4 玉竹干浸膏的制备及浸膏中总黄酮含量的测定
称取D-101型大孔树脂6g,共3份,置于3个干燥的250mL三角瓶中,分别加入60mL玉竹样品液(总黄酮浓度为0.368 7mg/mL,其浸膏中总黄酮含量为 4.075mg/g),振荡吸附5h,每10min振摇1次,每次振摇30s,然后向带有树脂的3个三角瓶中各加入60%的乙醇溶液150mL,振荡解吸3.5h,过滤,各取4.0mL过滤后的解吸液于3个具塞试管中,按1.2.1项下方法测定溶液中总黄酮的含量。再取50mL总黄酮浓度为0.368 7mg/mL的玉竹样品液和100mL解吸液置于称重后的蒸发皿中水浴浓缩至干,然后放入电热鼓风干燥箱中(60℃)干燥至恒重,称重,计算干浸膏及其总黄酮的含量。结果见表4。
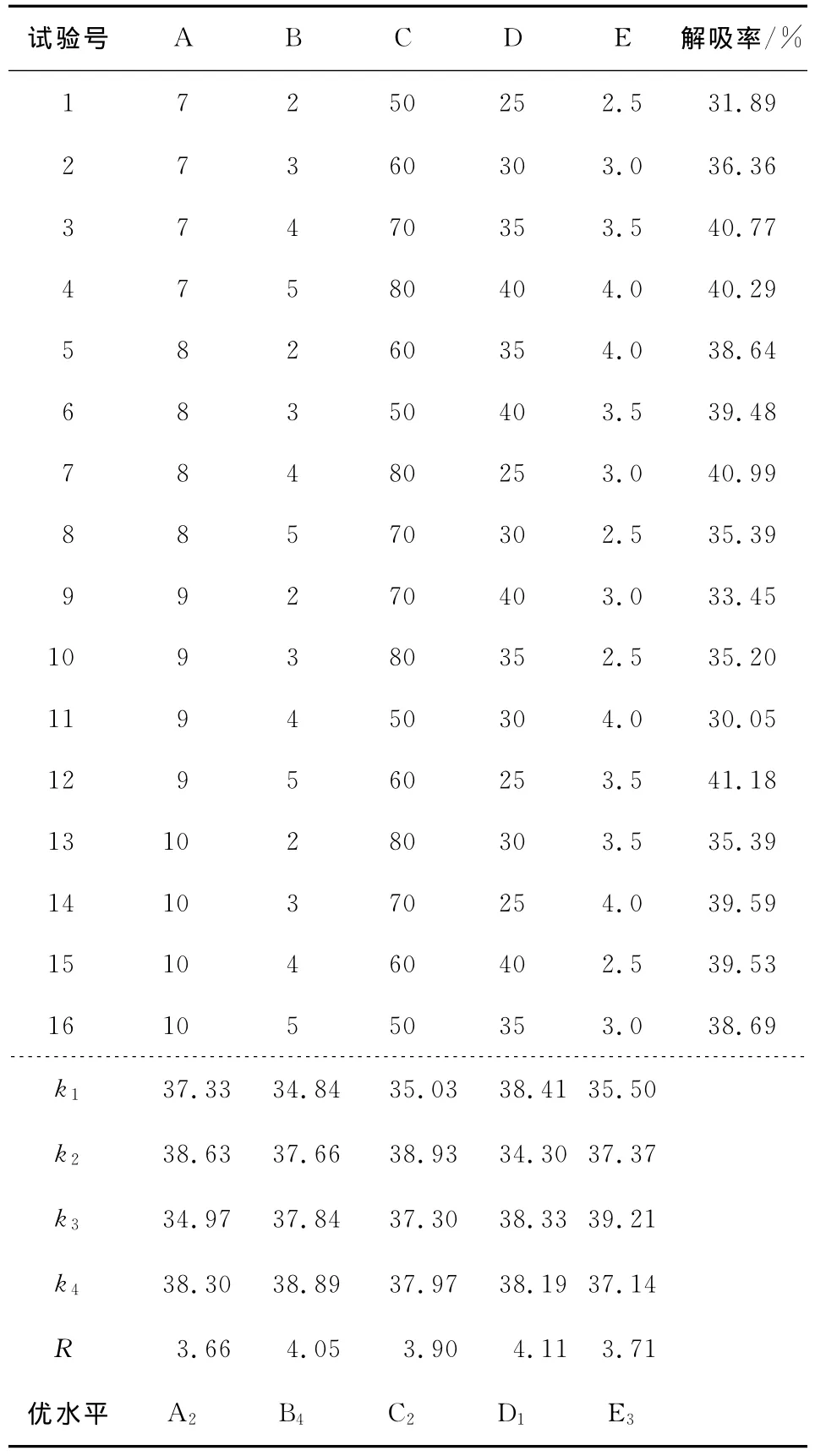
表3 正交试验结果Table 3 Experimental results of orthogonal test
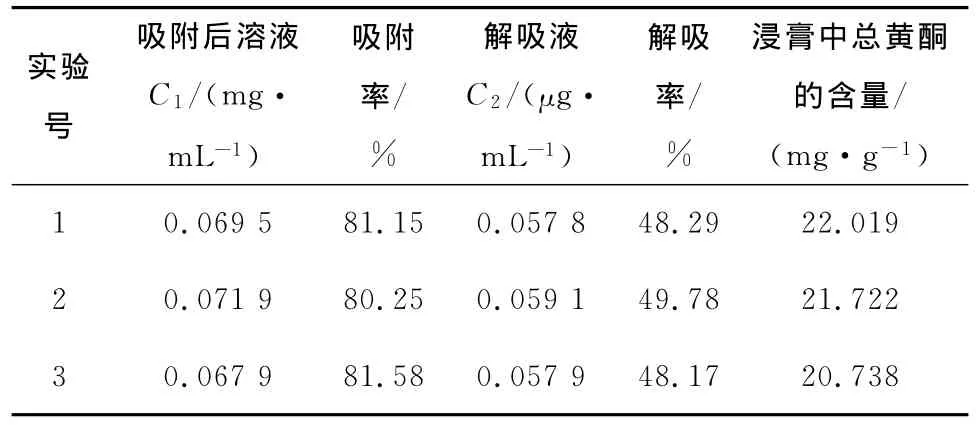
表4 验证实验结果Table 4 Experimental results of purification process validation of total flavonods in Rhizoma Polygonati Odorati.with D-101 macroporous resins
由表4可知,经D-101型大孔吸附树脂处理玉竹提取液后,干膏中总黄酮含量由大约4mg/g提高到21mg/g左右。
3 结论
采用D-101型大孔树脂可以对玉竹总黄酮进行初步纯化,但由于玉竹所含化学成分复杂,除了少量的黄酮类化合物外,还含有大量的植物多糖及甾体皂苷、生物碱、甾醇、鞣质、黏液质和强心苷等多类成分,所以纯化后玉竹干浸膏中的总黄酮纯度较低,这主要是由于玉竹中黄酮类化合物含量太低所造成的。若要使玉竹提取物中总黄酮的纯度进一步提高,则需要采用必要的方法提高玉竹总黄酮样品液的含量,然后再采用D-101型大孔吸附树脂对其进行分离纯化,上述试验结果为玉竹提取物的工业化生产提供了理论依据。
1 刘塔斯,杨先国,龚力民,等.药食两用中药玉竹的研究进展[J].中南药学,2008,6(2):216~219.
2 梁海霞,李焕德.玉竹的药理活性研究进展[J].中南药学,2008,6(3):342~344.
3 李尘远,潘兴瑜,张明策,等.玉竹提取物B抗肿瘤机制的初步研究[J].中国免疫学杂志,2003,19(4):253~254.
4 周晔,唐铖,高翔,等.中药玉竹的研究进展[J].天津医科大学学报,2005,11(2):328~330
5 彭秧锡,陈启元,钟世安,等.分光光度法测定玉竹中黄酮类化合物的含量[J].华西药学杂志,2006,1(6):604~605.
6 陈地灵,徐大量,林辉.玉竹总黄酮体内外抗氧化作用的实验研究[J].今日药学,2008,18(6):13~14.
7 高伟城,蓝晓庆,潘馨.大孔吸附树脂在分离纯化总黄酮化合物中的应用[J].海峡药学,2009,21(7):26~27.
8 阿布力克木·阿布力孜,阿布力米提·阿布都卡德尔,迪丽努尔·塔力甫.新疆野生苍耳叶中总黄酮的超声波提取工艺研究[J].食品科学,2009,30(16):131~134.
9 白夺龙,杨开华.大孔吸附树脂分离纯化技术及应用[J].海峡药学,2007,19(9):96~99.
10 唐巧玉,周毅,阎婷.HPD300大孔树脂纯化金橘皮黄酮类化合物的工艺研究[J].食品科学,2008,29(8):355~358.
11 陈顺,关延彬.大孔树脂吸附骨碎补总黄酮特性的研究[J].中国中药杂志,2007,32(8):750~753.

