分段调控优化阿维拉霉素生产菌罐上发酵参数
潜媛媛 陈 敏 王 宏
(1.浙江工商大学食品与生物工程学院,浙江 杭州 310012;2.浙江凯胜生物药业有限公司,浙江 兰溪 321100)
阿维拉霉素又名卑霉素、阿美拉霉素、肥拉霉素[1],既是一种抗生素又是一种新型的消化促进剂和代谢调节剂[2],主要抑制革兰氏阳性菌,对革兰氏阴性菌效果较差[3]。阿维拉霉素作为饲料添加剂,具有结构独特、安全性高、毒性小、低残留等优点,广泛应用在禽畜饲料中。目前阿维拉霉素仅由美国礼来公司生产,并且受专利保护。国内外对阿维拉霉素罐上发酵的研究较少,多数通过优化摇瓶发酵工艺以提高阿维拉霉素产量[4-6],且鲜少有对阿维拉霉素的罐上发酵过程进行分段调控的研究。
阿维拉霉素是绿色产色链霉菌(Streptomyces viridoehrongenes)的次级代谢产物,一般在菌体生长的对数期后期或稳定期合成。本试验拟以阿维拉霉素生产菌Streptomyces viridoehrongenes N-0104菌株为研究对象,通过分段调控并结合正交试验对其罐上发酵过程中的温度、pH等参数进行优化,旨在提高该菌株罐上发酵合成阿维拉霉素的产量。
1 材料与方法
1.1 材料
1.1.1 菌种
绿色产色链霉菌 (Streptomyces viridoehrongenes)N-0104:浙江凯胜生物药业有限公司;
藤黄微球菌 (Microccus luteus)10209:中国工业微生物菌种保藏中心。
1.1.2 主要仪器与设备
全温振荡培养箱:HZ-F160型,太仓市实验设备厂;
发酵罐:BIOTECH-2002型,上海保兴生物设备工程有限公司;
立式压力蒸汽灭菌锅:YXQ-LS-75Ⅱ型,上海博讯实业有限公司医疗设备厂;
可见分光光度计:JH721型,上海菁华科技仪器有限公司;生化培养箱:SHP-250型,上海森信实验仪器有限公司;多功能微生物自动测量分析仪:ZY-300IV型,北京先驱威锋科技开发公司;
pH计:DELTA 320型,梅特勒-托利多仪器(上海)有限公司。
1.1.3 培养基及主要试剂
活化 培 养 基 (g/L):可 溶 性 淀 粉 20.0,KNO31.0,K2HPO40.5,MgSO4·7H2O 0.5,NaCl 0.5,FeSO4·7H2O 0.01,琼脂20.0,pH 7.2~7.4。
种子培养基(%,质量分数):黄豆饼粉1.5,酵母粉0.25,葡萄糖0.5,糊精2.0,氯化钙1.8,碳酸钙0.1,pH 6.4~6.7。
发酵培养基(%,质量分数):葡萄糖1.8,黄豆饼粉1.3,精制豆油1.0,氯化钙1.8,碳酸钙0.5,氯化钠0.1,硝酸钠0.45,氯化锰0.005,七水硫酸亚铁0.005,硫酸镁0.005,硫酸锌0.005,硫酸铜0.001,硫酸钴0.001,硫酸铵0.2,玉米淀粉4.0,消泡剂0.03,pH 6.6~6.9。
检定培养基(g/L):牛肉膏3.0,蛋白胨10.0,NaCl 5.0,琼脂20.0,pH 7.0~7.2。
阿维拉霉素预混剂:10%(质量分数),美国礼来公司。
1.2 培养方法
1.2.1 种子培养 用接种铲取1cm×1cm的单菌落菌种块,接入装有100mL种子培养基的1 000mL锥形瓶中,28℃、200r/min条件下培养48h。
1.2.2 发酵培养
(1)摇瓶发酵培养:按10%(体积分数)的接种量取种子培养液,在无菌条件下接入装有50mL发酵培养基的250mL锥形瓶中,28℃、200r/min条件下培养一定时间,并在培养了24h时补加0.1%(质量分数)的L-缬氨酸。
(2)罐上发酵培养:按10%(体积分数)的接种量在装有7L发酵培养基的10L发酵罐中接入种子培养液,在28℃,通气量1∶1,溶氧30%,罐压0.03~0.05MPa下培养一定时间,并在培养了24h时补加0.1%(质量分数)L-缬氨酸。
1.3 测定方法
1.3.1 pH的测定 取10mL培养一定时间的发酵液,摇匀后在pH计上直接读数。
1.3.2 菌体浓度的测定 根据文献[7]测定。

1.3.3 还原糖和总糖的测定 采用 DNS法[8]。
1.3.4 氨态氮的测定 采用甲醛滴定法[9]。
1.3.5 阿维拉霉素含量的测定 采用微生物检定法[10]。
1.4 罐上发酵条件优化试验
1.4.1 变温发酵条件优化 根据Streptomyces viridoehrongenes N-0104菌株摇瓶生长曲线确定菌种的摇瓶发酵生长期和阿维拉霉素合成期,设计菌株生长期温度和阿维拉霉素合成期温度的2因素3水平正交试验,通过摇瓶变温发酵确定最优组合。然后进行Streptomyces viridoehrongenes N-0104菌株罐上变温发酵验证,并对菌株罐上变温发酵与恒温发酵的阿维拉霉素产量进行比较。
1.4.2 罐上发酵pH调控 阿维拉霉素生产菌的菌体生长较适pH为7.0~7.2,所以培养基灭菌后pH调在7.1左右[7]。而由于碱性条件下有利于阿维拉霉素生产菌产素,所以在菌体后期阿维拉霉素合成期分别控制pH在7.5,8.0,8.5,进行比较选择 Streptomyces viridoehrongenes N-0104菌株后期阿维拉霉素合成的最适pH。
2 结果与分析
2.1 变温发酵条件优化
2.1.1 摇瓶发酵生长曲线 按1.2.2中摇瓶发酵培养方法进行Streptomyces viridoehrongenes N-0104菌株的摇瓶发酵。考察菌株摇瓶发酵过程各代谢参数的变化,结果见图1、2。
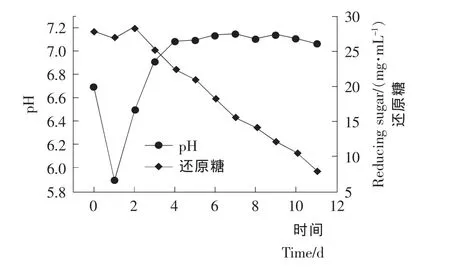
图1 摇瓶培养条件下培养基pH及还原糖变化曲线Figure 1 Time course of pH and reducing sugar of medium in 250mL-triangle flasks
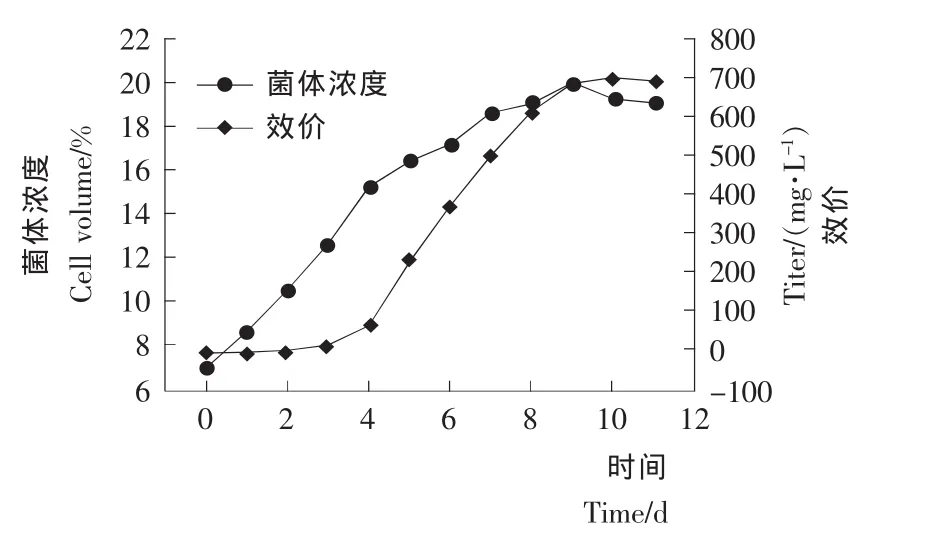
图2 摇瓶培养条件下菌体浓度及效价变化曲线Figure 2 Time course of cell volume and titer in 250mL-triangle flasks
由图2菌体浓度-时间曲线可知,摇瓶发酵前期菌体生长速度快,菌体浓度快速增加。随着发酵时间的增加,菌体浓度增加的速度变慢。当发酵进入后期时,由于培养基营养成分不足造成菌体自溶,菌体浓度下降。由效价-时间曲线可知,0~4d主要为菌体的生长期,阿维拉霉素合成很少。4d之后阿维拉霉素效价上升速度加快,阿维拉霉素不断积累。9d之后阿维拉霉素产量变化很小,其中10d时达到最大 值 700.14mg/L。 可 以 确 定 Streptomyces viridoehrongenes N-0104菌株的摇瓶发酵周期为10d,其中0~4d为菌体生长期,5~10d为菌体阿维拉霉素合成期。
2.1.2 摇瓶变温发酵试验 由文献[7]和[11]可知,阿维拉霉素生产菌的培养温度一般为28℃,故以28℃为中心点,设计Streptomyces viridoehrongenes N-0104菌株摇瓶变温发酵的2因素3水平正交试验。正交试验因素及水平见表1,正交试验结果分析见表2及表3。
由表2可知,因素A对于菌体浓度来说是主要因素,对于效价来说是次要因素,但是对于两个指标来说都是以A2为最佳水平,选取A2。因素B对于效价来说是主要因素,对于菌体浓度来说是次要因素,根据在确定某个因素的水平时首先应选择该因素作为主要因素的优水平的原则[12],选取B1。由表3可知,因素A与B对菌体浓度有影响,因素A与B对效价有高度显著的影响。最终变温发酵的条件为生长期温度28℃,阿维拉霉素合成期温度25℃,在该条件下摇瓶发酵阿维拉霉素的效价为820.83mg/L。

表1 正交试验因素及水平Table 1 Factors and levels of the orthogonal test/℃
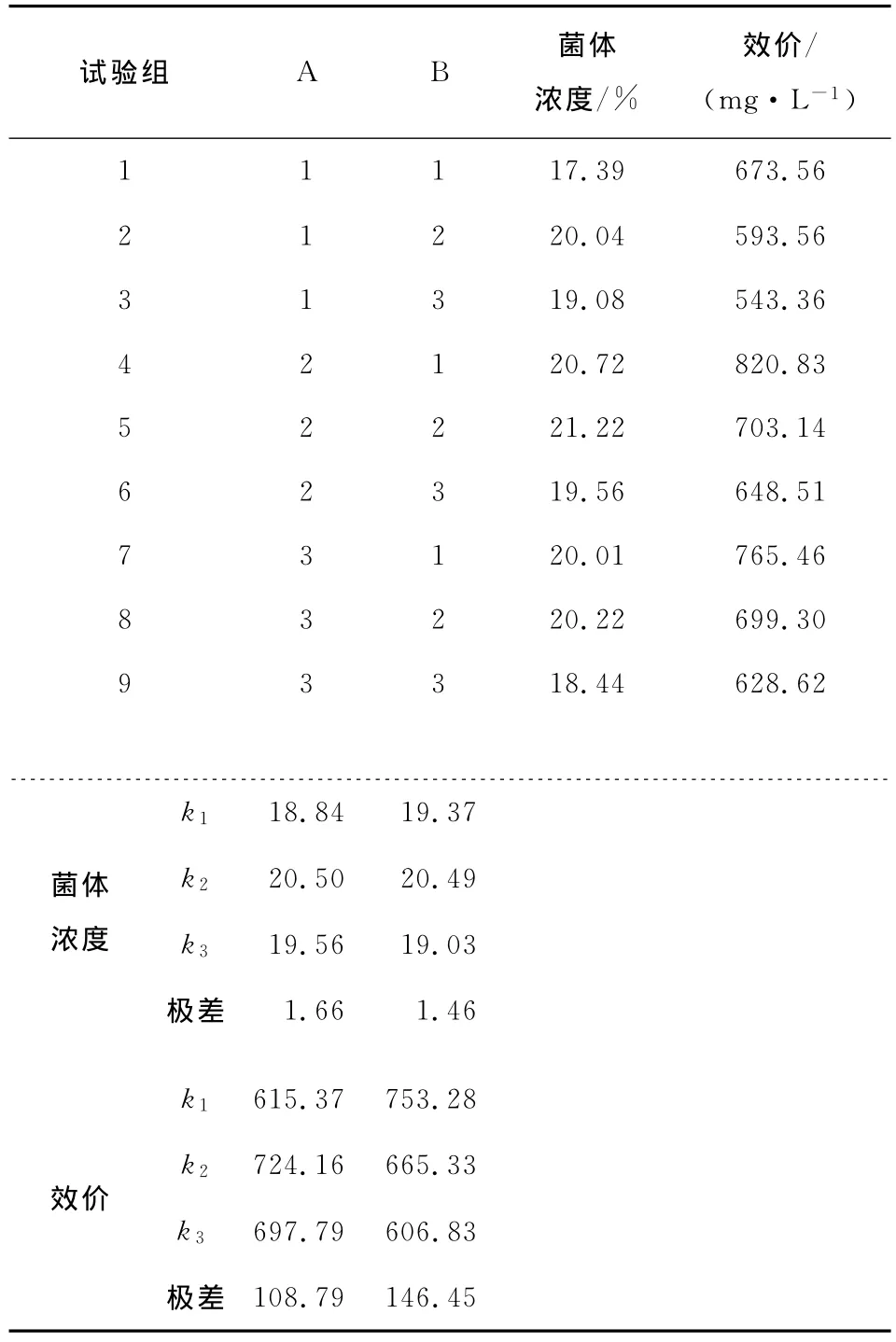
表2 变温发酵正交试验结果Table 2 Results of orthogonal test of changing temperature fermentation
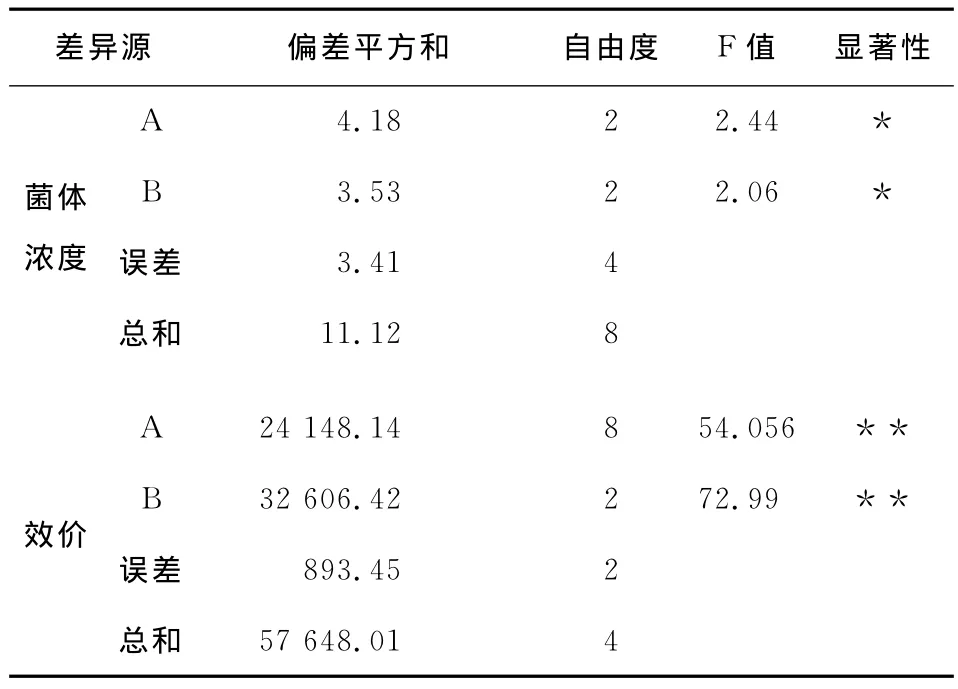
表3 变温发酵正交试验结果方差分析表†Table 3 Variance analysis of orthogonal test of changing temperature fermentation
2.1.3 罐上变温发酵验证 按1.2.2中的罐上发酵培养方法进行Streptomyces viridoehrongenes N-0104菌株的罐上变温发酵,其中发酵温度根据生长期28℃,阿维拉霉素合成期25℃进行分段调控。考察菌株罐上变温发酵过程各代谢参数的变化,结果见图3、4。
由图3pH-时间曲线可知,发酵前期,Streptomyces viridoehrongenes N-0104菌体生长,消耗培养基内的速效碳源,分解糖类等营养物质,产生酸、醇等小分子物质,使得发酵初期pH下降。随着发酵的进行,培养基中糖逐渐缺乏,pH开始上升。在2~4d,由于培养基中的氮源被分解利用后产生NH3,所以在糖代谢和氮代谢的综合作用下,pH迅速上升。之后菌丝体大量积累,代谢产物的合成速度加快,而由于碳酸钙的存在,pH的变化很小。
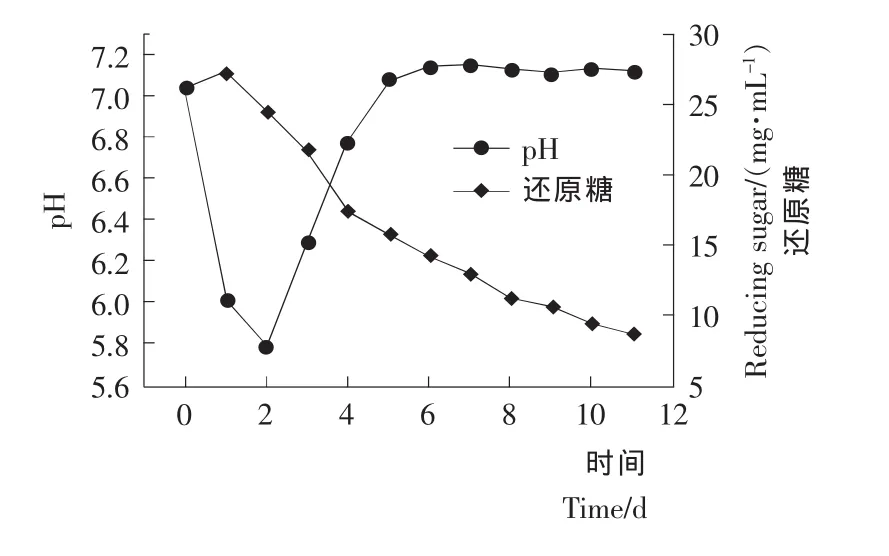
图3 罐上变温发酵培养基pH及还原糖变化曲线Figure 3 Time course of pH and reducing sugar in a 10Lfermenter
由还原糖-时间曲线可知,发酵初期由于菌体生长过程中会合成酶分解淀粉,使得发酵液中还原糖含量出现略有升高的现象。随着发酵时间的增加,发酵液中还原糖含量呈下降的趋势。发酵前期,发酵液中还原糖含量下降速度快。第4天之后,发酵液中还原糖含量接近15mg/mL。随着发酵过程进入后期,发酵液中还原糖含量下降的趋势变得缓慢,发酵结束时发酵液中还原糖的含量为8.79mg/mL。

图4 罐上变温发酵菌体浓度及效价变化曲线Figure 4 Time course of cell volume and titer in a 10Lfermenter
由图4菌体浓度-时间曲线可知,10L发酵罐罐上发酵过程中,菌体在发酵前期生长旺盛,菌体浓度增加速度快。发酵时间达到4d之后菌体浓度增加速度变慢,所以第4天之后发酵温度调至25℃。而发酵10d之后由于发酵罐中培养基营养成分不足,菌体开始自溶,菌体浓度也略有下降。
由效价-时间曲线可知,0~4d主要为菌体的生长期,只有很少量的阿维拉霉素合成。4d之后开始进入阿维拉霉素合成期,此时发酵温度为25℃,菌体合成阿维拉霉素速度快,阿维拉霉素不断积累。8d之后发酵液中阿维拉霉素产量增加缓慢。第10、11天时阿维拉霉素产量为960mg/L左右,并且变化很小,说明此时阿维拉霉素产量已达到最大值。因此 确 定 Streptomyces viridoehrongenes N-0104 菌 株 的10L发酵罐罐上变温发酵周期为10d,其中0~4d为菌体生长期,5~10d为菌体阿维拉霉素合成期。
2.1.4 罐上变温发酵与恒温发酵比较 将2.1.3中的Streptomyces viridoehrongenes N-0104菌株罐上变温发酵阿维拉霉素产量与菌株罐上恒温发酵结果进行比较,结果见图5。
由图5可知,当Streptomyces viridoehrongenes N-0104菌株进行罐上恒温发酵时,在第11、12天时阿维拉霉素产量变化已经很小,达到最大值735.27mg/L,可以确定菌株罐上恒温发酵的周期为11d。当菌株进行罐上变温发酵时,第10、11天时阿维拉霉素产量没有明显差异,达到最大值963.28mg/L,比恒温发酵的产量提高了31.01%,并且菌株罐上变温发酵的周期为10d。说明罐上变温发酵不仅能促进菌株合成阿维拉霉素,而且能缩短菌株的发酵周期。

图5 恒温发酵与变温发酵结果比较Figure 5 Comparison of variable temperature fermentation result and constant temperature fermentation result
2.2 罐上发酵pH调控
pH值的大小不仅会影响发酵过程中酶的活性,还会影响培养基中营养成分和中间代谢产物的解离程度,从而影响到菌体的生长和代谢产物的合成等。在Streptomyces viridoehrongenes N-0104菌株罐上变温发酵过程中,在控制培养基灭菌后pH为7.1左右的基础上,对菌体阿维拉霉素合成期的pH进行联动调控,并以不进行pH调控的发酵为对照组,结果见图6。
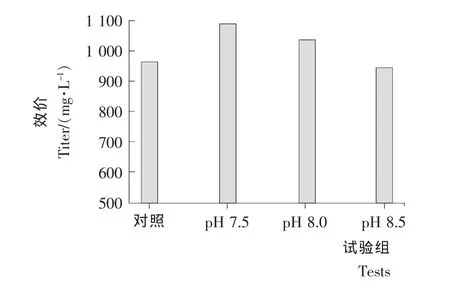
图6 pH对产阿维拉霉素的影响Figure 6 Influence of pH on avilamycin production
由图6可知,当调控合成期pH为7.5时,Streptomyces viridoehrongenes N-0104菌株产阿维拉霉素的产量最高,为1 087.40mg/L,比对照组的产量(963.28mg/L)提高了12.89%。虽然碱性条件有利于阿维拉霉素的合成,但是当调控阿维拉霉素合成期pH在8.0和8.5时,由于一定程度上影响到发酵过程中一些前体物质的合成及酶的活性,所以阿维拉霉素的产量相对降低。
3 结论与讨论
阿维拉霉素产生菌的发酵过程可以分为前期的生长期和后期的阿维拉霉素合成期,因此本试验通过分段调控,并结合正交试验对 Streptomyces viridoehrongenes N-0104菌株罐上发酵过程中的温度、pH等参数进行优化。经微生物检定法测定,采用优化后的罐上发酵条件所得的阿维拉霉素产量为1 087.40mg/L,较初始的产量(735.27mg/mL)提高了47.89%。说明阿维拉霉素产生菌罐上发酵分段调控能有效地提高阿维拉霉素的产量,这对阿维拉霉素的产业化具有很重要的意义。
1 陈永辉,刘波,曾兆国,等.阿维拉霉素的研究进展[J].饲料工业,2007,28(14):9~11.
2 Aarestrup F M,Seyfarth A M,Emborg H D,et al.Effect of abolishment of the use of antimicrobial agents for growth promotion on occurrence of antimicrobial resistance in fecal enterococci from food animals in Denmark[J].Antimicrob Agents Chemother,2001,45(7):2 054~2 059.
3 Weitnaucr G,Muhlenweg A,Trefzer A,et al.Biosynthesis of the orthosomycin antibiotic avilamycin A:deductions from the molecular analysis of the avi biosynthetic gene cluster of Strep tomyces viridochromogenes Tu57and production of new antibiotics[J].Chembiol,2001,8(6):569~581.
4 童应凯,靳亮,杨永涛,等.卑霉素摇瓶发酵工艺研究[J].西北农林科技大学学报,2006,34(10):32~36.
5 刘宁,王永星,张海龙,等.碳源对阿维拉霉素产量影响的研究[J].山东教育学院学报,2008(4):82~84.
6 靳亮,王泽立,童应凯,等.响应面法优化卑霉素发酵培养基的研究[J].生物技术通报,2007(2):155~162.
7 胡奇杰.阿维拉霉素生产菌推理选育及其发酵条件的初步研究[D].杭州:浙江工商大学,2007.
8 田芳年,马连荣.DNS法测定红枣总糖含量[J].化工技术与开发,2009(9):125~126.
9 刘国文.尿素复合肥中氨态氮的测定[J].广西化工,1992,21(4):32~34.
10 Formica G,Giannone C.Gas chromatographic determination of avilamycin total residues in pig tissues,fat,blood,feces and urine[J].Assoe Off Anal Chem.,1986,69(5):763~766.
11 张丹丹.阿维拉霉素产生菌的定向育种及机制研究[D].杭州:浙江工商大学,2011.
12 潘丽军,陈锦权,刘建学,等.试验设计与数据处理[M].第一版.南京:东南大学出版社,2008:117.

