多基质时厌氧氨氧化菌、异养反硝化污泥活性及抑制特征
李泽兵,刘常敬,赵白航,马家轩,王晓毅,李 军* (.北京工业大学北京市水质科学与水环境恢复工程重点实验室,北京 004;.河南省化工研究所有限责任公司,河南 郑州 5080)
近年来,短程反硝化技术有了较大的发展,以亚硝氮为底物的自养厌氧氨氧化[1-4]和异养反硝化[5-6]研究越来越多.相对于自养硝化菌,以硝氮和亚硝氮为底物的异养反硝化菌在污水处理构筑物中具有更好的种群多样性并且易于培养驯化,当然,对于不同的反硝化碳源,其反硝化优势菌群和活性也有一定的差异.而厌氧氨氧化过程不需要有机碳源,因此在处理低碳氮比污水中具有显著的优势.虽然自养厌氧氨氧化菌(AAOB)生长缓慢,但是在长期培养后就可获得极快的反应速率和在总菌量中占据较大的优势,大量研究表明,厌氧氨氧化颗粒污泥反应器或者生物膜反应器中都能实现较高的脱氮效率[1,7-9].
无论是前置厌氧氨氧化还是后置厌氧氨氧化,待处理水中有机物总是或多或少的存在,因此,厌氧氨氧化发展始终在探索厌氧氨氧化菌和各种有机物以及异养反硝化菌之间的关系[10-13],以建立一个不受有机物影响甚至能够较好的利用有机物的高效厌氧氨氧化反应器.
将异养反硝化菌和自养AAOB混合培养,可使AAOB在相对较高有机物浓度条件下保持活性稳定,在实际应用过程中更具有优势.本研究选取甲醇反硝化菌,城市污水处理厂活性污泥和厌氧氨氧化颗粒污泥进行研究.在亚硝氮和氨氮同时存在的基质中,分别在污泥和各种有机物混合,自养和异养反硝化菌群混合条件下开展反硝化研究,比较了异养和自养反硝化的效果.在此多基质,多种群条件下探明有机物和异养反硝化菌对自养AAOB的作用机理,为建立高效厌氧氨氧化反应器提供理论指导和技术支持.
1 材料与方法
1.1 污泥来源
1.1.1 AAOB AAOB来源于实验室厌氧氨氧化固定床反应器下部的悬浮污泥(图1),刻度尺所示最小刻度为1mm.厌氧氨氧化固定床反应器有效容积 50L,原水中亚硝氮控制为 50~60mg/L,氨氮为 40~50mg/L,其余组分和微量元素控制参照文献10.反应器温度为24~26℃,进水由浓水和未经消氧的自来水组成,DO为 4~5mg/L.取样期反应器 HRT为 3h,总氮平均容积去除负荷为 0.5kg/(m3•d),悬浮污泥 MLVSS/MLSS 为 56%~58%,总氮平均比降解速率0.312kg/(kg·d).污泥取出后,清水清洗3遍后备用.

图1 AAOB颗粒Fig.1 Granular sludge of AAOB
1.1.2 甲醇反硝化菌 甲醇反硝化菌是在 5L的有机玻璃圆柱中培养驯化的,其中投加了堆积体积为 3L的环状辫带式载体.驯化开始时,接种污泥取自高碑店污水处理厂二沉池回流污泥廊道取样点.整个培养过程均为反应器底部连续进水,上部自流出水,HRT为 4.8h,进水亚硝氮 50~60mg/L,甲醇(200±20)mg/L,温度为室温 20~25℃.培养 40d后,亚硝氮容积去除负荷达到0.2kg/(m3·d).活性分析试验前,将载体取出,用清水将污泥从载体上洗脱,洗脱污泥再用清水清洗3遍后备用.
1.1.3 活性污泥 试验用活性污泥取自高碑店污水处理厂二沉池回流污泥廊道取样点.取回后清水清洗3遍后备用.
1.2 试验装置和程序
试验所用试验装置如图 2所示.反应瓶容积为 500mL,有效容积 450mL(150mL备用污泥+300mL由自来水和试剂配置的试验用水).试验步骤:(1)配置泥水混合液,测定pH值和MLSS;(2)启动恒温磁力搅拌器,转速为 300r/min,温度(25±1)
℃,通氮气 30min(氮气纯度 99.999%);(3)停止通氮气,依据反应速率,每隔1h或0.5h取样一次,每次取样体积 2mL;(4)试验结束,停止搅拌器,测定pH值和MLSS.

图2 反应装置示意Fig.2 Schematic diagram of the denitrification reactor
1.3 试验水质
试验用水采用配水,亚硝氮为40~60mg/L,氨氮为 40~60mg/L,其余组分和微量元素控制参照文献[10].不同有机物影响试验时,醇类和其他有机物每次的投量分别为0.1mL和0.1g.
1.4 分析方法
水质指标NO2--N, NH3-N, MLSS和MLVSS等,均采用国家标准方法分析.pH值测量采用Thermo scientific pH计.
2 结果与讨论
2.1 不同有机物存在时AAOB的活性
试验选取醇类(甲醇、乙醇、正丙醇、正丁醇)、乙酸钠、丙酸钠、糖类(葡萄糖、乳糖和蔗糖)等常见有机物,考察各有机物存在时 AAOB的活性,其中,各试验投加有机物后,有机物浓度为200mg/L.从图3可以看出,各条件下氨氮和亚硝氮的降解过程均为零级反应,线性拟合较好.
如表1和图3所示,当醇类有机物投量约为175.56mg/L(甲醇、乙醇、正丙醇和正丁醇分别为 5.48,3.81,2.92,2.37mmol/L)时,AAOB降解亚硝氮和氨氮的总体活性损失接近 50%,其中甲醇导致的总体活性损失最大,乙醇次之,正丁醇活性损失略大于正丙醇.如表1所示,在各反应条件下,反应器中自养和异养反硝化过程均同时存在,只是由于添加不同有机物,各反应速率差异较大.由于试验过程没有好氧硝化,因此以氨氮降解评价自养厌氧氨氧化活性,然后基于化学计量学方法,总的亚硝氮降解速率减去相应的自养亚硝氮降解速率,剩余亚硝氮降解速率即可表征异养反硝化速率.因此可得出甲醇为5.48mmol/L时,AAOB自养活性为原有活性的 1/3.Isaka等[14]的研究表明甲醇为 5.0mmol/L条件下,游离和聚乙烯醇包埋 AAOB活性分别为原有活性的 37%和 33%,与本试验结果较接近.随着醇类碳链的增加,与自养活性逐渐上升恰恰相反,异养反硝化活性逐渐降低,4种醇类有机物中,AAOB富集培养物利用甲醇和乙醇进行异养反硝化的能力显著高于正丙醇和正丁醇.
如表1和图3所示,丙酸钠、葡萄糖、乳糖和蔗糖对 AAOB活性的影响较小,结果类似于Güven等[12]的研究. Kartal等[15]将能同时厌氧氨氧化和利用丙酸钠反硝化的 AAOB命名为Anammoxoglobus propionicus,揭示了在小分子有机酸存在条件下AAOB的代谢途径具有多样性.如表1所示,本实验所用的AAOB在乙酸钠存在时活性上升了27.05%,而丙酸钠存在时未发现活性上升,其差别应和 AAOB的种类密切相关.Kartal等[15]的研究表明,在丙酸钠、氨氮、亚硝氮和硝氮同时存在时,Anammoxoglobus propionicus以亚硝氮和硝氮为电子受体,可将丙酸钠氧化,并且不直接利用丙酸合成菌体.但是,Kartal等[16]关于Brocadia fulgida适于含乙酸钠废水的研究中,再未描述相关的反硝化过程.

图3 多基质环境中AAOB对亚硝氮和氨氮的降解Fig.3 Nitrite and ammonium conversion in multi-matrixes by AAOB
2.2 甲醇反硝化菌和活性污泥的活性和对碳源的适应性
在工业水处理中,甲醇被广泛用作反硝化碳源[17-19].通常情况下,反硝化菌须经过驯化后,才能较好利用甲醇.如图4和表2所示,驯化后的甲醇反硝化菌利用甲醇短程反硝化时的亚硝氮比降解速率最大为0.251 kg/(kg·d),利用乙醇、正丙醇和乙酸钠时,其速率分别为最大比降解速率的95%、85%和43%.葡萄糖则很难被其反硝化利用,速率仅为最大比降解速率的16%.

表1 不同碳源条件下AAOB的活性Table 1 Activity and details of AAOB under different organic matrixes
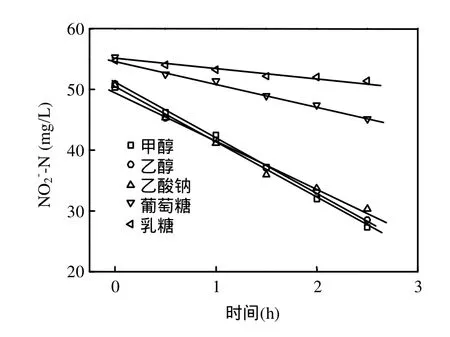
图4 不同碳源时甲醇反硝化菌对亚硝氮的降解曲线Fig.4 Nitrite conversion in different matrixes by methanol denitrifiers
北京市高碑店污水处理厂采用廊道式 A/O工艺处理城市生活污水,其活性污泥具有较好的硝化和反硝化能力.如图5和表3所示,在批式试验中,活性污泥利用乙酸钠短程反硝化的能力强于其他几种碳源,其亚硝氮比降解速率为0.128kg/(kg·d),其后依次为乙醇、甲醇和葡萄糖,乳糖最差.
甲醇反硝化菌和活性污泥的活性主要取决于菌群中反硝化菌的种类和数量.在以甲醇为碳源长期运行的系统中,选择性增殖的甲醇反硝化菌可将醇类转化为乙酸进入三羧酸循环以获得反硝化所需的能量和电子供体[20],因此,在乙醇和正丙醇作为碳源时也能获得较好的反硝化效果.由于乙酸和葡萄糖进入细胞膜需要载体蛋白,而甲醇反硝化菌缺乏相应的蛋白,从而导致其进入细胞膜较困难,所以反硝化效果较差.活性污泥所在的城市污水处理系统中,由于有机物种类较丰富,有利于各类反硝化菌的生长繁殖,因此活性污泥在各有机物存在时均有一定的反硝化效果.另外,从表2和表3可以看出,活性污泥利用乙酸钠和葡萄糖反硝化的活性略高于甲醇反硝化菌,而利用醇类碳源反硝化的能力远小于甲醇反硝化菌.

图5 不同碳源时活性污泥对亚硝氮的降解曲线Fig.5 Nitrite conversion in different matrixes by activity sludge

表2 不同碳源条件下甲醇反硝化菌的活性Table 2 Activity and details of methanol denitrification enrichment under different organic matrixes
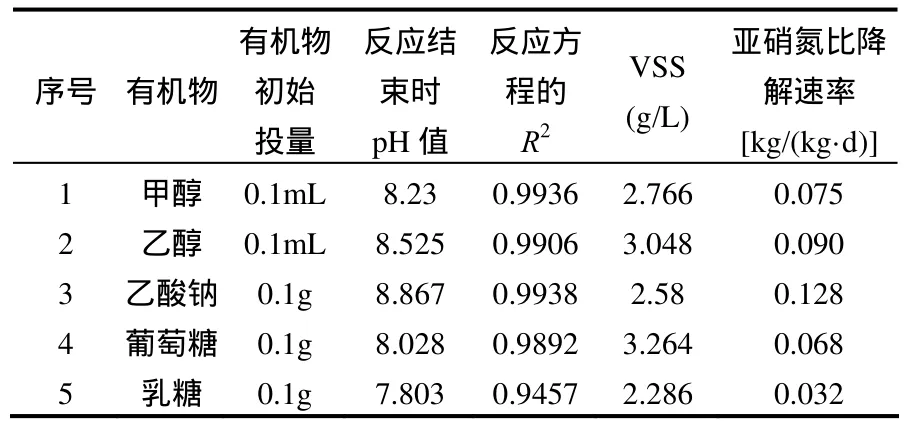
表3 不同碳源条件下活性污泥的活性Table 3 Activity and details of domestic wastewater treatment sludge under different organic matrixes
2.3 混合菌群的活性
试验将甲醇反硝化菌和活性污泥菌群分别与AAOB按比例混合.试验开始时,AAOB和甲醇反硝化菌混合菌群投加有机物正丙醇 0.1mL,AAOB和活性污泥中投加乙酸钠0.1g.试验以氨氮的降解速率评价AAOB活性.
如图6所示,AAOB和甲醇反硝化菌混合后,氨氮和亚硝氮降解均表现出较好的线性关系,即氨氮和亚硝氮的降解与其浓度无关,而与细胞活性和数量相关.由表4可知,相对于未投加正丙醇的AAOB菌群活性,投加正丙醇导致AAOB活性损失接近 50%,并且随着甲醇反硝化菌投加比例升高,AAOB活性下降趋势愈发显著,最大活性损失超过90%.说明AAOB在醇类有机物存在的情况下不仅活性明显下降,而且在与其他异养反硝化菌的竞争中处于劣势.
如图7所示,AAOB和活性污泥混合后,氨氮和亚硝氮降解仍为线性关系.从图 7和表 5可以看出,AAOB的活性未受到乙酸钠的抑制,相反具有促进作用.随着活性污泥投加比例升高,AAOB活性仍有下降,但与第一组试验相比,AAOB活性下降趋势显著减弱,最大活性损失仅为 26.54%.因此,在以小分子有机酸为反硝化碳源,但是碳源不足以满足反硝化脱氮的系统中,营造AAOB和异养反硝化菌共存的单级脱氮反应器具有较高的可行性.

表4 AAOB和甲醇反硝化菌混合后的活性Table 4 Activity and details of AAOB and methanol denitrifiers mixture under different organic matrixes

表5 AAOB和活性污泥混合后的活性Table 5 Activity and details of AAOB and activity sludge mixture under different organic matrixes
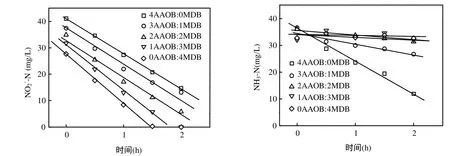
图6 AAOB和甲醇反硝化菌混合存在时氨氮和亚硝氮的降解曲线Fig.6 Nitrite and ammonium conversion by AAOB and methanol denitrifiers mixture
3 结论
3.1 在多种基质存在条件下,甲醇导致的AAOB 活性损失最大为 47.82%,乙醇次之,正丁醇活性损失略大于正丙醇.随着醇类碳链的增加,与氨氮比降解速率逐渐上升恰恰相反,亚硝氮比降解速率最大下降了 22.43%.非醇类有机物中,乙酸钠提高了AAOB活性27.05%,而丙酸钠、葡萄糖、乳糖和蔗糖等对AAOB活性的影响较小,葡萄糖表现出最大的抑制作用也仅为6.49%.
3.2 经驯化的甲醇反硝化菌,以甲醇为短程反硝化基质时短程反硝化的亚硝氮比降解速率最大为 0.251kg/(kg·d),以乙醇、正丙醇和乙酸钠为反硝化基质时时,速率分别为甲醇为基质时的95%、85%和 43%.葡萄糖则很难被其利用.由于活性污泥中的反硝化细菌可直接利用乙酸钠合成乙酰辅酶A参与三羧酸循环,以获得反硝化所需的能量及电子,因此活性污泥利用乙酸钠短程反硝化的能力优于甲醇、乙醇和葡萄糖等其它有机物.
3.3 在正丙醇存在条件下,AAOB和甲醇反硝化菌混合菌群中AAOB活性下降超过90%,在与甲醇反硝化菌的竞争中处于劣势.在乙酸钠存在条件下,AAOB和活性污泥的混合菌群中AAOB活性损失较小,仅为26.54%.
[1]Mulder A, Vande Graaf A A, Robertson L A, et al. Anaerobic ammonium oxidation discovered in a denitrifying fluidized bed reactor [J]. FEMS Microbiology Ecology, 1995,16(3):177-183.
[2]Schouten S, Strous M, Kuypers M M M, et al. Stable carbon isotopic fractionations associated with inorganic carbon fixation by anaerobic ammonium oxidizing bacteria [J]. Applied and Environmental Microbiology, 2004,70(6):3785-3788.
[3]Strous M, Pelletier E, Mangenot S, et al. Deciphering theevolution and metabolism of an anammox bacterium from a community genome [J]. Nature, 2006,440(7085):790-793.
[4]Jetten M S M, Niftrik LV, Strous M, et al. Biochemistry and molecular biology of anammox bacteria [J]. Critical Reviews in Biochemistry and Molecular Biology, 2009,44(2/3):65-84.
[5]Torà J A, Baeza J A, Carrera J, et al. Denitritation of a high-strength nitrite wastewater in a sequencing batch reactor using different organic carbon sources [J]. Chemical Engineering Journal, 2011,172(2/3):994-998.
[6]Jin X, Wang F, Liu G, et al. Characteristics of denitrifying granular sludge grown on nitrite medium in an upflow sludge blanket (USB) reactor [J]. Water Science and Technology, 2012,65(8):1420-1427.
[7]Tsushima I, Ogasawara Y, Kindaichi T, et al. Development of high-rate anaerobic ammonium-oxidizing (ANAMMOX) bio fi lm reactors [J]. Water Research, 2007(41):1623-1634.
[8]Tang C J, Zheng P, Wang C H, et al. Suppression of anaerobic ammonium oxidizers under high organic content in high-rate ANAMMOX UASB reactor [J]. Bioresource Technology, 2010,101:1762-1768.
[9]Abma W R, Schultz C E, Mulder J W, et al. Full-scale granular sludge ANAMMOX process [J]. Water Science and Technology,2007,55(8/9):27-33,524.
[10]van de Graaf AA, deBruijn P, Robertson L A, et al. Autotrophic growth of anaerobic ammonium -oxidizing micro-organisms in a fl uidized bed reactor [J]. Microbiology, 1996,142:2187-2196.
[11]Toh S K, Ashbolt N J. Adaptation of anaerobic ammoniumoxidising consortium to synthetic coke-ovens wastewater [J].Applied Microbiology and Biotechnology, 2002,59(2/3):344-352.
[12]Güven D, Ana Dapena, Kartal B, et al. Propionate oxidation by and methanol inhibition of anaerobic ammonium‑oxidizing bacteria [J]. Apply Environment Microbiology, 2005,71(2),1066-1071.
[13]González-Blanco G, Beristain-Cardoso R, Cuervo-López F, et al.Simultaneous oxidation of ammonium and p-cresol linked to nitrite reduction by denitrifying sludge [J]. Bioresource Technology, 2012,103(1),48-55.
[14]Isaka Kazuichi, Suwa Yuichi, Kimura Yuya, et al. Anaerobic ammonium oxidation (anammox) irreversibly inhibited by methanol [J]. Applied Microbiology and Biotechnology, 2008,81(2):379-385.
[15]Kartal B, Rattray J, van Niftrik L A, et al. Candidatus‘Anammoxoglobus propionicus’ a new propionate oxidizing species of anaerobic ammonium oxidizing bacteria [J]. System Apply Microbiology, 2007,30(1):39-49.
[16]Kartal B, van Niftrik L, Rattray J, et al. Candidatus ‘Brocadia fulgida’: an auto fl uorescent anaerobic ammonium oxidizing bacterium [J]. FEMS Microbiology Ecology, 2008,63(1):46-55.
[17]Ginige Maneesha P, Bowyer Jocelyn C, Foley Leah, et al. A comparative study of methanol as a supplementary carbon source for enhancing denitrification in primary and secondary anoxic zones [J]. Biodegradation, 2009,20(2):221-234.
[18]Kim I S, Oh S E, Bum M S, et al. Monitoring the denitrification of wastewater containing high concentrations of nitrate with methanol in a sulfur-packed reactor [J]. Applied Microbiology and Biotechnology, 2002,59(1):91-96.
[19]Baytshtok Vladimir, Kim Sungpyo, Yu Ran, et al. Molecular and biokinetic characterization of methylotrophic denitrification using nitrate and nitrite as terminal electron acceptors [J]. Water Science and Technology, 2008,58(2):359-365.
[20]Weijma J, Stams A J M. Methanol conversion in high-rate anaerobic reactors [J]. Water Science and Technology, 2001,44(8):7-14.

