混合乳酸菌复合冻干保护剂的研究
陈贺佳,牟光庆
(大连工业大学食品学院,辽宁大连 116034)
混合乳酸菌复合冻干保护剂的研究
陈贺佳,牟光庆*
(大连工业大学食品学院,辽宁大连 116034)
摘 要:将嗜热链球菌、保加利亚乳杆菌、嗜酸乳杆菌按3∶2∶1比例制备乳酸菌冻干保护剂。通过正交试验确定混合乳酸菌最佳保护剂配方为:甘氨酸1.0%,脱脂乳10.0%,海藻糖7.0%,山梨醇1.0%。研究表明,冻干乳酸菌发酵剂发酵酸度、产香及产黏特性良好,且冷冻干燥法制备的复合冻干保护剂对菌种保护效果优于单一保护剂。
关键词:冷冻干燥;乳酸菌;保护剂
目前真空冷冻干燥技术已被广泛应用于各类发酵剂的制备和商业化生产中。与传统的液体发酵剂、低温干燥和喷雾干燥方法相比,冷冻干燥后的乳酸菌发酵剂具有保存期长、菌种不易退化、运输方便等优点[1]。通过真空冷冻干燥原理分析,其干燥过程会造成乳酸菌的损伤[2]。研究表明,添加保护剂可以改变冷冻干燥时菌体细胞所处的物理、化学环境,减轻或防止冷冻干燥对菌体细胞的损害,使乳酸菌保持原有的理化特性和生物活性,因此保护剂有效利用已成为提高菌种存活率的关键技术[3]。本研究将嗜热链球菌、保加利亚乳杆菌、嗜酸乳杆菌按3∶2∶1比例[4]混合,进行乳酸菌冻干保护剂的研究,以选择最佳混合保护剂配方,达到冻干后菌种存活率最高的目的。
1 材料和方法
1.1 材料
1.1.1 菌种
嗜热链球菌(Streptococcus thermophils,S.t)来自西藏雪莲,高产胞外多糖,由内蒙古农业大学乳酸菌菌库提供;嗜酸乳杆菌(Lactobacillus acidophilus,L.a),为大连工业大学保藏菌种;保加利亚乳杆菌(Lactobacillus bulgaricus,L.b),筛选自辉山酸奶。
1.1.2 培养基
菌种传代和活化用12%脱脂乳培养基,扩大培养和菌落计数用MRS培养基[5]。
1.1.3 冻干保护剂
赖氨酸、甘氨酸、谷氨酸、VC、甘露醇、甘油、山梨醇、乳糖、蔗糖、果糖、海藻糖、麦芽糖、可溶性淀粉均为分析纯或生化试剂,脱脂乳粉:完达山乳业有限公司。
以上冻干保护剂分别配制成高浓度溶液。其中氨基酸、糖类和VC溶液经0.22 μm孔径微滤膜过滤除菌,其它冻干保护剂115℃灭菌15 min[6-7]。灭菌后于4℃冰箱备用。
1.1.4 仪器设备
4K系列真空冷冻干燥机:VirTis公司;Stratos冷冻离心机:Thermo Scientific公司;PHS-3C型精密pH计:上海雷磁仪器厂;NB-1系列数字式黏度计:上海泥润智能有限公司;手提式不锈钢蒸汽消毒器:上海三申医疗仪器有限公司;722型光栅分光光度计:山东高密彩虹分析仪器有限公司。
1.2 方法
1.2.1 冻干保护剂选择实验流程
菌种活化→扩大培养→离心→收集菌体→测活菌数→加入保护剂→分装→预冻→真空冷冻干燥→复水→测活菌数
1.2.2 菌种收集
取脱脂乳活化后的菌种接种到MRS液体培养基中扩大培养,接种量3%,42℃培养24 h。将扩大培养液加入无菌离心管中,4℃,6 000 r/min离心10 min收集菌体,去除上清液[8-10]。
1.2.3 乳酸菌冷冻干燥工艺条件
菌悬液分装厚度为4 mm,预冻温度为-80℃,预冻时间为12 h,冻干时间为8 h。
1.2.4 冷冻干燥存活率的确定
冻干前活菌数检测:将待测样品梯度稀释,采用倾注平板计数法检测活菌数[5]。
冻干后活菌数检测:向冻干菌粉中加入0.9%无菌生理盐水,补足至原体积,活菌数检测方法同上。
测冻干前后的活菌数,按照下列公式计算存活率:
存活率=冻干后用0.9%生理盐水补足至冻干前体积的活菌数/冻干前活菌数×100%1.2.5 酸度的测定
总酸度(T°):测定24 h内总酸度的变化情况,每隔2小时测一次,用0.1 mol/LNaOH标准溶液进行酸碱滴定[11]。
pH:用酸度计测定发酵24 h内pH变化情况,每隔2 h测一次。
1.2.6 粘度的测定
用粘度计测定发酵24 h内黏度的变化情况,每隔4 h测定一次。
2 结果与讨论
2.1 乳酸菌冻干保护剂筛选
根据相关研究结果[12-14]选取15种不同浓度保护剂分别添加至离心菌泥中,制成菌悬液。冻干前其菌悬液的活菌数为2.16×1010CFU/mL,冻干后计算其存活率,不同种冻干保护剂对乳酸菌存活率影响的平均值存在显著性差异(P<0.05)。运用Duncan新复极差法进行多重比较,结果如表1。

表1 乳酸菌冻干保护剂存活率多重比较结果分析表Table 1 Multiple comparisons of the cryoprotectants survival rate on lactobacillus
由表1所得结果,可以看出不同冻干保护剂对乳酸菌的保护效果均显著的高于无菌水的对照组。未添加保护剂的对照组(无菌水)乳酸菌冻干存活率仅为1.6%,添加冻干保护剂的乳酸菌存活率均在20%以上,说明本试验所选用的15种不同浓度的保护剂对乳酸菌均起到了保护效果,从而提高了冻干存活率。氨基酸、醇类、双糖、大分子物质保护效果最好的分别为:甘氨酸38.1%、山梨醇39.5%、海藻糖48.4%、脱脂乳50.5%。
2.2 乳酸菌冻干保护剂优化
研究表明,保护剂主要分为蛋白质、多糖、小分子糖、醇和维生素,采用添加保护剂的方法可以减轻冷冻和干燥过程所造成的细胞损伤、死亡及某些酶蛋白分子的钝化[15-16]。通过对保护剂的筛选试验以存活率作为衡量指标,选择存活率较高的甘氨酸、脱脂乳、海藻糖和山梨醇四种保护剂为因素,以冻干存活率为指标,建立L9(34)正交试验,结果如表2所示。
比较表1和表2可知,添加单一保护剂的乳酸菌冻干存活率在20.2%~50.4%,而添加正交试验中9种复合保护剂的乳酸菌冻干存活率在57.2%~89.4%,说明复合保护剂对乳酸菌保护效果比单一保护剂保护效果好。由表2极差分析可知,因素对试验指标影响的主次顺序是B>A>C>D,即脱脂乳对复合乳酸菌的冻干保护效果最好,其次是甘氨酸、海藻糖,山梨醇的保护作用最差。试验确定最佳组合为A2B2C3D1,即甘氨酸1.0%,脱脂乳10.0%,海藻糖7.0%,山梨醇1.0%,在此条件下,冻干存活率达到89.1%。

表2 冻干保护剂优化L9(34)正交设计与结果Table 2Plans and results of L9(34)on cryoprotectants
2.3 产酸能力
产酸能力强弱是酸奶生产选用菌种和判断菌种发酵活力的重要指标。实验以总酸度和pH为衡量指标,来检测冻干后菌株的产酸能力。如图1所示。
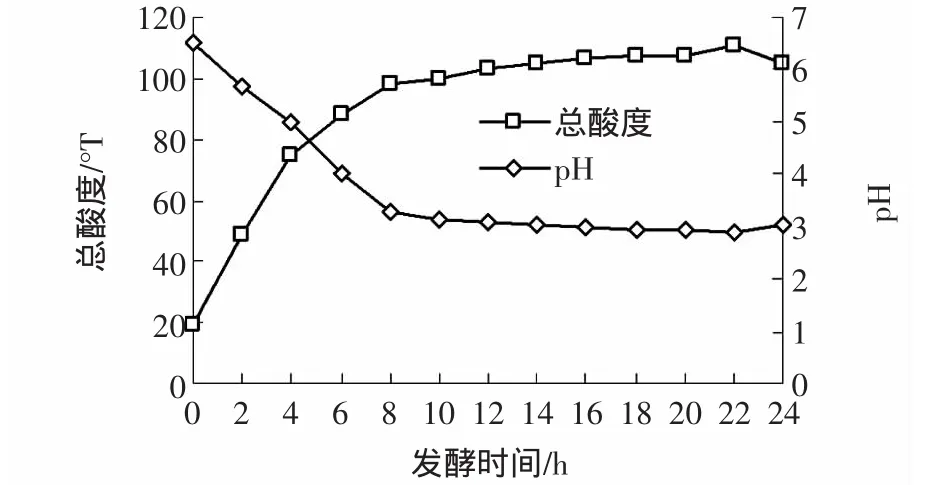
图1 冻干乳酸菌发酵过程总酸度和pHFig.1 The fermentation process of total acidity and pH on lactobacillus
由于冷冻干燥对乳杆菌损伤破害的原因,在发酵前期冻干的乳酸菌产酸能力有所下降,说明冻干燥后乳酸菌的停滞期延长。但总体观察冻干前后乳酸菌产酸能力来看,冻干后乳酸菌总酸度逐渐增大,同时pH呈下降趋势,前4 h酸度增加速率较快,在10 h后趋于稳定,表明冻干后乳酸菌发酵活力良好。
2.4 产香特性
发酵乳的风味主要来自于乳酸菌发酵过程中产生的乳酸和各种羰基化合物,其中羰基化合物主要是乙醛和双乙酰,被认为是构成发酵乳风味的基础物质。从图2中可以看出,在发酵过程中,混合乳酸菌之间的共生关系在促进乳酸菌生长的的同时,也促进双乙酰和乙醛风味物质物质产量的提高。发酵4 h后双乙酰和乙醛开始积累,8 h后产率降低,产量趋于平稳。通过图8pH变化趋势可以看出,当发酵乳pH在5.0~5.5范围时,才有明显双乙酰和乙醛的产生。在pH在3.5~4.0范围时,双乙酰和乙醛含量趋于稳定。

图2 乳酸菌发酵过程双乙酰和乙醛含量变化趋势Fig.2 The fermentation process of diacetyl and aldehyde on lactobacillus
2.5 产黏特性

图3 乳酸菌发酵过程中黏度和EPS变化趋势Fig.3 The fermentation process of viscosity and EPS on lactobacillus
发酵过程中产生微量的黏性物质,将有助于改善发酵乳的组织形态和黏度,特别是对固形物质含量低的发酵乳尤为重要。发酵乳黏度增加有两个原因:一是酪蛋白增加了发酵乳的黏稠度,二是保加利亚乳杆菌和嗜热链球菌产生的胞外多糖附着在乳酸菌细胞及蛋白质基质上,增加了发酵乳的黏稠度。由图2中可以看出,乳酸菌发酵过程黏度和胞外多糖含量变化趋势大致相同,表明胞外多糖含量的增加会促进黏度的增大,相关研究报道,高产胞外多糖影响发酵乳的稳定性,黏性有关,可以作为稳定剂、增稠剂,改善发酵乳的质构和口感。有在发酵后期20 h~24 h黏度和胞外多糖含量下降,说明发酵时间对黏度和胞外多糖产量具有影响,发酵时间过长会破坏发酵乳的黏性和稳定性,降低胞外多糖含量。
3 结论
不同保护剂对菌种起到不同保护作用。本研究所选择15种保护剂对混合乳酸菌都具有一定的保护效果,其中脱脂乳和海藻糖保护效果最为明显。由于单一保护剂存在一些缺陷不能高效的保护菌种,如大分子物质只能外部保护细胞表面免受损伤,不能渗透到细胞内部使细胞内溶质的浓度升高,减缓冰晶的生成,从而减少冻干对细胞内部的损伤,因此多种保护剂复合使用会比单一保护剂的作用更好些。本研究通过正交试验的方法,确定对于选定的混合乳酸菌的最佳冷冻干燥保护剂配方为甘氨酸1.0%,脱脂乳10.0%,海藻糖7.0%,山梨醇1.0%,此保护剂使混合乳酸菌的冻干存活率达到89.1%,且冻干后菌种的产酸、产香能力及产黏特性良好。
:
[1]李华,骆艳娥,刘延林.真空冷冻干燥微生物的研究进展[J].微生物学通报,2002,29(3):79-82
[2]Castro HP,Teixelra PM,Cirby R.Eyidence of membrane damage in Lactobacillus bulgaricus following freeze drying[J].J Applied Microbiology,1997,82:87-94
[3]Carvalho AS,Silva J,Ho P,et al.Survival of freeze-dried Lactobacillus plantarum and Lactobacillus rhamnosus during storage in the presence of protectants[J].Biotechnology letter,2002,24:1587-1591
[4]马艳,陈历俊,王昌禄,等.高产胞外多糖嗜热链球菌混菌培养特性研究[J].中国乳品工业.2011,39(1):15-18
[5]中华人民共和国卫生部.GB/T 4789.35-2008食品卫生微生物学检验食品中乳酸菌检验[S].北京:中国标准出版社,2009
[6]董翠龙.几种常用的物理灭菌法介绍[J].卫生防疫,2010(3):138
[7]王旻,于景华,张莉莉,等.鲜奶微过滤除菌初探[J].中国乳品工业,2000,28(2):13-14
[8]田洪涛,张柏林,贾英民,等.提高双歧杆菌在离心过程中活菌收得率的研究[J].食品科学,2000,21(6):27-30
[9]Foo HL,Loh TC,Lai PW,et al.Effects of Adding Lactobacillus plantarum I-UL4 Metabolites in drinking Water of Rats[J].Pakistan journal of nutrition,2003,2(5):283-288
[10]Bunthof CJ,Bloemen K,Breeuwer P,et al.Flow Cytometric Assessment of Viability of Lactic Acid Bacteria[J].Appled and environmental microbiology,2001,67(5):2326-2335
[11]骆承庠.乳与乳制品工艺学[M].北京:农业出版社,1992:82
[12]Fernanda F,Catherine B,Fatma M,et al.Improvement of cryopreservation of Lacbacillus delbrueckii subsp.bulgaricus CFLI with additives displaying different protective effects[J].International dairy journal,2003,13:917-926
[13]Albadias M,Benabarre A,Teixido N,et al.Effect of ferrze drying and protectants on viability of the biocontrol yeast Candida sake[J].International journal of food microbiology,2001,65:173-182
[14]Carcoba R,Rodriguez A.Influence of cryoprotectants on the viability and activity activity of frozen and freeze-dried cells of the novel starter strain Lactococus lactis ssp.[J].Eur Food Res Technol,2000,211:433-437
[15]陈声明,吕琴.微生物冷冻干燥的抗性机理[J].微生物学通报,1996,23(4):236-238
[16]陆爱华,王志耕,许飞,等.德氏保加利亚乳杆菌冻干工艺中菌悬浮液制备条件的研究[J].包装与食品机械,2006,24(4):22-25
Research of the Cryoprotectant for Composited Lactobacillus
CHEN He-jia,MU Guang-qing*
(School of Food Engineering,Dalian Polytechnic University,Dalian 116034,Liaoning,China)
Abstract:According to the proportion of lactic acid bacteria cryoprotectants preparation ,the strains matching ratio ofStreptococcus thermophils,Lactobacillus bulgaricus,Lactobacillus acidophilusis 3∶2∶1.By the orthogonal test it determine the optimum cryoprotectant formula for composited lactic acid bacteria as:glycine 1.0%,skim milk 10.0%,trehalose 7.0%,sorbitol 1.0%.According to acidity,producing aroma and viscosity of freeze-dried composited lactic acid bacteria culture is good,composite cryoprotectant protective effect is better single cryoprotectants.
Key words:freeze drying;lactobacillus;cryoprotectant
DOI:10.3969/j.issn.1005-6521.2013.18.033
辽宁省教育厅创新团队项目(2009T013)
陈贺佳(1984—),女(汉),在读研究生,研究方向:微生物资源与利用。
牟光庆(1967—),男,教授,研究方向:益生菌及蛋白质资源开发利用。
2012-12-20
- 食品研究与开发的其它文章
- 花生红衣白藜芦醇的研究进展

