黄颡鱼无水保活技术研究
白艳龙,谭昭仪,邸向乾,施文正,汪之和
(上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海201306)
黄颡鱼(Pseudobagrus fulvidraco)属鲶形目,鲿科的黄颡鱼属,俗称昂刺、黄姑、黄蜡丁、黄鳍鱼等。黄颡鱼广泛分布于长江、黄河、珠江及黑龙江等水域,具有高蛋白、低脂肪,肉质细嫩,味道鲜美,营养丰富等特点,且无肌间刺,可食性部分大,养殖简单,此外,黄颡鱼还有滋补作用,具有一定的药用价值,是出口创汇的优良品种,主要出口日本、韩国、东南亚等国家[1-2]。我国幅员辽阔,水产品养殖品种繁多且具有区域分布的特点,为满足不同区域消费者需求,水产品的保活运输便显示出很重要的商业价值[3],而保活运输也是保持水产品最佳鲜度的最有效方式[4]。水产品的传统运输多采用带水运输,此种方式运输成本相对较高,且水质容易污染,无水运输是对传统运输方法的一次革新,在具有部分皮肤呼吸功能的鱼类中得到应用,并在牙鲆[5]、大菱鲆[6]、鲫鱼[7]等鱼种中得到较好的效果。黄颡鱼的胸鳍和背鳍上长有带锯齿的硬刺,传统的带水运输,鱼体间易相互扎伤[4,8]。因此,探讨研究黄颡鱼的保活技术,对提高黄颡鱼的经济价值具有重要意义,本实验以黄颡鱼为原料研究其生态冰温无水保活技术及相关保活运输工艺,以期为黄颡鱼保活技术提供理论依据和技术参考。
1 材料与方法
1.1 材料与仪器
黄颡鱼 购自上海铜川路水产市场,选用规格一致(110±10)g、体表完整的原料鱼;肝素钠 生化试剂,国药集团化学试剂有限公司;浓硫酸 分析纯,国药集团化学试剂有限公司;乳酸、糖原试剂盒南京建成生物工程研究所。
ZC-10智能型超级恒温水槽 宁波天恒仪器厂;XW-80A漩涡混合器 上海医科大学仪器厂;SHP-2500低温生化培养箱 上海精宏实验设备有限公司;UV-1800PC紫外可见分管光度计 上海美谱达仪器有限公司;BS-200全自动生化分析仪 深圳迈瑞生物医疗电子股份有限公司;氧气瓶、塑料箱、充气泵、热电偶、数字温度计、塑料自封袋、秒表、纱布等辅助材料设备。
1.2 实验方法
1.2.1 鱼体死亡的确定 通过刺激鱼体观察有无反应或者将鱼体放入常温水中一段时间观察鱼鳃盖是否开闭,判断鱼体是否复苏。
1.2.2 临界温度的测定 将经过2d暂养的黄颡鱼放进盛有净水的塑料箱中,以3~4℃/h的速率缓慢降温,观察黄颡鱼在不同温度下的呼吸频率,以观察不到鱼呼吸时(鱼体尚未死亡)的温度作为其临界温度。
1.2.3 冻结点的测定 将热电偶的测温端插入鱼背部肌肉下,并给予固定,然后将其放入-20℃的冰箱内冻结,测定冻结曲线。
1.2.4 保活实验及复苏实验的测定 将处于低温休眠状态的黄颡鱼放入塑料自封袋中,上下垫湿透的纱布,以保持鱼体处于湿润状态,冲入纯氧后放置于低温生化培养箱内进行保活实验。无水保活实验结束后,将鱼放入常温水中,观察并记录鱼的复苏时间和状态。
1.2.5 肌肉中乳酸、糖原含量及pH的测定 乳酸、糖原含量分别采用试剂盒进行测定;pH测定方法:称取10g混匀的样品于烧杯中,加入新鲜煮沸(冷却)蒸馏水至100mL,均匀搅拌,静置30min后,记录其pH。
1.2.6 血液血清生化指标的测定 采血前用1%肝素钠润洗注射器,尾静脉取血后,去掉针头将血液注入离心管内,3000r/min离心10min,小心取出,吸取上层血清于2mL离心管内,除乳酸含量采用试剂盒测定外,其他指标皆采用全自动生化分析仪测定。
1.2.7 数据处理 使用SPSS19.0软件进行分析,在单因子方差分析(ANOVA)的基础上采用最小极差法(LSD)进行多重比较,取p<0.05为差异显著,利用Origin 8.0软件绘制相关图表。
2 结果与讨论
2.1 黄颡鱼的临界温度
表1为不同温度下黄颡鱼的呼吸频率,从表1中我们可以看出随着水温的不断降低,黄颡鱼的呼吸频率不断下降,当温度降至17℃时,黄颡鱼的活动量明显下降,在水中静止不游动,温度降至7℃左右时,鱼体开始侧翻,呼吸开始不均匀,温度降至4℃,鱼体表现为呼吸极不规律,偶尔咧腮,呼吸微弱,对外界刺激已无反应,说明此时的温度已经达到或接近黄颡鱼的临界温度,可以认为黄颡鱼的临界温度为4℃。
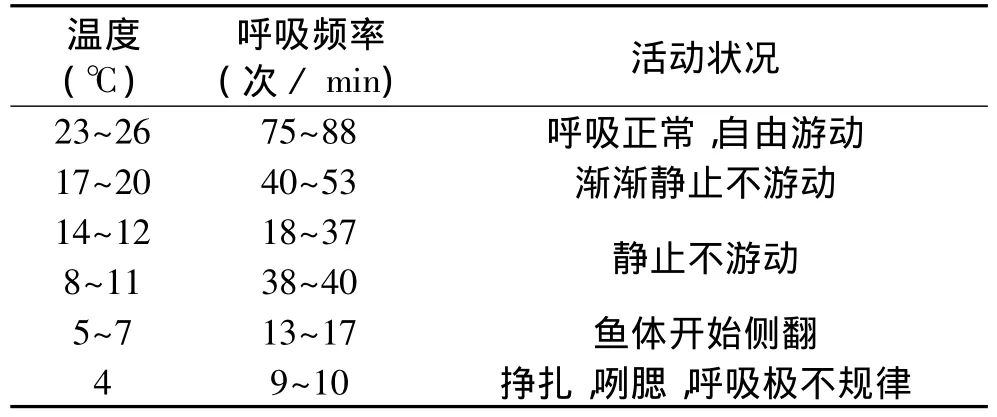
表1 黄颡鱼在不同温度条件下的呼吸频率Table 1 Breath frequency of yellow catfish at various temperatures
2.2 黄颡鱼的冻结点
从图1中的冻结曲线可以看出黄颡鱼的冻结点约在-1℃,温度继续降低将导致鱼体死亡,因此可以认为黄颡鱼在无水保活过程中的温度下限为-1℃。根据生态冰温区的定义,从临界温度到冻结点的这段温度称作生态冰温区[9]。黄颡鱼在无水保活时温度应控制在-1~4℃范围内。
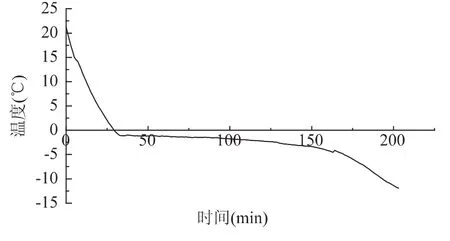
图1 黄颡鱼冻结曲线Fig.1 Freezing curve of yellow catfish
2.3 供氧方式对黄颡鱼无水保活时间的影响
从图2中可以看出在无水保活中纯氧供氧的效果要优于空气供氧,这是因为黄颡鱼在无水低温休眠状态下鳃盖始终处于闭合状态,无法进行呼吸,只能依靠皮肤进行微弱的呼吸作用,虽然低温下黄颡鱼的新陈代谢水平极低,氧气消耗量极少,在纯氧状态下黄颡鱼可获得更多的氧气,因而无水保活时间更长。韩利英[7]研究鲫鱼保活条件对存活率的影响,研究表明纯氧供氧相对于空气供氧鲫鱼无水保活时间可由9h提高到22h,本研究由15h提高到22h,提高幅度较低,原因可能是黄颡鱼的皮肤呼吸功能比鲫鱼强,在空气中氧气利用率比较高,空气中的氧气含量能够满足黄颡鱼较长时间呼吸。
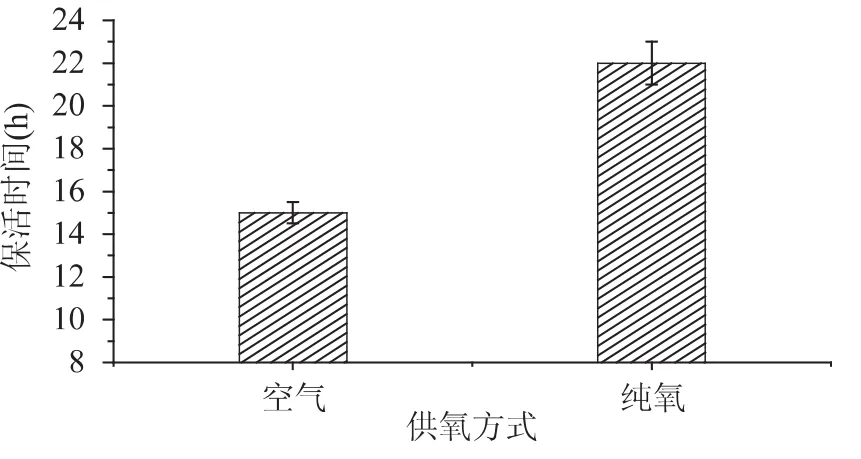
图2 供氧方式对黄颡鱼无水保活时间的影响Fig.2 Effect of oxygen supply on keep-alive without water
2.4 暂养时间对黄颡鱼无水保活时间的影响
从图3可见,在经过1~2d暂养之后黄颡鱼的保活时间可明显延长,暂养时间2d以上则对于无水保活没有明显延长影响,因此黄颡鱼在进行无水运输前应停食2d。Berka R[10]认为活鱼在运输前暂养比未经暂养保活运输时间会增加一倍,对黄颡鱼的研究也证实了这一点,这与刘淇[5]研究牙鲆的无水保活技术结果相似。因为在饱食状态下黄颡鱼新陈代谢水平较高,要消耗更多的氧气,对外界刺激比较敏感,停食暂养后黄颡鱼消化道基本排空,代谢较低,耗氧量下降,对外界各种刺激敏感程度下降,在此情况下黄颡鱼的无水保活时间可明显提高。
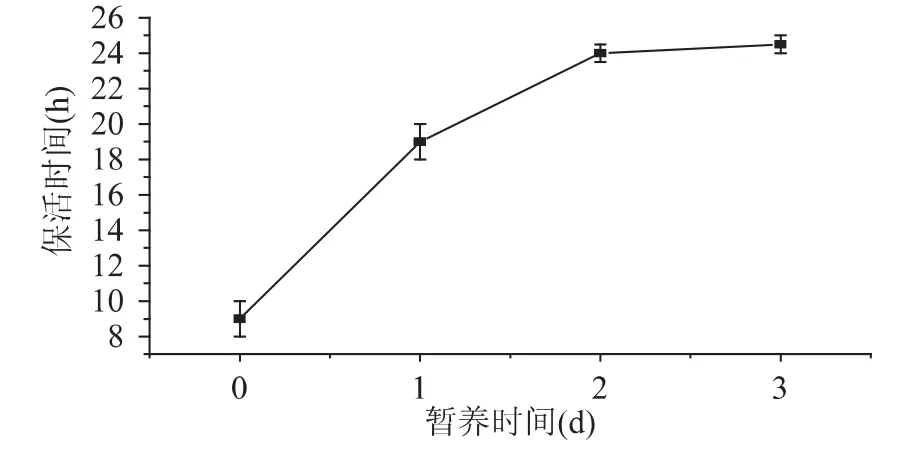
图3 暂养时间对黄颡鱼无水保活时间的影响Fig.3 Effect of temporary culture time on keep-alive time without water
2.5 温度对黄颡鱼的无水保活时间的影响
从图4可以看出黄颡鱼在生态冰温区的无水保活时间呈现上升后下降的趋势,在2℃无水保活时间最长。在-1℃时无水保活时间最短,原因是鱼体长时间处于微冻温度,体表水分随时间延长逐渐冻结,导致鱼体无法利用其皮肤进行呼吸而死亡。当温度控制在2℃时黄颡鱼的无水保活时间最长,原因可能是黄颡鱼在此温度由于处于低温休眠状态,新陈代谢水平极低,氧气消耗量极少,皮肤呼吸完全可以满足其存活,温度再升高可导致鱼体皮肤呼吸无法满足新陈代谢增强的需求而降低无水保活时间。由此可以看出,黄颡鱼在其生态冰温内可以保持活体状态,因此黄颡鱼的无水保活是可行的,并且无水保活时间可以达到24h,能够满足商业运输要求。
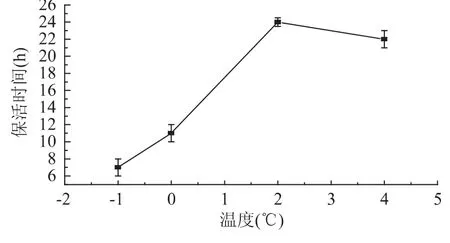
图4 不同温度黄颡鱼的无水保活时间Fig.4 Keep-alive time of yellow catfish at different temperature without water
2.6 黄颡鱼的复苏时间分析
将无水保活后的黄颡鱼直接放入常温(20℃)水中,可以观察到鱼尾摆动幅度越来越大,鱼鳃开始不规律地开闭,呼吸频率越来越大,逐渐接近正常水平,大约20min左右(见图5),鱼体恢复正常的游动,从而实现了无水保活后黄颡鱼的复苏。

图5 黄颡鱼的复苏时间和呼吸频率的关系Fig.5 Relation of revival time and breath frequency of yellow catfish
2.7 保活过程中鱼肉乳酸、糖原、pH的变化分析
在保活过程中的不同阶段黄颡鱼肌肉内乳酸、糖原、pH等指标将会发生变化,由表2可知,乳酸由保活前(0.72±0.10)mmol/g prot上升到保活后(1.01±0.11)mmol/g prot,糖原由保活前(2.10±0.14)mg/g下降到保活后(1.21±0.06)mg/g,pH由保活前7.22±0.04下降到保活后7.13±0.07。肌肉中乳酸、糖原、pH变化之间存在着一定的关系,糖原主要存在于肌肉和肝脏中,是能量的重要来源,鱼类利用肝糖原的能力很差,主要利用肌肉中的糖原,在无水保活过程中肌肉中糖原在缺氧时发生酵解产生能量的同时生成乳酸,乳酸绝大部分进入血液,从而造成糖原含量下降,乳酸含量上升,并导致肌肉pH的下降。

表2 黄颡鱼保活前后肌肉中乳酸、糖原、pH的变化Table 2 Changes of lactic acid,glycogen,pH in muscle during keep-alive process
2.8 保活过程中血液生化指标的分析
在保活过程中黄颡鱼血液生化指标变化如表3所示。由表3可见在生态冰温无水保活过程中,总蛋白和白蛋白都是先降低后升高,保活前后没有显著性差异。总蛋白和白蛋白可反映肝功能的代谢情况,白蛋白是由肝脏合成的,在血液中起着载体的作用,与血液中大部分水分、胆红素、尿酸、钙等结合而进行运送,与代谢、营养关系密切,当长期处于不良状态时,白蛋白会显著下降[11]。黄颡鱼由于处于无水、缺氧状态,总蛋白和白蛋白都显著下降,保活结束鱼体在水中复苏后总蛋白和白蛋白较保活前变化不显著。

表3 黄颡鱼保活过程血液生化指标的变化Table 3 Changes of blood biochemistry parameters during keep-alive process
尿素、肌酐、尿酸是反映肾功能代谢情况的重要指标,尿素是氮化合物代谢的产物,尿素也是维持血液渗透压的主要成分[12],表3可看出在整个保活过程中,尿素略有下降,但差异不显著;肾功能减退时尿酸会升高,表3显示尿酸在保活中显著升高,保活结束复苏后回到正常水平,说明在保活中肾功能部分受到抑制;肌酐是肾脏机能的一个重要指标,肾脏机能发生障碍,血液中肌酐含量会升高[13],由表3可见保活后肌酐含量上升,变化差异显著,说明黄颡鱼在低温无水条件下保活,肾功能会受到一定程度的损伤,这也是长时间保活会导致鱼体死亡的原因之一。
血糖是鱼体生理活动所需能量的来源之一。葡萄糖在肌肉和肝脏中以糖原的形式存在,从表3中可看出,血糖在整个保活过程中含量上升且变化差异显著。乳酸是葡萄糖在无氧条件下发生酵解提供能量时的产物,肌肉产生的乳酸大部分会进入血液,而乳酸含量增加会对血液中血红蛋白运输氧的能力产生影响,导致血液最大氧结合量减少[13],从表3中可以看出血液乳酸量在保活过程中显著上升,导致鱼体供氧量减少,这可能也是限制保活时间进一步延长的重要因素之一。
3 结论
本文研究黄颡鱼的无水保活运输技术,黄颡鱼在低温(2℃)无水纯氧的环境下可以存活24h,并可在常温(20℃)水中完全复苏。黄颡鱼在此条件下新陈代谢水平较低,几乎观察不到呼吸活动,基本依靠皮肤呼吸来满足鱼体耗氧,可以满足黄颡鱼的商业运输要求。在保活过程中肌肉中糖原含量下降、乳酸含量上升导致pH下降;血液中肌酐、血糖、乳酸含量在保活过程中显著上升,白蛋白在保活中显著下降,尿酸在保活中显著上升;除肌酐、血糖、乳酸外其他各项指标保活前后没有显著变化。
[1]刘行彪,付熊,吴晗冰,等.黄颡鱼营养学的研究进展[J].水产学杂志,2011,24(1):55-59.
[2]黄峰,严安生,熊传喜,等.黄颡鱼的含肉率及鱼肉营养评价[J].淡水渔业,1999(10):3-6.
[3]张慜,肖功年.国内外水产品保鲜和保活技术研究进展[J].食品与生物技术,2002(1):104-107.
[4]汪之和,张饮江,李勇军.水产品保活运输技术[J].渔业现代化,2001(2):31-34.
[5]刘淇,殷邦忠,姚健,等.牙鲆无水保活技术[J].中国水产科学,1999(2):101-103.
[6]刘伟东,薛长湖,殷邦忠,等.低温下大菱鲆有水和无水保活过程中生理生化变化的研究[J].渔业科学进展,2009(5):69-74.
[7]韩利英,张慜.鲫鱼保活条件对存活率的影响[J].食品与生物技术学报,2009(5):642-646.
[8]王丽岩,王永莉 .黄颡鱼运输技术[J].黑龙江水产,2004(3):20.
[9]徐若,曹井志,包建强.泥蚶无水低温保活技术研究[J].食品工业科技,2008,29(5):256-258.
[10]Berka R.The transport of live fish:a review[M].Rome:Food and Agriculture Organization of the United Nations,1986:1.
[11]Hoseini S M,Nodeh A J.Changes in blood biochemistry of common carp Cyprinus carpio(Linnaeus),following exposure to different concentrations of clove solution[J].Comparative Clinical Pathology,2011:1-5.
[12]林浩然.鱼类生理学[M].广州:广东高等教育出版社,1999:86.
[13]尾崎久雄.鱼类血液与循环生理[M].上海:上海科学技术出版社,1982:97-105.

