功能牛奶对小鼠免疫调节作用的研究
任璐,张锋华,苗君莅,蔡涛,王辉,肖杨
(光明乳业股份有限公司乳品研究院乳业生物技术国家级重点实验室,上海 200436)
随着我国国民经济的迅猛发展,人们的工作和生活方式更加快节奏、高效率。加之总需应对各种激烈的市场竞争,使越来越多的人们长期处于亚健康状态,从而导致人体免疫力下降。与此同时,人民生活水平的提高及生活质量观的日益兴起,人们在对饮食多样化、营养科学化方面提出了更高的要求,渴望通过调整饮食结构、补充营养物质来提高自身的健康水平和生命质量。综观这几年的保健食品,增强免疫力的产品总是最多的,但以液态奶为主要原料的免疫牛奶产品较少。低聚果糖、菊粉、富硒酵母作为重要的功能性食品配料,关于其促进肠道益生菌增殖[1-3]和抗氧化[4]的功能性报道很多。以牛奶这个普通食品为载体,通过添加低聚果糖、菊粉、富硒酵母等原料,利用主要成分各自的功能特性和相互的协同作用设计开发了一款功能牛奶。本文通过小鼠实验从细胞免疫、体液免疫、单核-巨噬细胞功能及NK细胞活性4个方面,进一步研究和全面评价自制研发的功能牛奶对其机体免疫调节的影响。
1 材料与方法
1.1 原料
牛奶:光明乳业牧场;低聚果糖:上海格信健康科技有限公司;菊粉:广州市德比欧贸易有限公司;富硒酵母:安琪酵母股份有限公司。
1.2 仪器及试剂
BIO-RAD 680型酶标仪:美国Bio-Rad公司;HERAcell 240型CO2培养箱:德国Heraeus公司;TW 20恒温水浴锅:德国Julabo公司;BX61显微镜:日本Olympus公司;DMI 3000-3N/PH倒置显微镜:德国Leica公司。高速乳化机-ULTRA-TURRAX IKA T18:IKA,德国;数显恒温水浴锅:国华电器有限公司。
绵羊红细胞(SRBC)、YAC-1细胞、鸡红细胞:北京联合大学应用文理学院保健食品功能检测中心;RPMI 1640培养液:美国CellGro公司;都氏试剂(NaHCO31.0 g/L,K3[Fe(CN)6]0.2 g/L,KCN 0.05 g/L);SA缓冲液(10 mmol/L醋酸钠,pH5.0);ConA、吩嗪二甲酯硫酸盐、氧化型辅酶I:美国Sigma公司;小牛血清:长春西诺生物科技有限公司;MTT:美国Promega公司;NP40:上海研卉生物科技有限公司;豚鼠血清、墨汁:上海麦莎生物科技有限公司;Giemsa染液:德国AppliChem公司;其他为常规试剂。
1.3 剂量设计
根据普通成人每日饮用500 mL(按60 kg体重计)牛奶计算,由于样品量超出动物最大承受量,需要将样品浓缩。故将功能牛奶配方设计为:称取低聚果糖120 g、菊粉50 g和富硒酵母1.5 mg加入100 mL牛奶中(水浴锅中预热到80℃),经过高速剪切混匀、均制、杀菌后作为功能牛奶供试液,即将功效成分增加100倍,相当于人体推荐量每日5 mL/60 kg。
1.4 受试样品
根据本试验剂量设计要求及功能牛奶供试液的推荐剂量,设定低、中、高3个剂量组为每日0.4 mL/kg·bw、0.8 mL/kg·bw 和 2.5 mL/kg·bw,相当于人体推荐量的5倍、10倍、30 倍。即取供试液 0.4 mL、0.8 mL、2.5 mL,加蒸馏水至20 mL,按照灌胃量0.4 mL/20 g·bw对小鼠灌胃。空白对照组和牛奶对照组分别给予蒸馏水和样品牛奶。
1.5 动物分组及喂养
将250只体重为(20±3)g的清洁级ICR小鼠[由上海斯莱克实验动物有限责任公司提供,许可证号:SCXK-(京)2007-0005],按体重随机分入5个试验大组,每组50只(分别进行NK细胞和淋转实验,DTH、脾指数和胸腺指数实验,溶血空斑和溶血素实验,碳廓清实验和吞噬实验)。每个试验大组中均设有空白对照组、牛奶对照组及低、中、高剂量组五小组,每小组10只。
1.6 试验方法
《保健食品检验与评价技术规范》(2003版)规定[5]:在细胞免疫功能、体液免疫功能、单核——巨噬细胞功能、NK细胞活性4个方面任2个方面结果阳性,可判定该受试样品具有增强免疫力功能作用。其中细胞免疫功能测定项目中的2个试验结果均为阳性,或任1个试验的2个剂量组结果阳性,可判定细胞免疫功能测定结果阳性。体液免疫功能测定项目中的2个试验结果均为阳性,或任1个试验的2个剂量组结果阳性,可判定体液免疫功能测定结果阳性。单核——巨噬细胞功能测定项目中的2个试验结果均为阳性或任1个试验的两个剂量组结果阳性,可判定单核——巨噬细胞功能结果阳性。NK细胞活性测定试验的1个以上剂量组结果阳性,可判定NK细胞活性结果阳性。因此,选取评价以上四方面来作为评判功能牛奶对小鼠免疫调节的作用。
1.6.1 喂养并称重
按照剂量设计连续喂养小鼠30 d,每周称重1次,计算试验初、中期、末期体重。
1.6.2 脏器/体重比值的测定
动物连续给样30 d后,颈椎脱臼处死,取脾脏和胸腺称重,分别计算脾脏体重比值和胸腺体重比值。
1.6.3 细胞免疫功能测定
1.6.3.1 ConA诱导的小鼠脾淋巴细胞转化试验
动物连续给样30 d后,颈椎脱臼处死,取脾脏制成脾细胞悬液,调整细胞浓度为2×106个/mL,将细胞悬浮液分两孔加入24孔培养板中,每孔1 mL,一孔加50 μL ConA 液(相当于 5 μg/mL),另一孔作为对照,置5%CO2,37℃培养72 h。培养结束前4 h,每孔轻轻吸去上清液0.7 mL,加入0.7 mL不含小牛血清的PRMI1640 培养液,同时加入 MTT(5 mg/mL)50 μL/孔,继续培养4 h,培养结束后,每孔加入1 mL酸性异丙醇,吹打混匀,使紫色结晶完全溶解后,以570 nm波长进行比色,记录试验结果。
1.6.3.2 DHT测试
致敏:动物连续给样30 d后,每鼠腹部去毛,范围约3 cm×3 cm,将1%的DNFB溶液50 μL均匀涂抹致敏。DHT的产生与测定:5 d后,用1%DNFB溶液10 μL均匀涂抹于小鼠右耳(两面)进行攻击。24 h后,颈椎脱臼处死小鼠,用打孔器取下直径8 mm的左右耳片,称重并计算肿胀度。
1.6.4 体液免疫功能测定
1.6.4.1 抗体生成检测试验
动物连续给样30 d后,将脱纤维绵羊红细胞免疫5 d后,动物颈椎脱臼处死,取脾脏,制成脾细胞悬液,调整细胞浓度为5×106个/mL。将表皮层培养基(1 g琼脂糖加双蒸水至100 mL)加热溶解后,放入45℃水浴保温,与等量pH7.2~7.4且2倍浓度的Hanks液混合,分装在小试管,每管0.5 mL,再向管内加入50 μL 10%SRBC,20 μL脾细胞悬液,迅速混匀,倾倒于已刷琼脂薄层的6 cm平皿上,放入二氧化碳培养箱中温浴1.5 h,然后用SA缓冲液稀释的补体(1∶10)加入到平皿中,继续温浴1.5 h后,计算溶血空斑数。
1.6.4.2 血清溶血素试验
动物连续给样30 d后,用2%(体积比)SRBC免疫动物5 d后,眼眶采血,颈椎脱臼处死,分离血清。在96孔微量血凝板上加25 μL生理盐水,分别在第一排加25 μL血清,以后各排座作对倍稀释,每孔加1%SRBC100 μL,振荡后 37℃放置 3 h,当血球对照出现沉落后观察结果。
1.6.5 单核-巨噬细胞功能测定
1.6.5.1 小鼠碳廓清试验
动物连续给样30 d后,尾静脉注射1∶3稀释的印度墨汁,待墨汁注入,立即计时。注入墨汁后2 min和10 min,分别从眼静脉丛取血20 μL,并将其加到2 mL 0.1%Na2CO3溶液中,用分光光度计在600 nm波长处测OD值,以Na2CO3溶液作空白对照。根据动物体重、肝重和脾重计算吞噬指数。
1.6.5.2 小鼠腹腔巨噬细胞吞噬鸡红细胞试验
动物连续给样30 d后,每鼠腹腔注射20%鸡红细胞悬液1 mL,间隔30 min,颈椎脱臼处死,固定于鼠板上,剪开腹壁皮肤,注射生理盐水2 mL,转动鼠板1 min,吸出腹腔洗液1 mL,分滴于2片玻片上,37℃孵箱湿孵30 min,用生理盐水漂洗,晾干,以1∶1丙酮甲醇溶液固定,4%Giemsa-磷酸缓冲液染色3 min,再用蒸馏水漂洗晾干,用油镜镜检,计算吞噬百分数和吞噬指数。
1.6.6 NK细胞活性测定
动物连续给样30 d后,颈椎脱臼处死,取脾脏,制成脾细胞悬液(效应细胞),取传代后24 h YAC-1细胞加1640完全培养液,调整细胞浓度为1×105个/mL(靶细胞),取靶细胞和效应细胞各100 μL效靶比(50∶1),加入U型96孔培养板,靶细胞自然释放孔加靶细胞和培养液各100 μL,最大释放孔加靶细胞和1%NP40各100 μL,上述各项均设3个复孔,于37℃、5%CO2培养箱中培养4 h,每孔吸取上清液100 μL置平底96孔培养板中,同时加入LDH基质液100 μL,反应 3 min,每孔加入1 mol/L的HCl30 μL终止,用酶标仪在490 mm处测定光密度值(OD)。
1.7 数据统计分析
2 结果与分析
2.1 细胞免疫功能测定
2.1.1 ConA诱导的小鼠脾淋巴细胞转化实验
淋巴细胞在免疫调控中起重要作用,其增殖反应是反映淋巴细胞活化和功能的重要指标。功能牛奶在不同剂量条件下对小鼠脾淋巴细胞增殖的刺激作用,结果见表1。
表1结果表明,经口给予小鼠不同剂量的功能牛奶30 d后,与空白对照组和牛奶对照组比较,每周各组的小鼠体重均无显著差异,2.5 mL/kg·bw剂量组的OD值显著高于空白对照组(p<0.01),亦显著高于牛奶对照组(p<0.05),而0.4 mL/kg·bw剂量组和0.8 mL/kg·bw剂量组的OD值与对照组均没有发生显著变化(p>0.05),淋巴细胞在免疫调控中起重要作用,特异性免疫是由淋巴细胞识别外源性抗原开始,通过增殖和分化成效应细胞行使清除抗原的功能。因此,淋巴细胞的增殖反应是反映淋巴细胞活化和功能的重要指标[6]。说明功能牛奶在2.5 mL/kg·bw剂量时能够刺激淋巴细胞增殖的有丝分裂源活性,显著增强其细胞免疫功能。
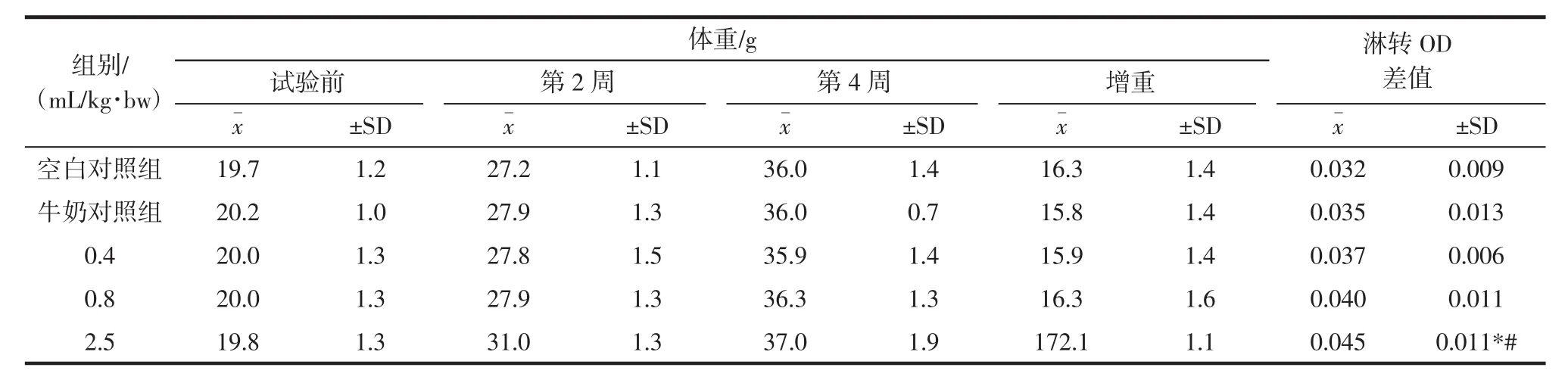
表1 功能牛奶对小鼠脾淋巴细胞转化的影响(n=10)Table 1 Effect of functional milk on activity of lymphocyte transformation of mice
2.1.2 对小鼠迟发性变态反应(DHT)的测试
迟发型变态反应是由T细胞介导的细胞免疫应答的一种类型,也是常见的一种免疫反应,外周血液中T细胞亚群的数目和比值测定是估计体内免疫调节平衡状态的最有意义的参数,也是疾病严重程度和预后的重要标志之一[7]。功能牛奶对小鼠迟发性变态反应(DHT)的影响见表2。
表2结果表明,经口给予小鼠不同剂量的功能牛奶30 d后,与空白对照组和牛奶对照组比较,每周各组的小鼠体重均无显著差异;各组小鼠的胸腺指数和脾指数均无显著差异;在DTH试验中,2.5 mL/kg·bw剂量组的左右耳重量差值(肿胀度)显著高于空白对照组(p<0.01),亦显著高于牛奶对照组(p<0.05);而牛奶对照组、0.4 mL/kg·bw剂量组和0.8 mL/kg·bw剂量组略高于空白对照组,但无统计学差异。以上结果说明2.5 mL/kg·bw剂量组对小鼠迟发性变态反应(DHT)有显著影响,显著增强其细胞免疫功能。

表2 功能牛奶对小鼠迟发性变态反应(DHT)的影响(n=10)Table 2 Effect of functional milk on DTH of mice
2.2 体液免疫功能测试
体液免疫功能在免疫调控中起重要作用。功能牛奶在不同剂量条件下对小鼠体液免疫(溶血空斑数和抗体积数)的影响,结果见表3。
表3结果表明,经口给予小鼠不同剂量的功能牛奶30 d后,与空白对照组和牛奶对照组比较,每周各组的小鼠体重均无显著差异;在抗体生成细胞检测试验中,2.5 mL/kg·bw剂量组的空斑数显著高于空白对照组(p<0.01),亦高于牛奶对照组(p<0.05);而牛奶对照组、0.4 mL/kg·bw剂量组和0.8 mL/kg·bw剂量组与空白对照组间无统计学差异。在血清溶血素试验中,2.5 mL/kg·bw剂量组的抗体积数显著高于空白对照组(p<0.01),亦高于牛奶对照组(p<0.05);而牛奶对照组、0.4 mL/kg·bw剂量组和0.8 mL/kg·bw剂量组与空白对照组间无统计学差异。以上结果说明2.5 mL/kg·bw剂量组有助于提高小数体液抗体水平。
2.3 单核-巨噬细胞功能测试
巨噬细胞是机体免疫系统的一种重要免疫细胞,不仅具有很强的吞噬功能,而且是主要的抗原提呈细胞,在非特异性和特异性免疫应答中均起关键作用 。巨噬细胞在抗肿瘤免疫、抗感染免疫及免疫调节中均起重要作用,其吞噬功能的强弱可以直接反映细胞免疫功能的强弱[9]。

表3 功能牛奶对小鼠体液免疫(溶血空斑数和抗体积数)的影响(n=10)Table 3 Effect of functional milk on humoral immunity of mice
2.3.1 小鼠碳廓清试验
碳廓清法可以表观小鼠网状内皮系统的吞噬功能,通过测定其吞噬指数的变化来研究不同剂量组对小鼠网状内皮系统的吞噬功能的影响,结果见表4。

表4 功能牛奶对小鼠碳廓清试验的影响(n=10)Table 4 Effect of functional milk on clearance capacity of carbon of mice
表4结果表明,经口给予小鼠不同剂量的功能牛奶30 d后,与空白对照组和牛奶对照组比较,每周各组的小鼠体重均无显著差异;在碳廓清试验中,2.5 mL/kg·bw剂量组的吞噬指数显著高于空白对照组(p<0.01),亦高于牛奶对照组(p<0.05);而牛奶对照组、0.4 mL/kg·bw剂量组和0.8 mL/kg·bw剂量组与空白对照组间无统计学差异。以上结果说明2.5mL/kg·bw剂量组对小鼠有提高小鼠吞噬指数的作用,对小鼠的非特异免疫功能有显著促进作用。
2.3.2 小鼠腹腔巨噬细胞吞噬鸡红细胞试验
巨噬细胞的吞噬功能在免疫反应中起着至关重要的作用。功能牛奶在不同剂量条件下对小鼠腹腔巨噬细胞吞噬能力的影响,结果见表5。
由表5结果可知,经口给予小鼠不同剂量的功能牛奶30 d后,与空白对照组和牛奶对照组比较,每周各组的小鼠体重均无显著差异;在小鼠腹腔巨噬细胞吞噬鸡红细胞试验中,0.8 mL/kg·bw剂量组的吞噬率和吞噬指数显著高于空白对照组(均p<0.05);2.5 mL/kg·bw剂量组的吞噬百分率和吞噬指数均显著高于空白对照组(均p<0.01),亦均显著高于牛奶对照组(均p<0.01),牛奶对照组与空白对照组间无统计学差异。以上结果说明,0.8 mL/kg·bw剂量组和2.5 mL/kg·bw剂量组对小鼠的非特异免疫功能有显著促进作用。
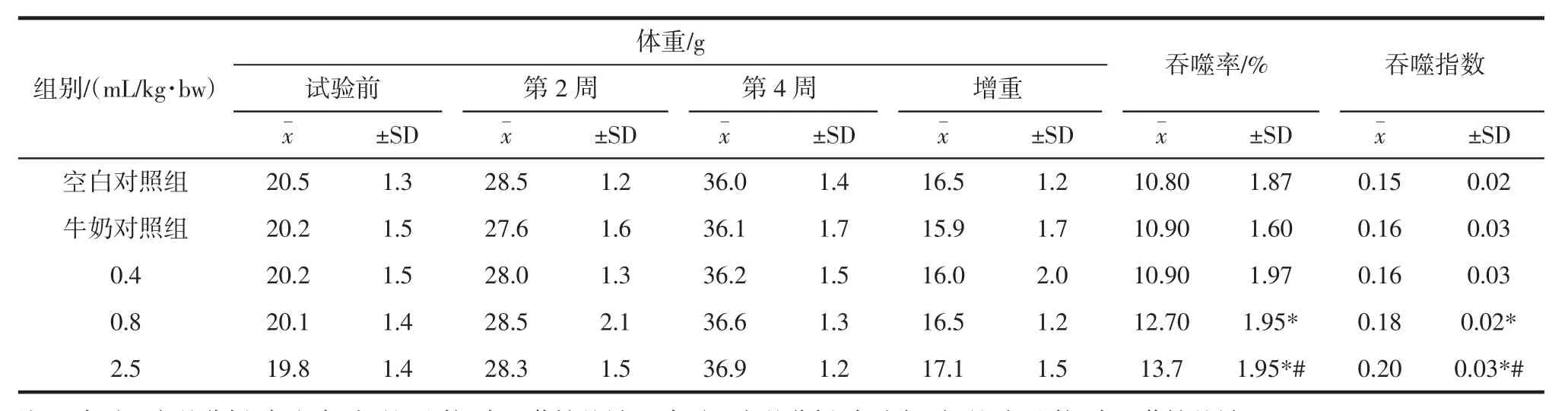
表5 功能牛奶对小鼠腹腔巨噬细胞吞噬能力的影响(n=10)Table 5 Effect of functional milk on phagocytic capacity of macrophages of mice
2.4 NK细胞活性测试
NK细胞(natural killer cell,自然杀伤细胞)是与T、B细胞并列的第三类群淋巴细胞,可非特异直接杀伤靶细胞,这种天然杀伤活性既不需要预先由抗原致敏,也不需要抗体参与,且不受主要组织相容性复合体(MHC)的约束,因此,把NK细胞活性作为非特异性免疫的重要指标[10]。功能牛奶对小鼠NK细胞活性的影响见表6。结果可知,经口给予小鼠不同剂量的功能牛奶30 d后,与空白对照组和牛奶对照组比较,每周各组的小鼠体重均无显著差异;在小鼠NK细胞活性测试试验中,2.5 mL/kg·bw剂量组的NK细胞活性显著高于空白对照组(p<0.05),且显著高于牛奶对照组(p<0.05)。以上结果说明2.5 mL/kg·bw剂量组对于增强NK细胞活性有显著促进作用。
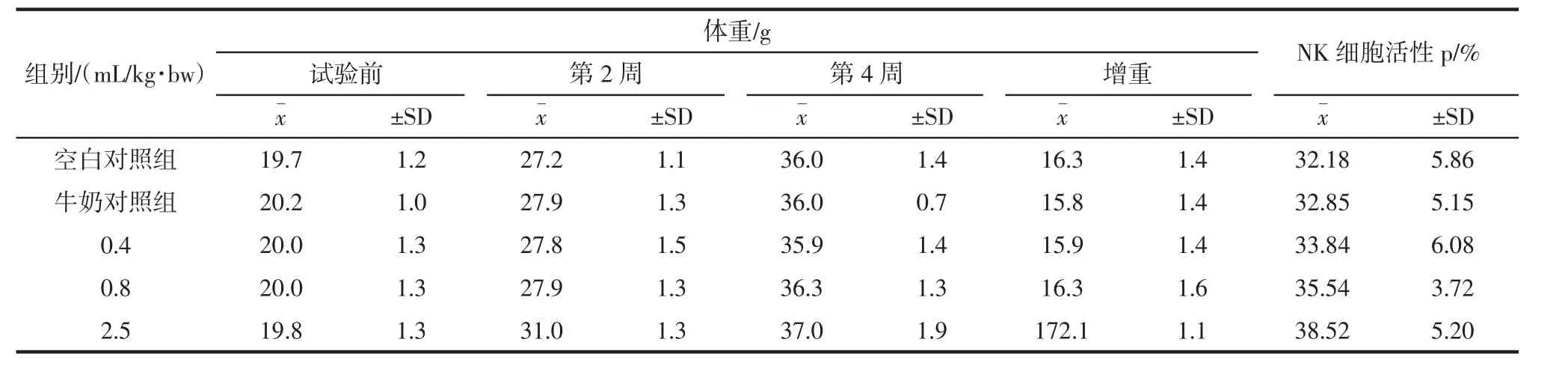
表6 功能牛奶对小鼠NK细胞活性的影响(n=10)Table 6 Effect of functional milk on activity of NK cells of mice
3 结论
本次试验从细胞免疫、体液免疫、单核-巨噬细胞功能及NK细胞活性4个方面,对功能牛奶的免疫功能的调节作用进行了研究。结果表明,不同剂量的功能牛奶对小鼠的体重差异无显著影响;0.8 mL/kg·bw剂量组对于提高巨噬细胞吞噬能力有显著作用;2.5 mL/kg·bw剂量组对提高小鼠脾淋巴细胞转化、增强小鼠迟发型变态反应、增加溶血空斑数和抗体体积、以及提高小鼠碳廓清能力和巨噬细胞吞噬能力,提高NK细胞活性均有显著作用。该研究证明功能牛奶能全面提高机体免疫能力,且具有食用安全性。
:
[1]张帆,汪会玲,孟晶.低聚果糖对人体肠道菌群的影响[J].现代预防医学,2006,33(2):158-159
[2]Gibson G R,Beatty E B,Wang X,et al.Selective stimulation of Bifidobacterium in the human colon by oligofructose and inulin[J].Gastroenterology,1995,108(4):975-982
[3]郭明若,S Gokavi,程建军,等.益生素、益生菌与结肠癌[J].中国乳品工业,2006,34(3):26-31
[4]罗培林,郑萍,何军,等.不同硒源及硒水平对大鼠生长性能、血清抗氧化能力和组织硒沉积的影响[J].动物营养学报,2012,24(7):1-9
[5]凌关庭.保健食品原料手册[M].2版.北京:化学工业出版社,2007:13
[6]林学颜,张玲.现代细胞与分子免疫学[M].2版.北京:科学出版社,2000:75
[7]李荣,李俊,胡成穆,等.橙皮苷对免疫功能低下小鼠免疫调节作用的试验研究[J].中国药理学通报,2007,23(2):169-172
[8]Ki HK,Kyung IK,Woo JJ,etal.In vitro and in vivo effects of macrophage-stimulatopolysaceharidefrom leavesofPerilla frutescens var.crispa[J].Biol Phann Bull,2002,25(1):367-371
[9]朱奇,郭善利,刘国富,等.双歧因子人工蜂粮保健食品对小鼠免疫功能的影响[J].食品科技,2004(6):101-103
[10]杭锋,伍剑锋,龚广予,等.不同剂量蔗果低聚糖对小鼠免疫调节的研究[J].乳品科学与技术,2009,138(5):101-103

