烧结温度对硅藻土基陶瓷砖吸湿和放湿性能的影响
高风辉, 苏立明, 林 健, 赵 宇, 金松哲*
0 引 言
硅藻土是古代硅藻遗体组成的硅质沉积岩,其化学主要成分是SiO2,且含有少量的Fe2O3,CaO,Al2O3,MgO和有机质等。硅藻有很多不同的形状,如圆盘状、针状、筒状和羽状等[1]。硅藻土在世界上储量非常丰富,并且具有很好的物理性质,如多孔性(25%~65%)、小尺寸、低导热性、低密度、大的比表面和高吸附能力[2]。由于硅藻土良好的吸附特性和较大的比表面积,硅藻土及其改性硅藻土在工业废水处理中得到了广泛的应用。Khraisheh[3]等研究了硅藻土和改性硅藻土在污水中Pb2+,Cu2+和Cd2+的吸附作用。同时,硅藻土在被海啸中铯-137污染的海水的净化中起到良好效果[4]。硅藻土对水溶液中的铀离子的吸附也有重要的作用[5]。用水铁矿改性过的硅藻土,比表面大大增加,可以用作湖泊河流污水中磷的吸收,进而预防超富营养化的出现[6]。硅藻土在土壤改性中起到重要作用,能大大地提高土壤的吸水能力[7]。
室内湿度和健康紧紧相连,当环境湿度低于30%时,皮肤喉咙会感到干燥,眼睛受到刺激。当环境湿度较高时,人们会感到呼吸困难,甚至过敏,同时,建筑材料质量也会受到影响,如霉菌生长等[8]。国内,以硅藻土为环保饰材还没有得到大量的推广应用,相关技术研究也才刚刚起步。
文中就是以硅藻土为主要原料,加入少量的长石、粘土、滑石和膨润土等,通过压制成型、烧结,制备出具有吸湿和放湿功能的环保陶瓷砖,并研究了不同烧结温度对陶瓷砖的密度、抗压强度及吸湿和放湿性能的影响。
1 试验方法及过程
本实验采用吉林省临江市硅藻土作为主要原料,加入长石、粘土、滑石和膨润土。采用湿法混合2h后在105℃下烘干,经过压片制成60mm×60mm×8mm压坯,分别在900~1 080℃进行烧结。
烧结样品采用阿基米德法测量密度。用JSM-5600LV型扫描电子显微镜(FESEM)观察硅藻土陶瓷砖的组织和孔隙状态。用三点弯曲法测试样品的抗压强度。恒温恒湿试验箱(HDHWHS-50)测陶瓷砖的吸湿和放湿能力,实验温度为25℃。
2 实验结果
2.1 不同烧结温度下的组织
烧结温度对陶瓷砖组织的影响如图1所示。

图1 烧结温度对陶瓷砖组织的影响
由图1(a)可以看出,在900℃烧结温度下样品颗粒细小,孔隙数量较多。随着烧结温度的增加,陶瓷砖中颗粒逐渐变大,孔隙减少(见图1(b)~(d))。
2.2 烧结温度对陶瓷砖密度的影响
密度随烧结温度的变化曲线如图2所示。

图2 密度随烧结温度的变化曲线
由图2可知,样品的密度随着烧结温度的提高而显著增加。这表明,随着温度的增高,样品中的孔隙逐渐减少,烧结使得陶瓷砖变得更加致密。密度变化趋势和SEM形貌观察结果一致。
2.3 烧结温度对抗压强度的影响
不同温度烧结的陶瓷试样抗压强度见表1。

表1 不同温度烧结的陶瓷试样抗压强度
由表1可以看出,随着温度的提高,样品的抗压强度不断提高,当温度超过1 020℃时,样品升高的程度减小。表明随着温度的升高,样品的烧结程度逐渐提高,晶粒变大,密度增加,进而提高了样品的抗压强度。
2.4 烧结温度对陶瓷砖吸湿和放湿性能的影响
硅藻土陶瓷的吸湿量和放湿量随烧结温度的变化曲线如图3所示。
由图3可知,陶瓷砖的吸湿量随着烧结温度的增加而减小。当温度为900℃时,陶瓷砖的吸湿量为32mg/g;当温度为1 080℃时,陶瓷砖的吸湿量为5mg/g。同样,陶瓷砖的放湿量随着烧结温度的增加而减少,在温度为900℃时,陶瓷砖的放湿量为30mg/g;当温度为1 080℃时,陶瓷砖的放湿量为4mg/g。这是因为随着烧结温度的提高,样品的颗粒逐渐变大,烧结程度增大,孔隙数量减少。

图3 吸湿量和放湿量随烧结温度的变化曲线
根据开尔文方程[9]:
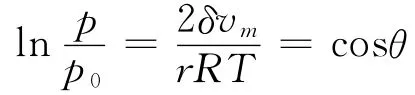
式中:p——液体在毛细管内的蒸汽压力;
r——毛细管半径;
p0——液体的饱和蒸汽压;
δ——表面张力;
vm——气体的摩尔体积;
θ——毛细管内液体的润湿接触角;
R——摩尔气体常数;
T——热力学温度。
文中硅藻土陶瓷砖的吸湿和放湿实验结果基本符合上述规律。当烧结温度逐渐升高时,陶瓷砖内的孔隙逐渐变少,毛细凝集现象更难发生,相应的吸湿和放湿性能逐渐减弱。
3 结 语
本研究通过以硅藻土、钾长石、粘土、滑石和膨润土为原料作为助溶剂,通过湿法混合、烘干、压制、烧结,成功制备出了具有吸湿和放湿功能的硅藻土基陶瓷砖。
随着烧结温度的提高,陶瓷砖的密度、抗压强度不断提高,吸湿和放湿能力逐渐降低。当温度在900℃时,陶瓷砖的密度为1.350 7g/cm3,抗压强度为4.58MPa,最大吸湿量为32mg/g,最大放湿量为30mg/g。
[1] 秦玉明,李远才.装饰性硅藻土基陶瓷的制备和表征[J].中国陶瓷,2007,43(2):38-40.
[2] M Aivalioti,P Papoulias,A Kousaiti,et al.Adsorption of BTEX,MTBE and TAME on natural and modi?ed diatomite[J].J .Hazard Mater,2012,207:117-127.
[3] M A M Khraisheh,Y S Al-degs,W A M Mcminn.Remediation of wastewater containing heavy metals using raw and modi?ed diatomite[J].Chem.Eng.J.,2004,99:177-184.
[4] B Y Hu,B Fugetsu,H W Yu,et al.Prussian blue caged in spongiform adsorbents using diatomite and carbon nanotubes for elimination of cesium[J].J.Hazard Mater,2012,217:85-91.
[5] M Sprynskyy,I Kovalchuk,B Buszewski.The separation of uranium ions by natural and modi?ed diatomite from aqueous solution[J].J.Hazard Mater,2010,181:700-707.
[6] W H Xiong,J Peng.Development and characterization of ferrihydrite-modified diatomite as a phosphorus adsorbent[J].Water Res.,2008,42:4869-4877.
[7] E L Aksakal,I Angin,T Oztas.Effects of diatomite on soil physical properties[J].Catena,2012,88:1-5.
[8] Z H Rao,S F Wang,Z G Zhang.Energy saving latent heat storage and environmental friendly humidity-controlled materials for indoor climate[J].Renewable and Sustainable Energy Reviews,2012,16:3136-3149.
[9] S J Gregg,K S W Sing.Adsorption[J].Surface Area and Porosity,1982,2:23-28.

