TiO2/石英砂双掺Cu-Fe的光催化性能研究
严九洲, 朱鹏飞*, 王 斯, 刘祎飞,韦宝杰, 张 勇, 张 丹, 魏俊男
0 引 言
目前,我国的水环境污染已经十分严重,主要是来自于工业排污及废弃物引起的水污染和城市生活垃圾引起的水污染。在工业废水中,尤其是以含酚废水的污染较为严重。化学-物理方法和生物处理均已成功地用于处理较浓的含酚废水,但是,对于较稀的含酚废水的处理,目前尚处于研究阶段[1]。TiO2半导体光催化是近年来出现的一种先进的水处理技术,能破坏有机污染物,没有二次污染,可将污染物转化成无毒、无味的CO2,H2O及一些简单的无机物小分子,这为消除环境污染和水处理开辟了一条新的途径。但是传统的TiO2光催化技术由于光催化剂容易在水中团聚而降低其活性,且不利于回收[2],因而限制了其实际应用。此外,单纯的TiO2半导体光催化剂还存在一些缺陷,主要表现在:①带隙较宽,仅能吸收紫外光,在可见光范围没有响应,对太阳光利用率低(约3%~5%);②光生载流子的复合率高,光催化效率较低。这些缺陷限制了TiO2光催化剂的应用前景。大量的深入研究表明,采用金属掺杂等技术对光催化剂进行表面修饰或改性处理,可以减小光催化材料的禁带宽度,扩展其光响应范围[3]。本实验采用溶胶-凝胶法方法制备了Cu-Fe共掺杂TiO2/石英砂复合光催化剂处理苯酚废水,选择出了最佳的催化剂制备方法,系统地研究了反应条件对Cu-Fe共掺杂TiO2/石英砂复合光催化材料处理模拟苯酚废水光催化降解性能的影响因素,确定了最佳光催化降解条件。
1 实验部分
1.1 主要原料,试剂和仪器
1.1.1 原料和试剂
石英砂载体由福建省泉州市滨海石英砂有限公司生产,其主要理化性质为:硬度7,密度为2.65,堆积密度(1~20目为1.6,20~200目为1.5),其化学、热学和机械性能具有明显的异向性,不溶于酸,微溶于KOH溶液,熔点1 750℃;
无水乙醇、苯酚、钛酸丁酯、硝酸铜、硝酸铁均为分析纯,成都市化工试剂厂生产。
1.1.2 主要仪器
101-2A型电热鼓风干燥箱,日本岛津公司UV-1800双光束紫外分光光度计;
WM-2H型无油气体压缩机;
SX2-8-10型马弗炉;
78-1型磁力搅拌器;800电动离心机。
1.2 催化剂的制备和性能评价
1.2.1 催化剂的制备
采用溶胶-凝胶的方法制备 Cu-Fe-TiO2/石英砂负载型复合光催化剂。
取40mL无水乙醇于烧杯中,加入0.616g硝酸铜晶体和0.231 2g硝酸铁晶体,搅拌至其完全溶解后得A液。另取一烧杯,加入120mL无水乙醇,再加入34mL酞酸丁酯,用浓硝酸调节溶液的pH值至1.0~2.0,用磁力搅拌器搅拌并醇化0.5h,得黄色B液。快速搅拌下将B液逐渐滴入A液,滴加完毕后,继续搅拌得透明溶胶。0.5h后向上述溶胶中少量多次地加入8.0g石英砂,继续搅拌,并在搅拌过程中或加入少量纯水,直至形成凝胶,静置过夜,水洗离心。将洗涤后的沉淀产物于80℃下烘干,将干燥后的产物经研磨后称取适量置于马沸炉中焙烧。分别在350,400,450,500,550,600℃下焙烧2h。制得不同焙烧温度下的TiO2光催化剂,用作考察温度对催化剂性能的影响。由此制得Cu掺杂量为1.0%(质量分数),Fe掺杂量为0.2%(质量分数),TiO2和石英砂的质量比为1∶1的 Cu-Fe-TiO2/石英砂负载型复合光催化剂。
1.2.2 吸光度法评价催化剂性能
配置5,10,15,20,25,50mg/L不同浓度的苯酚溶液,用于评价催化剂对不同浓度苯酚溶液的催化性能。取50mL苯酚溶液于烧杯中,并加入同一温度下焙烧的催化剂0.16g,调节pH值至3.0~4.0,将烧杯放置于紫外光反应箱中照射(以30W汞灯作为紫外光),并用空气泵通入恒定流量的空气,使催化剂悬浮以便与溶液充分接触,进行光催化氧化反应数小时后于离心管中离心,离心结束后取2mL上层清液于50mL容量瓶中,依次加入1mL缓冲液、2mL显色剂4-AAP,1mL铁氰化钾溶液,定容。取该溶液于507nm测定其吸光度。由反应前的吸光度A1和反应后的吸光度A2,通过公式

计算降解率,以降解率高低来评价催化活性。
2 结果与讨论
2.1 焙烧温度对催化剂活性的影响
不同焙烧温度制备的Cu-Fe-TiO2/石英砂复合光催化剂在常温下、pH值3.0~4.0左右、催化剂投入量3g/L,对初始浓度为50mg/L的苯酚废水溶液紫外光催化6h后的降解率评价结果如图1所示。

图1 不同焙烧温度对催化剂活性的影响
由图1可知,当焙烧温度较低时,催化剂活性较低,当焙烧温度升高至500℃时,催化剂对苯酚的降解率达到最高为8.3%;当焙烧温度高于500℃时,随着焙烧温度的继续升高,复合光催化剂对苯酚的降解率反而降低。由此可知,催化的最佳焙烧温度为500℃。出现上述现象的原因可能是当焙烧温度较低时,催化剂结晶度较低,光生电子与空穴易复合,并且由于焙烧温度过低,导致催化剂表面可能被一些还未完全分解的物质覆盖,导致催化剂的活性中心与苯酚分子接触面积和几率减小,故催化剂光催化活性较低[4]。随着焙烧温度的升高,催化剂结晶度增强,且表面的杂质被分解或脱附,催化剂的有效比表面积增大,活性中心数目增多,使得催化剂活性得以提高。但随着焙烧温度继续增高(>500℃),催化剂活性迅速下降,这是由于温度过高会导致TiO2粒子与石英砂中的Na+,Mg2+等金属离子形成催化活性较低的钛酸盐,由于这些金属离子的钛酸盐是光生电子与空穴的复合中心[5],所以导致光催化效果下降。此外,温度过高还可能会导致催化剂晶粒变大,石英砂层间结构卷曲坍塌,从而使复合光催化剂的比表面积减小,催化剂活性降低。因此,在接下来的实验中选用焙烧温度为500℃的光催化剂进行实验。
2.2 苯酚废水溶液浓度对降解率的影响
Cu-Fe-TiO2/石英砂复合光催 化剂在常 温下,pH 值3.0~4.0左右,催化剂投入量3g/L,对不同初始浓度的苯酚废水溶液紫外光催化6h后的降解率评价结果如图2所示。
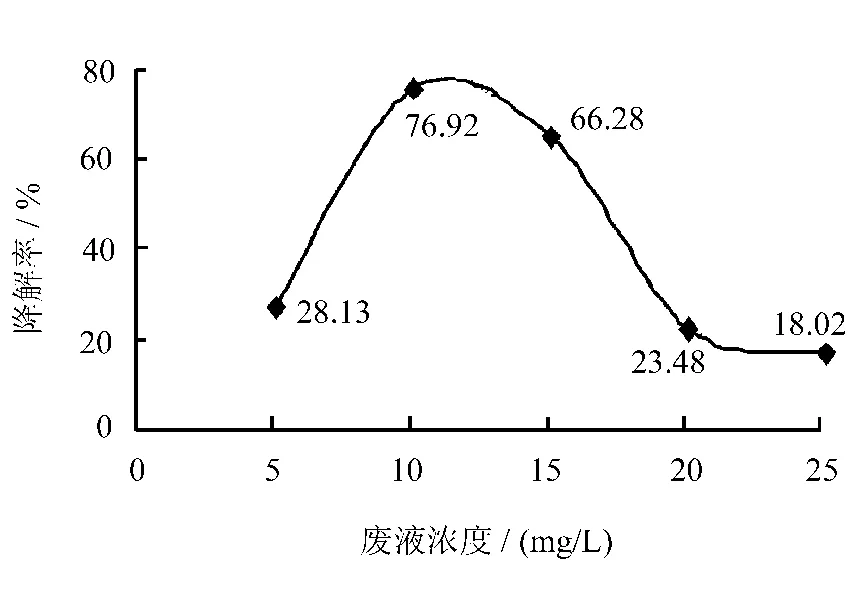
图2 苯酚废水初始浓度对降解率的影响
由图2可知,苯酚废水的降解率在废液浓度5~25mg/L的范围内,随废液浓度的增加先缓慢增大后缓慢降低,这可能是当苯酚浓度增大后,溶液中苯酚分子数目增多,而在催化剂数量一定的情况下,苯酚分子在催化剂表面的吸附竞争激烈程度增大[6],导致其催化活性下降。结合实验结果和工业处理要求,在接下来的实验中选取降解较高,其初始浓度也较高的10mg/L的苯酚废水进行催化活性评价。
2.3 催化剂用量对催化活性的影响
为考察光催化剂投入量对Cu-Fe-TiO2/石英砂复合光催化剂催化性能的影响,分别以催化剂投入量为2.6,3.2,3.8,4.4,5.0g/L称取相应克数的Cu-Fe-TiO2/石英砂光催化剂,加入到初始浓度10mg/L苯酚废水中,混合均匀后在紫外光照下进行光催化降解反应7.5h,评价其降解率,得到光催化剂投入量对催化剂催化降解苯酚废水的脱色率曲线,实验结果如图3所示。
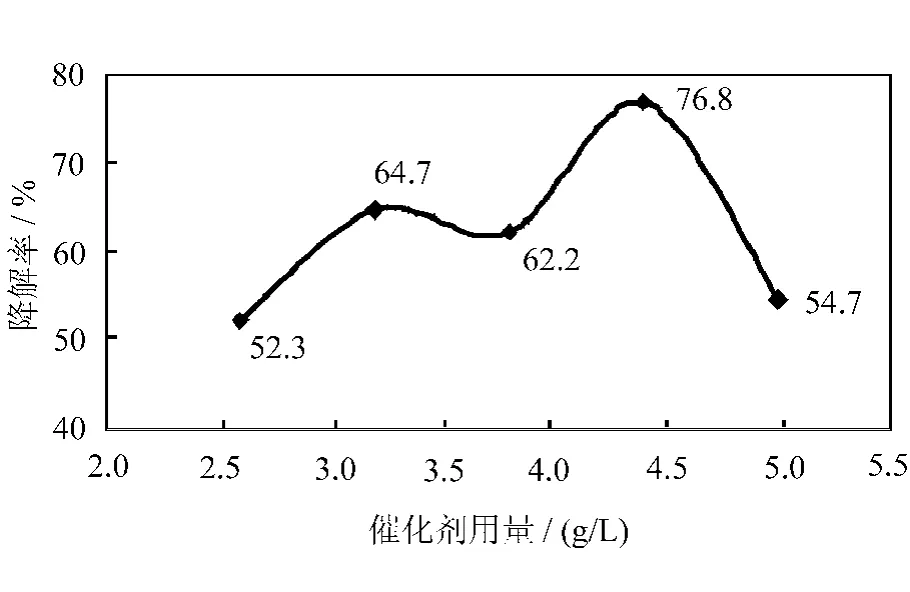
图3 不同催化剂用量对降解率的影响
由图3可知,催化剂用量在2.5~3.8g/L的范围内,苯酚废水的降解率随 Cu-Fe-TiO2/石英砂光催化剂用量的增加先增大后降低[7],催化剂用量在3.8~5.0g/L的范围内,苯酚废水的降解率同样随催化剂用量的增加,先增加后降低。其中出现了两个峰值及催化剂用量为3.3g/L和4.4g/L,其原因为该吸附不是单分子吸附[8]。降解率随催化剂用量增加而增大的原因是Cu-Fe-TiO2/石英砂光催化剂用量增多,则其生成的光生电子-空穴对也就增多,这样就会促使更多的羟基自由基·OH的生成,从而加快反应的进行。但是当光催化剂加入量达到3.3g/L和4.4g/L后,若再增加光催化剂的用量,光降解率则会下降,这可能是因为光催化剂的浓度过大,对入射的紫外光产生了屏蔽和散射的作用,降低了光源发射的光子对光催化剂的激发效率[9],影响溶液内部的催化剂颗粒对紫外光的吸收,从而导致苯酚废水降解率的下降[10]。由于3.3g/L和4.4g/L的降解率相差不大,因此从经济上来讲,催化剂的加入量应选择3.3g/L为宜。
2.4 不同pH值对 Cu-Fe-TiO2/膨润土光催化剂活性的影响
常温下,平行称取4份0.16g Cu-Fe-TiO2/膨润土复合光催化剂于50mL浓度为50mg/L的苯酚溶液中,用盐酸调至不同的pH值,分别在紫外灯照射下反应6h,原始数据记录见表1。

表1 不同的pH值的吸光度和降解率
降解率结果如图4所示。

图4 废液初始pH值对苯酚降解效率的影响
由图4可以看出,其它条件相同的情况下,在pH=2.0~4.0的范围内,随着pH 值升高,苯酚的降解率升高;当pH=4.0~5.0时,降解率下降。出现以上结果可能是由以下两个原因导致的。其中一个原因可能是pH值的变化会影响苯酚的离解平衡[11],同时溶液中的H+浓度的大小也会影响苯酚羟基自由基(OH·)的形成,进而影响苯酚的降解率。另一个原因可能和TiO2是一种两性化合物有关,在溶液中TiO2能与水形成钛醇键[12],这种钛醇键是一种二元酸,存在酸碱平衡,因此催化剂活性受pH影响。当溶液酸性较强时,TiO2表面带正电,有利于光生电子向催化剂表面迁移,与表面吸附O2反应生成O-2,抑制电子与空穴复合,从而可提高光催化剂活性。综上可知,苯酚的pH应选取3.0~4.0。
3 结 语
1)本项实验通过铜铁双金属掺杂,在半导体TiO2表面引入缺陷位置或改变结晶度,从而在半导体表面引入一定数量的电子或空穴的陷阱,延长其寿命,以达到提高复合光催化剂的催化活性和可见光利用率的目的。同时,在催化剂的制备中,本实验选用石英砂作为载体,也为目前复合光催化剂工业化应用的不易回收问题的解决提供了新思路。这将进一步推进复合光催化剂在环境污染治理方面应用的进程。
2)实验通过溶胶-凝胶法制备了铜铁双金属掺杂的TiO2/石英砂光催化剂,重点考察了反应条件对光催化剂降解苯酚活性的影响,得出催化剂的最佳反应条件为:焙烧温度500℃,废水浓度10mg/L,催化剂用量3.3g/L,pH 值3.0~4.0,在该反应条件下对苯酚的降解率可达到91.7%,有一定的应用价值。
[1] 王大文,钟顺和.二氧化碳和丙烯直接合成甲基丙烯酸CuPW/TiO2催化剂的研究[J].燃料化学学报,2004,32(2):219-224.
[2] 崔玉民,韩金霞.光催化降解水中有机污染物研究现状与展望[J].燃料化学学报,2004,32(2):123-128.
[3] 梅长松,钟顺和.Cu/MoO3-TiO2光催化 CO2与C3H6反应合成甲基丙烯酸的性能[J].催化学报,2004,25(12):937-942.
[4] 严九洲.测定空气阻力系数新方法[J].长春工业大学学报:自然科学版,2012,33(2):200-204.
[5] 王春明,赵璧英,谢有畅.盐类和氧化物在载体上自发单层分散研究新进展[J].催化学报,2003,24(6):475-482.
[6] 刘成林,钟菊花,李远光,等.TiO2/SnO2复合氧化物的制备和光谱特性[J].光谱学与光谱分析,2005,25(12):1947-1949.
[7] 梅长松,钟顺和.Cu/SnO2-TiO2催化剂的结构、光吸收性能和催化反应性能[J].化学物理学报,2005,18(5):821-826.
[8] 李爱昌,崔志鹏,李文菊.Ag-TiO2/SnO2纳米薄膜的制备及其光催化降解罗丹明B的性能[J].稀有金属材料与工程,2009,38(2):304-307.
[9] 张东丽.掺铜TiO2/膨润土光催化剂的制备及其光催化性能研究[J].吉林大学学报:地球科学版,2009,39(5):913-917.
[10] 黄丽华.纳米TiO2光催化降解直接耐晒蓝的研究[J].环境化学,2003,22(4):359-363.
[11] Ohno T,Murakami N,Tsubota T,et al.Development of metal cation compound-loaded s-doped TiO2photo catalysts having a rutile phase under visible light[J].Applied Catalysis A:General,2008,349(1/2):70-75.
[12] Xin B,Wang P,Ding D,et al.Effect of surface species on Cu-TiO2photo catalytic activity[J].Applied Surface Science,2008,254(9):2569-2574.

