有机电致发光材料9-(1-萘基)-10-(2-萘基)蒽的合成及表征
杨 杰,吕宏飞
(黑龙江省科学院石油化学研究院,哈尔滨 150040)
有机电致发光器件(OLED)与其他显示器件相比具有自发光,不需要背景光源和滤光片,功耗低,低驱动电压(3~10 V),宽视角,响应速度快等特点,已成功应用于以手机为代表的小尺寸显示领域,并向电视、显示器等领域拓展[1-4]。
在全彩OLED平板显示领域,高效率和高纯度的红、蓝、绿三原色发光材料扮演着极其重要的角色。其中蓝光材料不仅是蓝色光源的重要组成部分,而且还可作为绿光和红光材料能量转移掺杂的主体发光材料[5,6]。迄今为止,人们一直致力于开发新型蓝色磷光或者荧光材料。然而,蓝色荧光材料因为化合物本身的不稳定性以及色彩纯度问题,迟迟未能有所突破,与已经达到商业化要求的绿光材料相比,高效率和长寿命的蓝光材料与器件,特别是深蓝光材料与相应器件相对还比较缺乏[7,8],因此,新型深蓝光材料的研究与开发,成为目前OLED行业普遍关注的焦点。
自从蒽作为蓝色有机电致发光器件的鼻祖级材料诞生以来,因其独特的载流子平衡特性,受到学者们广泛关注[9,10]。但蒽太容易结晶而不易形成无定形膜。而二萘基蒽类衍生物作为一种稳定高效的蓝光主体发光材料在主客体掺杂体系器件中显示出较好的应用前景[11-13]。
笔者采用9-溴蒽,1-萘硼酸,2-萘硼酸为原料,通过Suzuki偶联反应制备了9-(1-萘基)-10-(2-萘基)蒽(α,β-ADN),采用红外、核磁对其结构进行了表征,采用紫外和荧光光谱对其发光性能进行了研究。
1 试验部分
1.1 试验试剂与仪器
试验所用9 -溴蒽,NBS,K2CO3,Pd(PPh3)4及甲苯均为市售,未经说明,无须特殊处理;1-萘硼酸及2-萘硼酸为自制。
液相色谱分析采用戴安U-3000高效液相色谱仪,分析条件为C18色谱柱,流动相为100%甲醇,流速1 mL/min,柱温35℃,二极管阵列检测器;采用美国PE公司100型傅里叶红外仪进行分析,溴化钾压片;采用UV-2450紫外可见漫反射光谱分析仪(日本Shimadzu公司)进行紫外光谱分析,波长扫描范围为230~800 nm;采用日立F7000荧光光度计进行荧光光谱分析。热重分析采用PE Diamond热分析仪进行,N2气氛,升温速率为10℃/min,温度区间为50℃ ~600℃。
1.2 产品合成
1.2.1 1 -萘硼酸的合成
1 -萘硼酸的合成路线如图1所示:

图1 1-萘硼酸的合成Fig.1 Synthesis of1 -naphthylboronic acid
将30 g1-溴萘溶于200 mL的THF中,盛于恒压滴液漏斗中,N2气保护下,将4.88 g干燥过的镁条加入到250 mL三口烧瓶中,保持N2流通,加入少量的1-溴萘溶液,微热使其引发,将配好的1-溴萘-THF溶液在N2气气氛下向体系内缓慢滴加,放热,保持微回流,滴加完毕后持续搅拌2 h,形成均匀的褐色溶液,用于下一步合成使用。
100 mLTHF加入500 mL三口瓶中,冷却至-50℃,将19.85 g硼酸三甲脂加入到上述体系内,将上述制备好的1-萘基溴化镁溶液向体系内滴加,控制温度,加完后继续搅拌30 min后,自然升温至室温下搅拌12 h,形成乳白色的络合物后,进行水解,酸化,分出水层,有机相经无水硫酸镁干燥后,蒸干有机溶剂,石油醚洗涤,干燥后重结晶得21.2g白色固体,产率达到91.11%,高效液相色谱检纯度为98.73%。
1.2.2 2 -萘硼酸的合成
2 -萘硼酸的基本合成路线如图2所示:
2 -萘硼酸的合成方法同上,收率为92.43%,纯度为99.26%(HPLC)。
1.2.3 α,β -ADN 的合成
α,β-ADN的基本合成路线如图3所示。

图2 2-萘硼酸的合成Fig.2 Synthesis of 2 - naphthylboronic acid
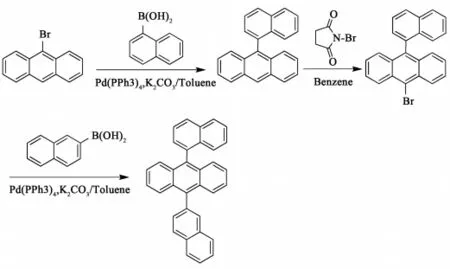
图3 α,β-ADN的合成Fig.3 Synthesis ofα,β -ADN
在装有搅拌、冷凝器、温度计的500 ml四口瓶中,加入200 mL甲苯、61 mLH2O、20 g9 -溴蒽、15.1 g1 -萘硼酸、21.5 g K2CO3,N2保护下,加入 0.89 g Pd(PPh3)4,搅拌加热至回流,HPLC监测至反应完全,自然降温,静置分液,有机相水洗干燥后浓缩,得粗品22.5 g,重结晶后得到10-(1-萘基)蒽白色固体粉末22.2 g,纯度为99.4%(HPLC),收率91%。
将20 g 10-(1 -萘基)蒽、12.4 g NBS、150 mL 苯放入装有搅拌、冷凝器和温度计的500 mL三口瓶中,水浴加热至回流,HPLC监控至反应完毕。旋转蒸发蒸出苯,得9-溴-10-(1-萘基)蒽黄色固体粉末24.5 g,收率97.3%,无须再处理即可进行下步反应。
9 -溴-10-(1-萘基)蒽同2-萘硼酸Suzuki偶联反应条件和前述Suzuki偶联反应条件相同。合成收率95.64%,产品纯度99.12%。FT-IR:3040 cm-1为芳环上C-H键伸缩振动峰,2000 ~1600 cm-1为芳烃泛频峰,1627 cm-1、1594 cm-1为芳环上 C -C 骨架面内伸缩振动峰,1502 cm-1、1435 cm-1、1362 cm-1为芳环内C -C伸缩振动峰,797 cm-1、775 cm-1、757 cm-1为芳环上C-H面外弯曲振动峰。
2 结果与讨论
2.1 光谱分析和发光行为
2.1.1 紫外—可见吸收光谱
α,β-ADN的紫外—可见吸收光谱示于图4。
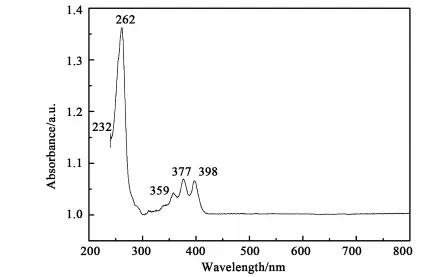
图4 α,β-ADN的UV-Vis DRS谱图Fig.4 UV -Vis DRSspectra ofα,β -ADN
由图可见,α,β-ADN存在2个吸收谱带,E带有2个吸收峰:E1带吸收峰在232 nm,E2带吸收峰在262 nm;B带有3个吸收峰,属于B带精细结构。这种精细结构是由π-π*电子跃迁产生的吸收和芳环振动跃迁吸收叠加在一起的结果。其波长分别在359 nm,377 nm,398 nm。同蒽(吸收峰:311 nm、326 nm、341 nm、359 nm、378 nm)比较,在蒽的9,10 -位取代了萘环后,降低了分子的自身振动,使得蒽的B带的精细结构的前两个峰消失;萘环取代增强了共轭性,分子间轨道重排,降低了π-π*跃迁能隙,使得α,β-ADN的吸收比蒽的红移[14,15]。
2.1.2 荧光光谱
α,β-ADN的氯仿稀溶液采用日立F7000型荧光光谱仪所作的激发和荧光光谱示于图5。
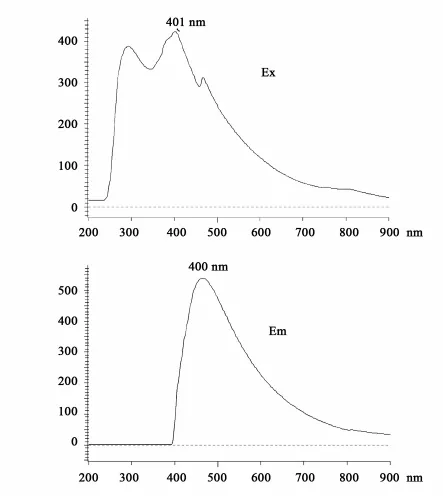
图5 α,β-ADN的激发和发射光谱Fig.5 Excitation and Emission spectra ofα,β -ADN
由图可见,激发谱图的峰值波长为401 nm;荧光发射谱的峰值波长为440 nm,为典型的蓝色荧光。荧光光谱同激发光谱比较有红移,这是由于分子由激发态衰减回到基态之前,激发态分子通过振动弛豫首先衰减到最低激发态S1能级,激发态分子与S1的能量差表现为荧光发射光谱比激发光谱红移[16]。
2.2 热稳定性
α,β-ADN的热重分析示于图6。

图6 α,β-ADN的TG谱图Fig.6 TGspectra ofα,β -ADN
由图可知,α,β-AND的玻璃化转变温度较高,为416.3oC,这样对蓝光器件的制作非常有利[17]。热失重较少,证明α,β-AND这种新材料的热稳定性更好。
3 结论
采用9-溴蒽为原料通过与自制的萘硼酸反应,制备了新型的蓝光材料α,β-AND。通过红外、核磁共振对其结构进行了表征。利用紫外可见吸收光谱、荧光光谱研究了其发光性能。紫外光谱表明三种化合物有两个吸光带,荧光光谱表明其发射蓝色荧光。
[1]HOSOSAWA C,EIDA M,MATSUURA M,et al.Organic multicolor electroluminescence display with finepixals[J].Synth,1997,91(1):3 -7.
[2]城户淳二.有机电致发光——从材料到器件[M].北京:北京大学出版社,2012.
[3]陈金鑫,黄孝文.OLED梦幻显示器——材料与器件[M].北京:人民邮电出版社,2011.
[4]赵坚勇.有机发光二极管OLED显示技术[M].北京:国防工业出版社,2012.
[5]CHENC T,CHIANG C L,LIN Y C.Ortho - substituent effect on fluorescence and electrolumine- scen ce of arylamino-substituted coumarin and stiibene[J].org.Lett,2003,5(8):126l-1264.
[6]安永,徐茂梁,王子俊,等.新型蓝光材料9,9-联蒽衍生物的合成及其光电性能[J].发光学报,2011,32(9):890 - 894.
[7]YUE SHUMEI,LI NA,WANG BINBIN,et al.Syntheses,properties of luminescent complexes with 2-(2-pyridyl)benzimidazole ligands[J].Chin JLumin.,2009,30(6):852 -857.
[8]ZHOU RUI,SONG XINCHAO,TIAN JIE,et al.Synthesis and spectroscopic properties of new blue-phosphorescent iridium com-plexes based on 2-difluorophenyl-4-methylpyridine and 2-(pyridyl-2 - yl)imidazole as ligands[J].Chin J Lumin,2010,31(2):279-284.
[9]WANG ZHEN,CHEN SHUANGWEN,ZHOU XIANG.Study on efficient blue and white organic light- emitting devices[J].Chin JLumin,2010,32(7):715 -719.
[10]SUN LI,SHAOXIBIN,QIN LEI,et al.Emission of electroplex in PVK and its properties under UV irradiation[J].Chin J Lumin,2010,31(6):332 -336.
[11]TAOSL,HONGZR,PENGZ K,et al.Anthracene derivative for a non-doped blue-emitting organic electroluminescence device with both excellent color purity high efficiency[J].Chem Phys Lett,2004,397(1):1 -4.
[12]WANG ZHIQIANG,ZHU YANYAN,HUANG DA,et al.Synthesis and characterization of the soluble blue-light emitting material 2-tert-butyl-9,10-bis(9,9-Dipropylfuorenyl)anthracene[J].Photographic Science and Photochemistry,2007,25(6):415-421.
[13]FENG LIHENG,WANG XIAOJU,CHEN ZHAOBIN.Anthracene electroluminescence material containing cavity transmission group and preparation method:China,CN101144012A[P].2008 - 03-19.
[14]别国军,柴生勇,刘波,等.蓝光材料9,10-二(2-萘基)蒽的合成与光谱分析[J].液晶与显示,2007,22(3):301-304.
[15]ZHANG X H,LEE C S,WU S,et al.Blue and white organic electroluminescent devices based on 9,10-bis(2-naphthyl)anthracene[J].Chem Phys Lett,2003,369(3 -4):478 -482.
[16]HOSOKAWA C,HIGASHI H,NAKAMURA H,et al.Highly efficient blue electroluminescence from a distyrylene emitting 1ayer with a new dopant[J].Appl Phys Lett,1995,67(26):3853 -3855.
[17]李恒,任天辉,钟庆华,等.新型蓝光材料ADN衍生物的合成及表征[J].化学工业与工程技术,2008,29(5):7- 10.

