过氧化物酶在多孔磁性微球修饰电极上的直接电化学行为研究
谭向恩,赖国松,韩德艳,张海丽
(湖北师范学院 化学与环境工程学院,湖北 黄石 435002)
过氧化物酶是由微生物或植物所产生的一类氧化还原酶,它们能催化很多反应,并参与诸多不同类型的生理过程,如生物活化氧分子和生物合成细胞壁等。所以研究这一类型酶的直接电化学行为,不仅可以模拟生物体内氧化还原系统,而且对理解,认识,揭示其中的电子转移机制具有重要意义[1~2]。但是由于酶分子比较大,结构复杂,氧化还原中心被包裹在蛋白质的多肽链中,很难接近电极表面,同时蛋白质很容易在固体电极表面失活[3]。因此,人们研究各种酶的固定化材料比如纳米材料[4],表面活性剂[5]等,为酶提供适宜的微环境。
近年来,由于一些多孔材料具有均匀的孔径,大的比表面积,良好的生物兼容性和化学稳定性而被广泛的用于酶和蛋白质的固定[6~7]。作为一种重要的纳米材料,磁性纳米粒子因其优良的性质近年来越来越得到广泛关注,并先后在包括酶固定在内的许多领域得到成功应用[8]。壳聚糖具有许多优良的性质生物兼容性、低毒性、化学惰性和优异的成膜能力,常在传感器的制备中用作成膜材料[9]。本文按文献[10]合成了一种多孔的壳聚糖磁性微球(PMMS),并研究了过氧化物酶(POD)在修饰了多孔壳聚糖磁性微球的碳糊电极(CPE)上的直接电化学行为。
1 实验部分
1.1 试剂与仪器
壳聚糖(脱乙酰度≥90%)(深圳伯奥生命科技公司);过氧化物酶(POD)(美国Sigma公司);过氧化氢(H2O2,30%),购于武汉华飞化学试剂公司,其准确浓度通过高锰酸钾滴定法得到;25% 戊二醛;0.1 mol·L-1的磷酸盐缓冲溶液 (PBS) 通过Na2HPO4和NaH2PO4配制而成并用0.1 mol·L-1的NaOH或H3PO4溶液调节合适的pH值。0.10 mol·L-1KCl的5.0m mol·L-1K3Fe(CN)6/K4Fe(CN)6(1∶1) 溶液;其它试剂均为分析纯,实验用水为二次蒸馏水。CHI830B 型电化学工作站(上海辰华仪器公司);三电极系统:饱和甘汞电极为参比电极,铂电极为辅助电极,修饰电极为工作电极。
1.2 修饰电极的制备
将1.8∶1(m∶m)光谱纯石墨粉和石蜡油在玛瑙研钵中充分混匀,然后将此碳糊均匀地填入内径为2 mm的玻璃管中并与其中的铜棒压紧,抛光纸磨平后制得CPE.称10.0 mg多孔磁性高分子微球(PMMS)于2 mL含5%戊二醛溶液中,超声分散一段时间后得到5.0 mg·mL-1的均匀分散液。移取5μL该分散液滴加到预处理好的碳糊电极表面,晾干后滴加8μL的POD溶液(8.0 mg·mL-1,溶于0.1 mol·L-1的pH 7.5 PBS中)。该电极在室温下置于空气中4h晾干即得到所需的修饰电极POD/PMMS/CPE.
2 结果与讨论
2.1 修饰电极的电化学表征
电化学阻抗(EIS)能够提供电极表面修饰过程中的阻抗变化等有用信息[11]。图1为PMMS修饰电极(a), POD/PMMS修饰电极(b),裸电极(c)在含有0.1 mol·L-1KCl的5.0m mol·L-1K3Fe(CN)6/ K4Fe(CN)6(1∶1)溶液中记录的交流阻抗的Nyquist图。从图中可以看出,PMMS修饰电极的RCT较裸电极有明显减小,说明覆盖在电极表面的微球能够在一定程度上促进[Fe(CN)63-/4-]探针与电极表间的电子传递;而与PMMS修饰电极相比,POD/PMMS修饰电极的阻抗明显增加,说明POD已经成功固定在电极表面。
2.2 过氧化物酶在修饰电极上的电化学行为
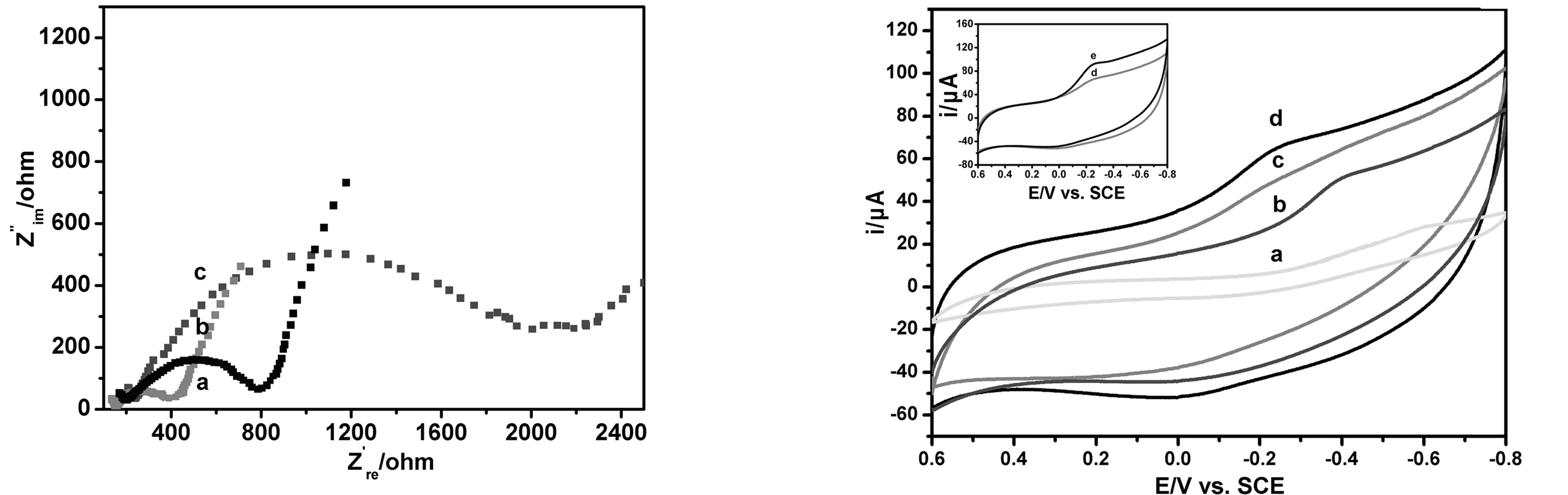
图1 PMMS修饰电极(a),POD/PMMS修饰电极(b),裸电极(c)的交流阻抗图谱
利用循环伏安法研究了POD/PMMS修饰电极的电化学行为。与裸电极(图2a) 相比,POD修饰电极(图2b)峰电流增大,说明POD有一定的电催化还原作用;PMMS修饰电极(图2c)与裸电极(图2a)相比,电流增加,说明PMMS覆盖在裸电极表面,使电极表面积增大。POD/PMMS修饰电极(图2d)与PMMS修饰电极(图2c)相比,还原峰电流明显增大。说明修饰在电极上的多孔磁性高分子微球能够较好的吸附POD.此外,当1.0m mol·L-1H2O2加入到该试验底液中时,POD/PMMS修饰电极的还原峰电流明显增加(图2e),说明该修饰电极对H2O2具有良好的电催化还原作用。
2.3 pH值影响
利用循环伏安法考察PMMS/POD修饰碳糊电极上的伏安行为的影响因素。从pH 5.0到7.5安培电流随着pH值的增大而增大,pH值超过7.5后电流反而减小。实验还表明,随着溶液的pH值增大,H2O2的还原峰电位发生负移,表明此还原过程有质子参与反应,根据实验中峰电位与pH值的线性关系:Epc(V)= 0.1917-0.066pH知,此反应为一电子一质子过程[12]。此氧化还原反应的机理可能为:
PMMS-POD-Fe(III) + e + H+→ PMMS-POD-Fe(II)H
PMMS-POD-Fe(II)H + 1/2 H2O2→ PMMS-POD-Fe(III)+ H2O
2.4 扫速影响
图3为在扫速为20~200 mV·s-1范围内,H2O2在PMMS/POD修饰电极上的峰电流与扫速的平方根成较好线性关系。线性回归方程为:ipc(10-5A) = 0.1323 + 0.5986v1/2(n=9),相关系数R=0.9996.故H2O2在该修饰电极上的电催化还原反应为扩散控制过程。由公式Randles - Sevcik equation:ip=2.69 ×105n3/2D1/2v1/2Ac 计算出扩散系数D为5.03×10-10cm2·s-1.
2.5 安培响应
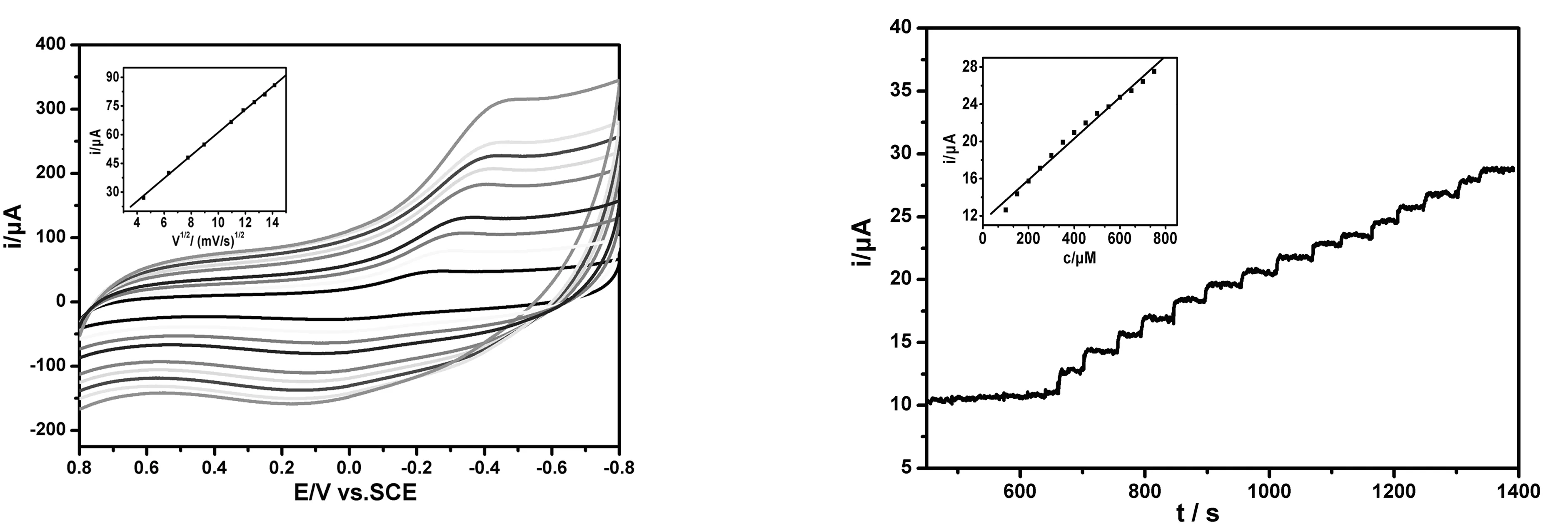
图3 不同扫速下POD/PMMS修饰电极在1.0 m mol·L-1H2O2底液中的循环伏安图,内插图为峰电流与扫速的平方根间的线性关系。(扫速 v=20, 40, 60, 80, 120, 140,160, 180,200 mV s-1)
图4为在-0.45V工作电位下,向缓冲溶液中(搅拌状态下)连续滴加H2O2溶液,POD/PMMS修饰电极对H2O2的稳态安培响应图。内插图为安培电流和H2O2浓度二者间的工作曲线。在0.1~0.8
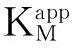
3 结论
将POD酶在戊二醛交联剂作用下固定于多孔磁性高分子微球修饰的碳糊电极的表面,由于多孔状的结构,不但增大了电极的表面积,吸附更多的POD酶,同时孔洞结构使酶的氧化还原中心与电极表面更加接近,壳聚糖良好的生物兼容性很好的保持了酶的活性,为酶的提供了优良的微环境,实现了酶在电极上的直接电化学,该修饰电极对H2O2有响应,具有较好的选择性、稳定性和重现性。
[1]Victor G, Ovadia L. Sol -gel vanadium pentaoxide glucose biosensor [J] . J Am Chem Soc, 1993, 115 (6) : 2533 ~ 2534.
[2]左国防. 辣根过氧化物酶直接电化学研究进展 [J] . 天水师范学院学报(自然科学版), 2007, 27 (5) : 21 ~ 25.
[3]Rusling J F. Enzyme bioelect rochemistry in cast biomembrane like films [J] . Acc Chem Res, 1998, 31 (6) : 363 ~ 369.
[4]Yang Y, Yang M, Wang H, et al. An amperometric horseradish peroxidase inhibition biosensor based on a cysteamine self-assembled monolayer for the determination of sulfides [J]. Sens Actuators B, 2004, 102 (1) : 162 ~ 168.
[5] 徐红艳, 吴华强, 徐冬梅, 等. 碳纳米管负载纳米Ni修饰电极及碱液中电氧化甲醇[J]. 应用化学, 2007, 24 (5) : 503 ~ 506.
[6] Jia N Q , Wen Y L ,Yang G F, et al. Direct electrochemistry and enzymatic activity of hemoglobin immobilized in ordered mesoporous titanium oxide matrix [J]. Electrochemistry Communications,2008, 9 (7) : 774 ~ 777.
[7]LI Y H, Zeng X D, Liu X Y, et al.Direct electrochemistry and electrocatalytic properties of hemoglobin immobilized on a carbon ionic liquid electrode modified with mesoporous molecular sieve MCM-41 [J]. Colloidsand Surfaces B Biointerfaces, 2010, 10 (5): 241 ~ 245
[8]Lai G S, Zhang H L,Han D Y. A novel hydrogenper oxide biosensor based on hemoglobin immobilized on magnetic chitosan microspheres modified electrode [J]. Sensorsand Actuators B, 2008, 129 (1) : 497 ~ 503.
[9]Shi A W,Qu F L,Yang M H,et al. Amperometric H2O2biosensor based on poly-thionine nanowire/HRP/nano-Au-modified glassy carbonelectrode [J]. Sens Actuators B, 2008, 129 (1): 779 ~ 783.
[10]Chen Chen, Yin T T,Chen J , et al. Adsorptive removal of copper ions from aqueous solution using porous magnetic chitosan microspheres [C]. Remote Sensing, Environment and Transportation Engineering (RSETE), 2011 International Conference on, 24-26 June 2011, 7350 ~7353.
[11]Feng J J, Zhao G, Xu J J,et al.Direct electrochemistry and electrocatalysis of hemeproteins immobilized on gold nanoparticles stabilized by chitosan [J]. Anal Biochem, 2005, 342 (2) : 280 ~ 286.
[12]Sedigheh H, Hedayatollah G, Ali A M, et al.Direct electrochemistry of chemically modified catalase immobilized on an oxidatively activated glassy carbon electrode [J]. J Appl Electrochem, 2009, 39 (1) :7 ~ 14.
[13]Lai G S, Zhang H L, Han D Y. Amperometric hydrogen peroxide biosensor based on the immobilization of horseradish peroxidase by carbon-coated iron nanoparticles in combination with chitosan and cross-linking of glutaraldehyde [J]. MicrochimActa, 2009, 165 (1) : 159 ~ 165.
[14]Zhang H L, Lai G S, Han D Y. An amperometric hydrogen peroxide biosensor based on immobilization of horseradish peroxidase on an electrode modified with magnetic dextran microspheres [J]. Anal Bioanal Chem, 2008, 390 (3) : 971 ~ 977.

