西瓜遗传图谱的构建及果形指数QTL分析
王兆吉 高 鹏 栾非时 刘 识
(东北农业大学园艺学院,黑龙江哈尔滨 150030)
果实形状是以鲜果为食用器官的园艺作物产品的市场品质评价、分类及定级的重要考核指标,近年来国内外专家学者对于果实形状QTL定位研究取得了一定的进展。van der Knaap等(2002)分别定位了番茄第2、3条和11条染色体上的果形指数QTL-lifs2,lifs3,lifs11,其中lifs2和lifs11分别是调控果形ovate基因和sun基因的等位基因,这些QTL控制番茄梨形果形。van der Knaap等(2004)通过两个杂交组合试验及精细基因作图,发现在番茄第7条染色体的短臂上有一个sun基因,控制果实形状。Ben-Chaim等(2001,2006)和Zygier等(2005)的研究表明,辣椒果实大小、直径、长度和果形指数间的QTL簇紧密连锁,并且控制果实性状的许多QTL都在同一条染色体上聚集。目前,对于西瓜果实形状的遗传分析和基因定位未见相关报道。在西瓜遗传图谱的构建方面,Shimamoto和Harushima(1996)利用非洲野生类型西瓜SA-1与自交系H-7杂交所获得的F2群体为试验材料构建了世界上的第一张西瓜遗传连锁图谱,覆盖基因组长度为524 cM,图谱中包含有69个RAPD标记、1个同工酶标记、1个RFLP标记和3个形态标记。易克(2002)采用西瓜自交系97103与野生西瓜PI296341为亲本材料构建的重组自交系群体为试验材料,获得了一张覆盖基因组总长度为1 383.8 cM,平均图距为6.8 cM,分属于19个连锁群的遗传连锁图谱,包含86个RAPD标记、24个SSR标记、10个ISSR标记、3个SCAR标记和79个AFLP标记以及1个形态学标记。Hawkings等(2001)利用抗枯萎病西瓜品系NHM与感枯萎病西瓜品系PI296341杂交所获得的F2、F3群体为试验材料,构建出两张覆盖基因组长度分别为112.9 cM和132.0 cM的遗传连锁图谱。
本试验利用圆球形西瓜〔Citrullus lanatus(Thunb.)Matsum. et Nakai〕品系花园母本为母本,椭圆形西瓜品系LSW-177为父本,配制杂交组合获得F2群体,利用SSR分子标记构建遗传连锁图谱,并进行果形指数的QTL分析,以期为今后进一步开展相关基因克隆及应用分子标记辅助育种奠定理论基础。
1 材料与方法
1.1 试验材料
试验的母本材料是由东北农业大学西甜瓜分子育种研究室提供的圆球形西瓜品系花园母本(原产地为中国),试验的父本材料是由美国农业部南部农业研究中心Davis等(2008)提供的椭圆形低糖西瓜品系LSW-177 (原产地为美国)。利用常规方法配制杂交组合获得F1,F1自交获得由180个单株组成的F2群体。
1.2 试验时间与地点
田间试验于2010年3月至2012年8月在东北农业大学香坊实验实习基地进行,2010年3月将两亲本种植于实验实习基地的24号温室内,杂交获得F1种子,8月播种F1,严格自交授粉获得单株F2种子。2011年5月定植两亲本、F1及F2群体于实验实习基地的24号大棚内,其中F2群体采用严格自交授粉及常规田间管理,自花授粉后35 d收获,采收两亲本和F1果实各30株,F2果实180株,分别测定西瓜果实纵径、横径。2011年2~9月在东北农业大学园艺学院西甜瓜分子研究室内进行SSR引物的多态性筛选,两亲本及F2群体的DNA的提取,SSR-PCR扩增电泳检测及谱带分析。
1.3 田间试验设计
分别种植两亲本和F1各30株,每小区种植10株,行距80 cm,株距50 cm,小区面积12 m2,3次重复;随机种植F2群体180株,行距80 cm,株距50 cm,小区面积为90 m2。采用吊蔓栽培,双蔓整枝。
1.4 性状测量方法
果实纵径:用直尺测量成熟西瓜果实的基部边缘到顶部边缘的最大距离。果实横径:用直尺测量成熟西瓜果实纵切面与果实纵轴垂直方向两边缘之间最大距离。西瓜果实纵径与果实横径的比值即为果形指数。
1.5 分子试验设计
2011年春季,在苗期采集母本、父本、F1、F2单株幼嫩真叶2 g,采用改良CTAB法提取西瓜基因组DNA(Luan et al.,2008)。甜瓜SSR引物序列来源于公开发表文献(Danin-Poleg et al.,2001;Fazio et al.,2002;Silberstein et al.,2003;Gonzalo et al.,2005;Zalapa et al.,2007;Fernandez-Silva et al.,2008)和互联网(http://www. ncbi. nlm. nih. gov/dbEST;http://www.icugi.org/)中葫芦科作物EST信息库和中国农业科学院。西瓜SSR引物来源于公开发表文献(易克 等,2003;Joobeur et al.,2006;Zhang Haiying et al. ,2012),总计 1 574对。引物由上海生工生物工程技术服务有限公司合成,西瓜SSR-PCR反应体系参考盛云燕等(2006)和张法惺等(2010)的方法,略有改动。扩增产物用6%变性聚丙烯酰胺凝胶电泳进行检测,记录带型并分析,对分子试验数据进行卡方检验,选择符合1∶2∶1的分子标记,利用Mapmaker/Exp 3.0软件构建遗传连锁图谱,利用MapChart2.1软件绘制连锁遗传图谱。
使用Microsoft®Excel 2003软件进行数据记录和整理,利用DPS软件分析得到频次分布图;利用Windows QTL Cartographer V2.5软件进行QTL分析。
2 结果与分析
2.1 DNA提取和SSR引物筛选
提取两个亲本、F1及F2群体180个单株的DNA,用0.8%琼脂糖凝胶电泳和紫外分光光度计检测,浓度和质量均适用于SSR分子标记。选用1 574对SSR引物对两亲本进行扩增筛选,其中西瓜SSR引物355对(g-SSR引物194对,EST-SSR引物161对),甜瓜SSR引物1 219对(g-SSR引物848对,EST-SSR引物371对),共筛选出与亲本有多态性并能稳定遗传的SSR引物55对,其中包括西瓜SSR引物36对(g-SSR引物32对,EST-SSR引物4对),多态率为10.14%,甜瓜SSR引物19对(g-SSR引物13对,EST-SSR引物6对),多态率为1.56%。
2.2 遗传分析
由表1可知,母本及父本的果形指数平均值分别为1.04、1.51,分别属于圆球形果实和椭圆形果实,可用于QTL分析。F1果形指数平均值为1.06,介于两亲本之间,与母本数值接近。F2群体果形指数大多数介于双亲之间,果形指数平均值为1.18,单株果形指数最高值为1.63,高于双亲,呈现正向超亲优势,最低值为0.92,低于双亲,呈现负向超亲优势。F2群体果形指数分离明显,呈现单峰连续分布,峰度及偏度均小于1,由此可以证明其典型的数量性状特征。对F2群体的果形指数进行分析,运用DPSV7.05软件绘制频次分布图,如图1所示。

表1 两亲本及F1、F2群体果形指数变化
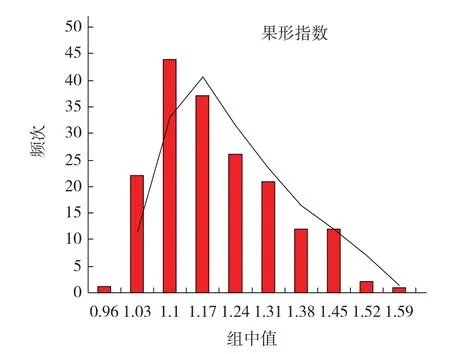
图1 果形指数在F2群体中的分布
2.3 西瓜遗传连锁图谱的构建
按照理论比值1∶2∶1计算F2群体的卡方值,55个标记中有45个标记符合1∶2∶1的理论比值,其中有10个表现出不同程度的偏分离,占总数的18.18%。
运用MAPMAKER/EXP 3.0软件对其中45个标记进行连锁分析,获得了1张包含45个SSR标记,13个连锁群的遗传连锁图谱(图2),图谱总长度547.3 cM,标记间平均距离为12.44 cM,最大的连锁群为第四连锁群,分布9个标记,标记间平均距离为9.85 cM。最长的为第九连锁群,长度为101.10 cM,第八连锁群最短,长度为13.0 cM。
2.4 果形指数的QTL分析
利用花园母本×LSW-177获得的F2群体构建的遗传连锁图谱,结合果形指数的田间数据,采用Windows QTL Cartographer V2.5软件进行QTL分析。结果表明(图2),在第三连锁群上发现了一个与果形指数紧密相关的QTL位点,为加性效应位点。以性状英文缩写、连锁群编号和QTL编号为依据命名,将与果形指数密切相关的1个QTL位点命名为Fsi3.1,该位点位于第三连锁群(图2),图谱位置45.8,在标记MCPI-12和CMN05_69之间,距离MCPI-12和CMN05_69两标记的遗传距离分别为2.4 cM和1.1 cM,LOD值3.1,贡献率为2.8%,加性效应负值(-0.179 1),对减小果形指数表现为增效加性效应。
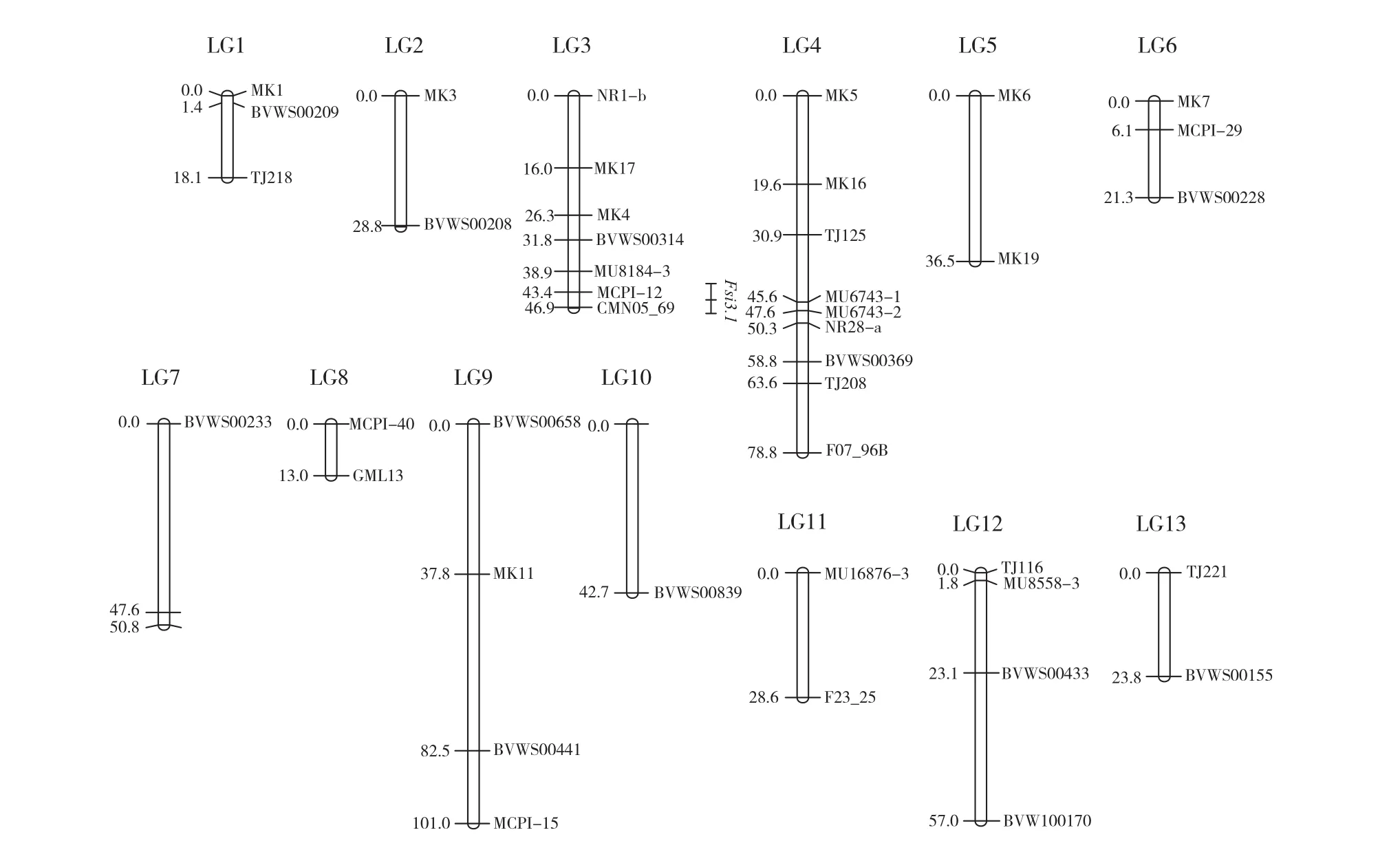
图2 西瓜遗传连锁图谱及果形指数相关QTL分析
3 结论与讨论
在园艺作物果形指数的遗传分析中,马瑞娟等(2007)以油桃品种霞光和油蟠桃品系NF杂交组合为试材,证实F1果形指数分离比例符合1对等位基因的分离规律,蟠桃(扁盘形)对圆桃是完全显性;李慧峰等(2010)在晚白塔桃自交试验中也证实果实形状为质量性状遗传。但质量遗传分析是建立在果形指数为质量性状,性状稳定,且不考虑环境条件影响的基础上,采用人为果形指数判断及强行人为分级,这样造成的人为误差较大,遗传分析结果应用有很大的局限性。更多的研究表明,果形指数是数量遗传性状,受微效多基因控制。陈克玲等(1994)对柑橘果形指数遗传的研究认为,柑橘F1果形指数呈连续性变异,F1果形指数与亲中值及母本果形指数均呈极显著正相关,果形指数呈趋中或趋扁变异,果形指数为多基因控制的数量性状。刘艳等(2001)在香梨果形指数遗传研究上,刘志等(2004)在苹果果形指数遗传研究上得到了相似的结果。本试验利用圆球形西瓜品系花园母本为母本,以椭圆形西瓜品系LSW-177为父本对西瓜果形指数的研究表明,亲本果形指数在其杂种后代中占有较高的百分率,后代果形指数性状呈多基因控制的数量性状遗传特征,进一步证实果形指数属微效多基因控制的数量遗传性状。
本试验找到了一个与果形指数相关的QTL位点,贡献率较小,为2.8%,原因可能是西瓜的遗传背景狭窄,不同西瓜种质资源间遗传多样性较低,导致能够用于SSR分子标记的引物数量相对较少。其次,本试验中只采用了单一的SSR分子标记方法,结合田间数据和分子数据进行分析,在控制西瓜果形指数方面,还可能存在着贡献率较大的QTL位点,还有待于通过开发更多的SSR标记引物及开发新的分子标记等方法获得与西瓜果形指数密切相关的分子标记。
本试验在SSR分子标记过程中出现了偏分离,标记的偏分离现象在植物的遗传作图中是一种普遍现象,并被认为是一种进化动力,自交不亲和性和遗传搭车效应(hitchhiking)(即分子标记偏分离程度与影响等位基因频率的遗传因子连锁有关。在一些连锁群中存在着控制配子生活力和竞争力的座位,其结果是导致配子选择从而产生偏分离)是造成偏分离现象的两种观点。Oliver等(2001)利用甜瓜F2群体,采用RAPD、AFLP等标记,偏分离比率为5.8%;高美玲等(2011)利用甜瓜RIL6群体,采用SSR标记,偏分离比率为11.1%;易克等(2003)利用西瓜RIL8群体,采用SSR分子标记,偏分离比率为10%;刘莉等(2010)利用西瓜的F2群体,采用AFLP标记,偏分离比率为27%;本试验利用西瓜的F2群体,采用SSR分子标记,偏分离比率为18.18%,由此可推断,不同作图群体,不同材料间存在很大不规律差异,本试验偏分离比率较高,这可能是因为用于构建遗传连锁图谱的F2群体数量有限,导致标记的分离呈现出一定的偏分离现象,或是检测的标记与在一些连锁群中存在着控制配子生活力和竞争力的座位连锁紧密有关,总之要更进一步地阐明其机理,还要在偏分离基因座位的近等基因系(near-isogeniclines,NIL)发展方向进行更具体细致的研究。
本试验采用圆球形品系花园母本和椭圆形品系LSW-177杂交获得的F2群体为试验材料,构建了一张包含45个SSR标记,13个连锁群的遗传连锁图谱,覆盖基因组长度为547.3 cM,标记间平均距离为12.44 cM。在遗传图谱的构建过程中,采用了Zhang Haiying等(2012)在构建西瓜核酸指纹图谱中所使用的23对核心引物,这23对核心引物在供试的两亲本间共筛选出多态性引物16对,最终将其中的12对引物标记在本试验所构建图谱的10个连锁群上,这12对引物在连锁群中的分布与西瓜核酸指纹图谱中的分布相一致。
本试验找到了与果形指数相关的QTL位点一个,为负向加性效应,由于F2群体为临时作图群体,找到的这个QTL位点有待于进一步利用重组自交系等永久作图群体进行多年多点的分析和验证。将定位的与果形指数相关的QTL位点命名为Fsi3.1,贡献率为2.8%,根据毛传澡和程式华(1999)的研究结果(贡献率<5%为效应微小的QTL,贡献率>15%为效应较大的QTL),本试验所定位的基因属微效基因,推测在西瓜果形方面可能存在效应更大的主效QTL或是多个微效QTL,等待进一步发掘。
陈克玲,陈力耕,钟广炎,洪奇斌.1994.柑桔果形遗传的研究.西南农业大学学报,16(2):120-123.
高美玲,朱子成,高鹏,栾非时.2011.甜瓜重组自交系群体SSR遗传图谱构建及纯雌性基因定位.园艺学报,38(9):1308-1316.
李慧峰,李林光,王长君,杨建明.2010.晚白塔桃果实性状基因型判定.落叶果树,42(3):5-7.
刘莉,焦定量,郭敏,张秦英,胡宝刚,商纪鹏,张艳宁.2010.西瓜遗传图谱构建及其强雌性状定位研究.果树学报,27(1):50-56.
刘艳,吴忠华,董延年,常宏伟.2001.香梨杂种F1代的杂种后代果实性状遗传研究.北方果树,(6):4-7.
刘志,伊凯,王冬梅,杨巍,杨锋,张景娥.2004.富士苹果果实外观品质性状的遗传.果树学报,21(6):505-511.
马瑞娟,俞明亮,沈志军,杜平,许建兰,蔡志翔.2007.霞光油桃×NF油蟠桃组合F1代果实主要性状的遗传倾向.江苏农业学报,23(6):622-625.
毛传澡,程式华.1999.水稻农艺性状QTL定位精确性及其影响因素的分析.农业生物技术学报,7(4):368-394.
盛云燕,栾非时,陈克农.2006.甜瓜SSR标记遗传多样性的研究.东北农业大学学报,37(2):165-170.
易克.2002.西瓜遗传图谱的构建及其重要农艺性状的基因定位〔博士论文〕.长沙:湖南农业大学.
易克,徐向利,卢向阳,许勇,肖浪涛,王永健,康国斌.2003.利用SSR和ISSR标记技术构建西瓜分子遗传图谱.湖南农业大学学报,29(4):333-337.
张法惺,栾非时,盛云燕.2010.不同生态类型西瓜种质资源遗传多样性的SSR分析.中国蔬菜,(14):36-43.
Ben-Chaim A,Paran I,Grube R C,Jahn M,van Wijk R,Peleman J.2001.QTL mapping of fruit-related traits in pepper(Capsicum annuum).Theor Appl Genet,102:1016-1028.
Ben-Chaim A,Borovsky Y,Rao G,Gur A,Zamir D,Paran I.2006.Comparative QTL mapping of fruit size and shape in tomato and pepper.Israel Journal of Plant Sciences,54(3):191-203.
Danin-Poleg Y,Reis N,Tzuri G,Katzir N.2001.Development and characterization of microsatellite inCucumis.Theor Appl Genet,102:61-72.
Davis A R,Perkins-Veazie P,Collins J,Levi A.2008.LSW-177 and LSW-194:red-fleshed watermelon lines with low-total soluble solids. Hort Science,43(2):538-539.
Fazio G,Staub J E,Chung S M.2002.Development and characterization of PCR markers in cucumber.HortScience,127:545-557.
Fernandez-Silva I,Eduardo I,Blanca J,Esteras C,Pico B,Nuez F,Arus P,Garcia-Mas J,Monforte A J.2008.Bin mapping of genomic and EST-derived SSRs in melon(Cucumis meloL.).Theor Appl Genet,118:139-150.
Gonzalo M J,Oliver M,Garcia-Mas J,Monfort A,Dolcet-Sanjuan R,Katzir N,Arus P,Monforte A J.2005.Simple-sequence repeat markers used in merging linkage maps of melon(Cucumis meloL.).Theor Appl Genet,110(5):802-811.
Hawkings L K,Dane F,Kubisika T L.2001.Linkage mapping in a watermelon population segregating for Fusariumwilt resistance.Journal of the American Society for Horticultural Science,126(3):344-350.
Joobeur T,Gusmini G,Zhang X,Levi A,Xu Y,Wehner T C,Oliver M,Dean A.2006.Construction of a watermelon BAC library and identification of SSRs anchored to melon orArabidopsisgenomes.Theor Appl Genet,112:1553-1562.
Luan F,Delannay I,Staub J E. 2008. Melon(Cucumis meloL.)diversity analyses provide strategies for genetic improvement and evidentiary support of domestication patterns. Euphytica,164:445-461.
Oliver M,Garcia-Mas J,Cardus M,Pueyo N,López-SeséA I,Arroyo M,Gómez-Paniagua H,Arús P,de Vicente M C.2001.Construction of a reference linkage map for melon.Genome,44:836-845.
Shimamoto I,Harushima Y.1996.Construction of a linkage map for watermelon〔Citrullus lanatus(Thunb.)Matsum. & Nakia〕using random amplified polymorphic DNA(RAPD).Euphytica,90:265-273.
Silberstein L,Kovalski I,Brotaman Y,Perin C,Dogimont C,Pitrat M,Klingler J,Thompson G,Portnoy V,Katzir N,Perl-Treves R.2003.Linkage map ofCucumis meloincluding phenotypic traits and sequence-characterized genes. Genome,46:761-773.
van der Knaap E,Lippman Z B,Tanksley S D.2002.Extremely elongated tomato fruit controlled by four quantitative trait loci with epistatic interactions.Theor Appl Genet,104:241-247.
van der Knaap E,Sanyal A,Jackson S A,Tanksley S D.2004.High-resolution fine mapping and fluorescence in situ hybridization analysis ofsun,a locus controlling tomato fruit shape,reveals a region of the tomato genome prone to DNA rearrangements.Genetics,168:2127-2140.
Zalapa J E,Staub J E,Mcreight J D,Chung S M,Cuevas H.2007.Detection of QTL for yield-related traits using recombinant inbred lines derived from exotic and elite US Western shipping melon germplasm. Theor Appl Genet,114:1185-1201.
Zhang Haiying,Wang Hui,Guo Shaogui,Ren Yi,Gong Guoyi,Weng Yiqun,Xu Yong.2012.Identification and validation of a core set of microsatellite markers for genetic diversity analysis in watermelon,Cirtullus lanatusThunb. Matsum. & Nakia.Euphytica,186:329-342.
Zygier S,Chaim A,Efrati A,Kaluzky G,Borovsky Y,Paran I.2005.QTLs mapping for fruit size and shape in chromosomes 2 and 4 in pepper and a comparison of the pepper QTL map with that of tomato. Theor Appl Genet,111:437-445.

