芥菜游离小孢子培养技术研究
顾祥昆 李 菲 张淑江 章时蕃 张 慧 孙日飞
(中国农业科学院蔬菜花卉研究所,北京 100081)
小孢子培养技术是利用植物的未成熟花粉在一定诱导条件下改变正常的花粉发育途径,即由配子体发育途径转向孢子体发育途径,进而形成胚状体的过程。通过小孢子培养可获得大量单倍体或双单倍体植株(DH系),在纯化亲本、突变体筛选、遗传研究等方面应用广泛。目前,该技术已经成为育种的重要手段之一。Lichter(1982)首次报道了甘蓝型油菜小孢子培养获得了胚状体再生植株;日本学者Sato等(1989)首次利用游离小孢子培养技术从1个大白菜品种中得到了小孢子胚和再生植株。随后,小孢子培养技术在芸薹属蔬菜中得到广泛应用,目前已经涉及芸薹属的3个基本种和3个复合种(牛永超 等,2010)。
芥菜〔Brassica juncea(L.)Czern. et Coss.〕是十字花科芸薹属一年或二年生植物,是我国重要的经济作物。随着消费水平的提高,人们对芥菜品质、产量等提出了更高的要求。利用小孢子培养技术可以快速获得纯合的DH材料,大大缩短育种周期,提高育种效率,为芥菜高效优质育种获得纯合目标材料提供了新的途径。但目前国内外对芥菜小孢子培养技术的研究较少,且主要集中在油用芥菜上,对鲜食或加工用芥菜的研究甚少,芥菜游离小孢子培养技术体系尚不完善。本试验拟通过研究基因型、热激诱导条件、供体植株生长条件对芥菜小孢子培养的影响,探讨适宜芥菜小孢子培养的主要条件,为完善芥菜小孢子培养技术体系、提高胚胎诱导率奠定理论基础。
1 材料与方法
1.1 材料
选取12份不同基因型的芥菜栽培种为试验材料(表1),分属于叶用芥菜、茎用芥菜、根用芥菜3个变种,均由中国农业科学院蔬菜花卉研究所提供。2011年1月播种于本所玻璃温室内,常规管理,3月初定植于日光温室,4~6月初取蕾进行游离小孢子培养。

表1 供试芥菜品种名称及类型
1.2 方法
1.2.1 芥菜游离小孢子提取和培养 早上8:00~9:00取材,在显微镜下对不同基因型不同长度的芥菜花蕾进行镜检,确定大部分小孢子处于单核靠边期时所对应的花蕾长度,进行游离小孢子培养。
用75%的酒精消毒花蕾30 s,再用8%次氯酸钠溶液消毒15 min,无菌水冲洗3次,每次1 min。将无菌花蕾置于消毒研钵中,并加入一定量的B5洗涤培养液,挤压花蕾,分离小孢子,用300目消毒滤网过滤,收集滤液于10 mL离心管中,离心3次,转速为1 200 r·min-1,每次4 min,之后弃上清液,用NLN-13培养基制成小孢子悬浮液,用血球计数板调节小孢子密度为8×104~1×105个·mL-1。将其分装于直径为60 mm的无菌培养皿中,每个培养皿中倒入约4 mL,用封口膜封口。
根据试验设计,将分装好的小孢子悬浮液置于恒温培养箱中进行热激诱导后,转入25 ℃恒温培养箱中继续暗培养,至胚状体出现。培养25 d后统计小孢子出胚数目。
1.2.2 花粉发育时期的荧光显微观察 以A12959、V03B0097、V03C0021为试材,在生长健壮的植株花序上选取不同长度的花蕾进行DAPI染色观察,染色液的配制参照李菲(2006)的方法。将不同长度花蕾中的花药剥离出来,取2~3个花药置于载玻片上,并滴1~2滴DAPI染液,用镊子挤压花药,使小孢子分离出来,剔除花药残片,盖上盖玻片并烤片。室温下暗处理15 min后置于荧光显微镜下观察、照相,并记录处于不同发育时期的小孢子外部形态。
1.2.3 单核靠边期与花蕾长度的对应关系 根据DAPI染色结果,得知处于不同时期的小孢子外部形态。将12份芥菜品种不同长度花蕾中的花药剥离出来,取2~3个花药置于载玻片上,滴1~2滴清水,用镊子挤压花药,使小孢子分离出来,剔除花药残片,盖上盖玻片,置于显微镜下观察小孢子的外部形态,测量大部分小孢子处于单核靠边期时对应的花蕾长度并记录。
1.2.4 小孢子发育过程的形态学观察 培养小孢子,每天于倒置显微镜下进行形态学观察。
1.2.5 热激诱导条件 设置3个热激温度:32、33、35 ℃,并分别处理1、2、3 d,热激后置于25 ℃恒温培养箱中静止暗培养。以25 ℃暗培养为对照。培养25 d后统计小孢子出胚数目,计算出胚率。
1.2.6 供体植株生长条件 以A12959、V03B0097、V03C0021为试材,分3个不同播期播种,常规栽培管理,使每批材料抽薹开花的日期分别为4月底~5月初、5月底~6月初、6月底~7月初。取材进行游离小孢子培养,培养时的热激处理条件为35 ℃、3 d。对 比不同生长温度下供体植株的出胚状况,探讨供体植株生长条件对芥菜小孢子培养的影响。
2 结果与分析
2.1 不同发育时期花粉的DAPI染色观察
对不同发育时期的花粉进行DAPI染色并进行细胞学观察,结果见图1。芥菜小孢子发育过程为四分体时期→单核中期→单核靠边期→双核期→三核期。
四分体时期(图1-a):小孢子母细胞经减数分裂后会形成4个子细胞粘连在一起的时期,称为四分体时期,经荧光染色后有4个核出现。此时小孢子的外部形态呈明显的四裂状。单核中期(图1-b):小孢子的核只有1个且处于细胞中间。此时小孢子的外部形态呈近圆形,三棱形初步显露但不是很明显。单核靠边期(图1-c):细胞核处于细胞的边缘处,靠近细胞壁。小孢子的外部形态呈明显的三棱形,可以看见有3条萌发沟,并且从总体上看,单核靠边期的小孢子要比单核中期的小孢子体积要大。双核期(图1-d):小孢子经第一次有丝分裂在胞壁内形成营养核和生殖核,其中营养核染色较浅,生殖核染色较深。此时小孢子的外部形态呈圆形。三核期(图1-e):随着小孢子的继续发育,生殖核分裂为2个精子,此时小孢子内有3个核,即1个营养核和2个精子核。精子核较小,营养核较大。此时小孢子的外部形态呈近圆形至椭圆形。由DAPI染色结果可知:小孢子随着不断地生长发育,细胞体积不断增大。处于单核靠边期的小孢子可见明显的3条萌发沟,呈三棱形,可作为单核靠边期的形态指标。
2.2 小孢子处于单核靠边期所对应的花蕾长度
对于芥菜,适于培养的小孢子发育时期一般是单核靠边期。刘冬等(1997)以芥菜为试材进行小孢子培养,结果显示单核晚期的小孢子培养效果最好。Prem等(2005)选取单核晚期占较大比例的花蕾进行小孢子培养,培养效果较好。
对供试的12份芥菜材料的不同长度花蕾中的小孢子进行镜检,依据单核靠边期小孢子的细胞学特征,找出大部分小孢子处于单核靠边期所对应的花蕾长度,即为适宜小孢子培养的花蕾长度。从表2可以看出,除了南平大头芥(V03B0001)小孢子单核靠边期所对应的花蕾长度是3.0~3.5 mm外,其余芥菜材料小孢子单核靠边期所对应的花蕾长度为2.0~3.0 mm。但不同基因型的芥菜材料,其小孢子单核靠边期所对应的花蕾长度也有所不同。如包心芥(A12959)的小孢子单核靠边期所对应的花蕾长度为2.5~3.0 mm,而儿菜(V03B0109)的小孢子单核靠边期所对应的花蕾长度为2.0~2.5 mm。在实际应用中,应根据基因型选择适宜长度的花蕾进行游离小孢子培养,在分离提取小孢子之前用显微镜快速镜检,找到大部分小孢子为三棱形时所对应的花蕾长度即为适宜的花蕾长度。

图1 不同发育时期芥菜小孢子的DAPI荧光染色结果(10×20)

表2 不同基因型芥菜小孢子单核靠边期所对应的花蕾长度
2.3 小孢子培养过程中的细胞学观察
在小孢子培养过程中,用倒置显微镜观察小孢子各个发育时期的形态。经热激处理24 h后,部分小孢子明显膨大,细胞呈圆球形,细胞直径增大到原来的2~3倍(图2-a);3 d后,部分膨大的小孢子发生第一次分裂,大部分为均等分裂(图2-b),也有极个别的为不均等分裂(图2-c),不均等分裂的小孢子一般不能发育成胚;5 d后,较多的小孢子发生第二次均等分裂(图2-d);7 d后,可观察到分裂多次的细胞团(图2-e);9 d后,可观察到球形幼胚(图2-f);第10~11天时,可观察到球形胚(图2-g)和心形胚(图2-h),第12~15天时,可观察到鱼雷形胚和子叶形胚(图2-i,j,k)。
此外,还观察到不同基因型芥菜的小孢子胚胎发生均具有不同步性,在1个培养皿中可以同时观察到球形胚、心形胚、鱼雷形胚和子叶形胚并存(图2-l)。
2.4 热激条件对芥菜小孢子出胚率的影响

图2 芥菜小孢子离体发育过程
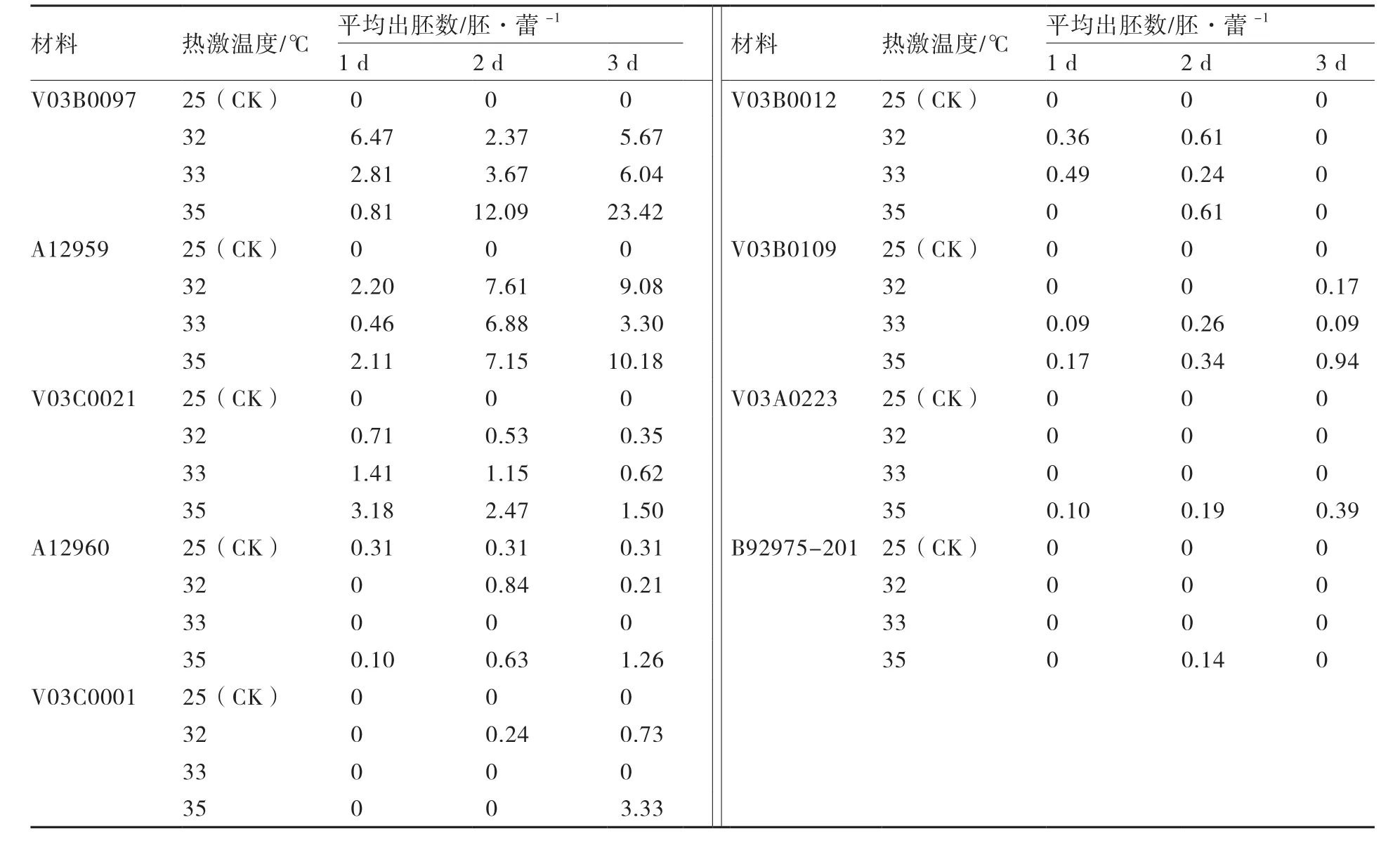
表3 不同热激条件对芥菜小孢子出胚率的影响
从表3可以看出,V03B0012和B92975-201在35 ℃、2 d的热激处理下出胚率较高,V03C0021在35 ℃、1 d的热激处理下出胚率较高,其余6份出胚的芥菜材料均在35 ℃、3 d的热激条件下产胚量最多。总体来说,35℃、3 d是本试验条件下大多数芥菜材料小孢子培养较为适宜的热激诱导条件。
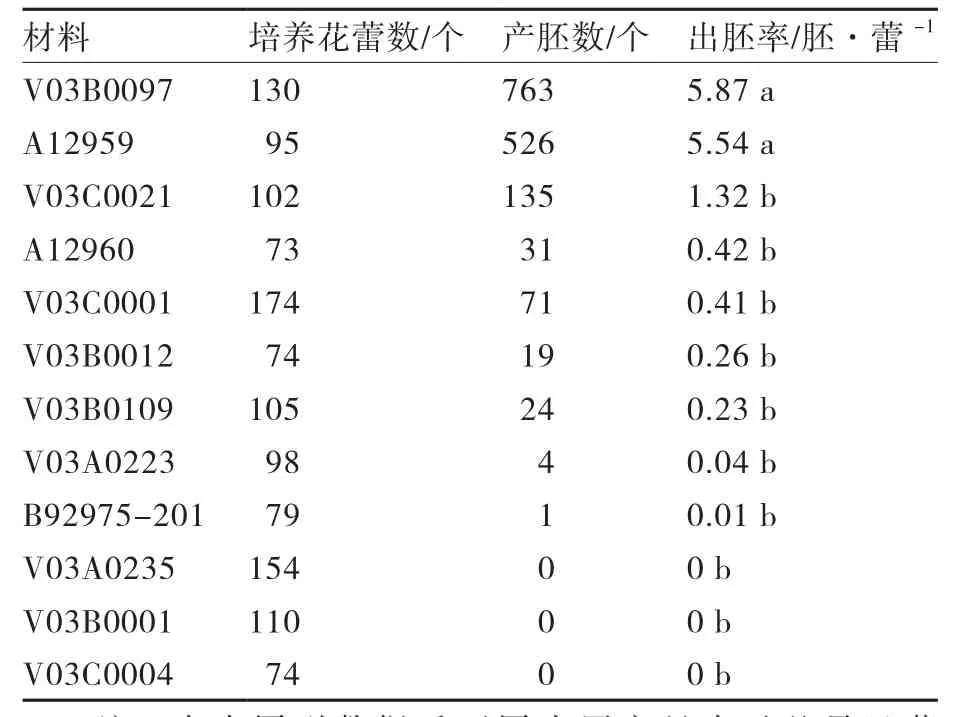
表4 不同基因型对芥菜小孢子出胚率的影响
2.5 基因型对芥菜小孢子胚产量的影响
由表4可见,供试的12份芥菜材料中有9份诱导出胚,其中V03B0097和A12959出胚率较高,达5.87胚·蕾-1和5.54胚·蕾-1;A12960、V03C0001、V03B0012、V03B0109、V03A0223、B92975-201的出胚率相对较低,均在0.5胚·蕾-1以下;而V03A0235、V03B0001、V03C0004很难诱导出胚。由此可见,不同基因型的芥菜小孢子胚胎发生能力有很大的差异,基因型是影响芥菜小孢子培养成功与否的重要因素。
2.6 供体植株生长条件对芥菜小孢子培养的影响
为探讨不同温度条件下生长的供体植株对芥菜小孢子培养的影响,本试验以A12959、V03B0097、V03C0021为试材,分3批播种,常规栽培管理,每批材料抽薹开花的日期分别为4月底~5月初、5月底~6月初、6月底~7月初,取材进行游离小孢子培养,并统计同种材料在不同抽薹开花日期的出胚情况。4月底~5月初平均气温为25.7 ℃/14.25 ℃(平均最高气温/平均最低气温,下同),5月底~6月初为29.8 ℃/17.95 ℃,6月底~7月初为30.25 ℃/21.95 ℃。结果显示:只有4月底~5月初抽薹开花的材料进行游离小孢子培养后可诱导出胚,其余两批材料均没有诱导成胚。可见,供体植株的生长温度对芥菜小孢子培养有较大的影响。在运用小孢子培养技术时,应尽量确保供体植株处于较低的温度环境中生长。但由于本试验没有进行多年多点重复试验,还需进一步设计详细的试验进行研究。
2.7 芥菜小孢子胚状体的继代培养
将培养25 d后的胚状体(图3-a)转接到B5固体培养基上继续培养,待胚状体萌发分化后转接到MS培养基上进行继代培养(图3-b),大部分的子叶形胚均能正常发育、分化,并形成健全的植株(图3-c),而球形胚、心形胚和鱼雷形胚均褐化死亡。表明幼期胚状体不容易成活,子叶形胚易于进行继代培养。为了使更多的胚状体得以应用,还需要进一步探究继代培养中各种条件对胚状体发育的影响,以优化芥菜继代培养体系。

图3 芥菜小孢子胚状体的萌发与植株再生
3 结论与讨论
在游离小孢子培养中,小孢子发育时期与诱导胚胎发生能力密切相关,选择合适发育时期的小孢子至关重要。对于芥菜,单核靠边期的小孢子易于诱导启动胚状体发生途径(刘冬 等,1997;Prem et al.,2005)。本试验采用DAPI染色法确定了单核靠边期小孢子的细胞形态,对12份芥菜材料不同长度花蕾的小孢子进行显微观察,找到了单核靠边期的小孢子所对应的花蕾长度。三棱形是单核靠边期小孢子最为明显的细胞学形态特征,可以作为此发育时期的形态学标志。本试验选取的12份芥菜小孢子处于单核靠边期所对应的花蕾长度主要在2~3 mm的范围内,但适宜的花蕾长度随基因型的不同而有差异,在实际应用中应根据基因型确定适宜长度的花蕾进行游离小孢子培养。
很多作物小孢子培养过程中,高温热激是诱导小孢子胚胎发生的关键步骤。其作用机理是通过胁迫改变小孢子的发育途径,阻止小孢子向成熟花粉粒方向发展,促进其沿胚胎发育途径发展,最后形成小孢子胚(栗根义 等,1993a,1993b)。目前高温热激处理已经广泛地运用于十字花科作物小孢子培养中。芥菜小孢子培养同样需要热激诱导,但目前所采用的热激条件各有不同,难以统一。刘冬等(1997)的研究中只有在33 ℃、3 d热激处理下有芥菜小孢子胚形成;牛永超等(2010)认为32 ℃、5 d热激处理对大多数芥菜小孢子再生成胚状体较为有效;Hiramatsu等(1995)对24份叶用芥菜材料进行游离小孢子培养,采用的热激条件为32.5 ℃、1~3 d,只有7份材料出胚,对于出胚情况最好的Hsueh Li Hung来说,最佳的热激条件是32.5 ℃、2 d;Pradeep等(2006)的研究表明35 ℃、2 d的热激条件最好,比32、33 ℃处理2 d后的产胚量高10~15倍。本试验探究了热激温度和热激天数对12份芥菜小孢子培养的影响,35 ℃、3 d是大多数材料较为适宜的热激条件。这与Pradeep等(2006)的研究结果较为一致。为了进一步确定适于芥菜小孢子培养的热激条件,今后还需要增加芥菜基因型的种类和数量进行重复验证。
目前,小孢子培养技术已经广泛的应用于芸薹属的很多作物中,在探究大白菜(曹鸣庆 等,1993;栗根义 等,1993a;赵俊 等,2008)、甘蓝型油菜(余凤群和刘后利,1995;王汉中 等,2004)、花椰菜(张晓芬 等,2005;赵前程 等,2007)、萝卜(张丽,2004)等小孢子培养的影响因素试验中,基因型仍是决定小孢子培养成功与否的关键因素。在本试验中,基因型亦是影响芥菜小孢子培养的关键因素,这与前人的研究结果相同(Hiramatsu et al.,1995;Agnihotri et al.,1996;Lionneton et al.,2001;Prem et al.,2005;Deepak et al.,2008;牛永超 等,2010),不同基因型芥菜的小孢子胚胎发生能力有很大的差异。
在探讨基因型对芥菜小孢子胚产量的影响时,本试验综合了所有条件下的出胚情况进行探讨。因为芥菜的遗传背景较为复杂,可能存在较多的内在因素影响芥菜小孢子胚胎发生能力,没有较为统一的热激条件。本试验中,虽然35 ℃、3 d的热激条件对大多数芥菜材料而言是较为适宜的诱导条件,但并不是对所有的基因型都适用,有的在其他热激条件下出胚的材料在35 ℃、3 d热激后并不出胚。如V03B0097和A12959在任何热激条件下均能诱导出胚,是易出胚材料;而B92975-201只有在35 ℃热激2 d后有胚状体发生,V03C0004、V03B0001和V03A0235在任何热激条件下均不能诱导出胚,由此表现出基因型差异。此外,本试验所用的基因型较少,很可能随着基因型的增加,会表现出依赖于基因型的热激条件多样性,因此需要考虑在一定热激条件范围内的出胚总体情况进行基因型影响的探讨。今后也应当增加芥菜的种类和数量作进一步的研究。
本试验也初步探究了供体植株生长条件尤其是温度条件对芥菜小孢子培养的影响,发现4月底~5月初抽薹开花的材料小孢子易于诱导出胚,说明供体植株在较低的温度环境下生长有利于小孢子培养。在常规栽培管理中,应尽量使芥菜抽薹开花时的气温相对较低。
曹鸣庆,李岩,刘凡.1993.基因型和供体植株生长环境对大白菜游离小孢子胚胎发生的影响.华北农学报,8(4):1-6.
栗根义,高睦枪,赵秀山.1993a.大白菜游离小孢子培养.园艺学报,20(2):167-170.
栗根义,高睦枪,赵秀山.1993b.高温预处理对大白菜游离小孢子培养的效果(简报).实验生物学报,26(2):165-166.
李菲.2006.大白菜游离小孢子培养及其胚胎发生和加倍机理的研究〔硕士论文〕.北京:中国农业科学院.
刘冬,郭平仲,刘凡,李岩,曹鸣庆.1997.芥菜(Brassica junceaL.)小孢子胚发生和植株再生.首都师范大学学报:自然科学版,18(1):76-81.
牛永超,李加纳,殷家明,林呐,徐新福,韩甫,周清元.2010.基因型和处理温度对芥菜型油菜游离小孢子培养的影响.西南大学学报:自然科学版,32(8):23-28.
王汉中,王新发,刘贵华,郑元本,杨庆.2004.甘蓝型杂交油菜亲本的小孢子培养技术研究.中国油料作物学报,26(1):1-4.
余凤群,刘后利.1995.供体材料和培养基成份对甘蓝型油菜小孢子胚状体产量的影响.华中农业大学学报,14(4):327-332.
张丽.2004.萝卜游离小孢子培养技术初探.园艺学报,34(5):676-678.
张晓芬,王晓武,张延国,刘运霞,王永清.2005.花椰菜游离小孢子培养再生植株研究.中国蔬菜,(1):16-17.
赵俊,巫东堂,赵军良,董晓飞,赵美华,王秀英,李改珍.2008.影响大白菜游离小孢子培养若干因素的研究.山西农业科学,36(8):26-28.
赵前程,吉立柱,蔡荣旗,刘莉莉,佟志强,孙德岭.2007.花椰菜游离小孢子培养及植株再生研究.华北农学报,22(6):65-68.
Agnihotri A,Seguin-Swartz G,Downey R K.1996. Microspore embryogenesis inB. juncea//Pareek L K.ed.Trends in plant tissue culture and biotechnology.Rajasthan:Agrobotanical Publishers:218-221.
Deepak P,Kadambari G,Gautam S,Abha A.2008.Activated charcoal induced high frequency microspore embryogenesis and efficient doubled haploid production inBrassica juncea.Plant Cell Tissue and Organ Culture,93(3):269-282.
Hiramatsu M,Odahara K,Matsue Y.1995.A survey of microspore embryogenesis in leaf mustard (Brassica juncea).Acta Hort,392:139-145.
Lichter R.1982.Induction of haploid plants from isolated pollen ofBrassica napus.Z Pflanzenphysiol,105:427-434.
Lionneton E,Beuret W,Delaitre C,Ochatt S,Rancillae M.2001.Improved microspore culture and doubled haploid plant regeneration in the brown condiment mustard(B. juncea).Plant Cell Rep,20:126-130.
Pradeep K A,Parinita A,Jan B M C,Liu C M,Bhojwani S S.2006.PCIB an antiauxin enhances microspore embryogenesis in microspore culture ofBrassica juncea.Plant Cell Tissue and Organ Culture,86(2):201-210.
Prem D,Gupta K,Agnihotri A.2005.Effect of various exogenous and endogenous factors on microspore embryogenesis in Indian mustard〔Brassica juncea(L.)Czern and Coss.〕.In Vitro Cell Dev Biol Plant,41:266-273.
Sato T,Nishio T,Hirai M.1989.Plant regeneration from isolated microspore cultures of Chinese cabbage (Brassica campestrisssp.pekinensis).Plant Cell Rep,8:486-488.

