磺胺类药物对结核分枝杆菌的体外抑菌作用及与其他抗结核药物相互作用的研究
于霞 赵立平 姜广路 马异峰 黄海荣
结核病疫情的不断蔓延是全球严重的公共卫生问题之一,目前全球已有20亿人感染结核分枝杆菌,而活动性结核病患者达1500万例,每年新增结核病患者约800~1000万例,每年有180万例因结核病死亡[1]。耐多 药结核病 (multidrug-resistant tuberculosis,MDR-TB)是指体外至少对异烟肼(H)和利福平(R)同时耐药的结核病。MDR-TB的治疗与普通结核病的标准一线药物治疗相比,治疗效果差,不良反应多且治疗费用高,已经成为成功控制结核病的障碍。
磺胺是最早发现的具有抗菌作用的药物,磺胺甲噁唑(sulfamethoxazole,SMX)又称新诺明(sinomine),是磺胺类药物中常用的抗生素,通常与甲氧苄啶(trimethoprim,TMP)联合用于临床治疗。SMX和TMP均作用于细菌的叶酸合成途径,SMX作用于二氢喋呤合成酶,从而阻止其将对氨基苯甲酸催化成二氢叶酸,而TMP则作用于二氢叶酸还原酶,从而阻止其将二氢叶酸还原成四氢叶酸[2]。目前,广泛使用的复方新诺明就是TMP和SMX的复方制剂,其中SMX的含量为TMP的5倍。早在20世纪30—50年代,磺胺类药物就单独用来治疗肺结核。但随着20世纪50年代具有更强杀菌效果的H和链霉素(S)出现后,磺胺类药物就基本不再用于结核病的治疗。但迫于MDR-TB患者的不断增多,磺胺类药物又以抗结核药物的形式被推荐[3],已有研究表明,磺胺类药物在体内外对于结核病的治疗具有良好的疗效[4]。
本研究的目的是评价TMP和SMX的联合应用对结核分枝杆菌临床分离株的体外抑菌作用。同时因抗结核治疗是一个联合化疗的过程,也因此对TMP和(或)SMX与其他抗结核药物如R、H、乙胺丁醇(E)、S、卡那霉素(Km)、氧氟沙星(Ofx)、利福布丁(Rfb)的体外协同作用进行了评价。
材料和方法
一、材料
1.菌株来源:H37Rv(ATCC 27294)和120株结核分枝杆菌临床分离株来源于首都医科大学附属北京胸科医院国家结核病临床实验室,菌株收集时间为2010年9月至2010年11月。纳入的121株结核分枝杆菌的药敏实验结果均是由绝对浓度法(罗氏含药培养基)药敏试验确定,包括MDR菌株32株,非MDR耐药菌株36株,敏感株53株。
2.试 剂 和 药 品:SMX(S7507,10g)、TMP(T7883,5g)、R(R3501,5g)、H(I3377,50g)、S(S6501,25g)、E(E4630,25g)、Km(K400,5g)、Ofx(O8757,10g)、Rfb(R3530,25mg)均购自美国Sigma公司;96微孔板(Corning,美国);Alamar blue(Serotec,英国);7H9(Difco,美国);OADC(BD,美国);Tween-80、二甲基甲酰胺(dimethylformamide,DMF)和氢氧化钠购自国药集团化学试剂有限公司,均为化学分析纯。
二、方法
1.微孔板 Alamar blue法(microplate alamar blue assay,MABA):具体的操作步骤参见参考文献[5]。药物的终浓度分别为:SMX 为(0.63~160)μg/ml;TMP为(0.125~32)μg/ml;“TMP∶SMX=1∶5”为(0.13/0.63~16/80)μg/ml;“TMP∶SMX=1∶19”为(0.031/0.6~4/76)μg/ml;R为(0.0625~8)μg/ml;H 为(0.0125~1.6)μg/ml;S为(0.125~16)μg/ml;E 为 (0.3125~40)μg/ml;Km 为(0.3125~40)μg/ml;Ofx 为(0.125~16)μg/ml;Rfb为(0.03125~4)μg/ml,SMX、TMP、R、Rfb用DMF溶解,H、S、E、Km用水溶解,Ofx用1%氢氧化钠溶解,上述药物浓度均由最高浓度进行2倍稀释,每种药物包括8个梯度浓度,每种药物浓度重复2孔。选取罗氏培养基上生长2~3周的新鲜菌落,用玻璃珠磨菌,稀释至1个麦氏浓度[McFarland 1,相当于(3~6)×107CFU/ml],再以1∶25稀释后向微孔板加入100μl菌液,菌液的终浓度约为106CFU/ml。每个菌株设1个不含药物的生长对照孔(阳性对照)和只含有7H9不含药物和菌液的无菌对照孔(阴性对照),各菌株平行进行2次测试。96孔板于37℃孵育5d后在生长对照孔加入20μl Alamar blue和50μl Tween-80(5.00%)的混合液,37℃孵育24h,如果颜色从蓝色变为粉色,则在各实验药物孔内加入上述量的 Alamar blue和Tween-80混合液,37℃孵育24h记录各孔的颜色,蓝色孔为无生长,粉红色孔为有生长。如出现紫红色孔,则继续在37℃培养24h,如果不变为粉红色且其相连的蓝色孔仍为蓝色,则记录为有生长。MIC定义为阻止颜色变化 (从蓝色变为粉红色)的最低药物浓度。
2.药物联合作用:选取18株临床分离株(5株MDR,13株非 MDR)和 H37Rv(ATCC 27294)(18株选择为分层整群抽样设计,即先按照MDR菌株和非MDR菌株进行分层,总体MDR菌株∶非MDR菌株=32∶89,本次抽样的总数为18例,按照32∶89比例约为5株MDR菌株,13株非MDR菌株)进行药物相互作用试验。SMX与R、H、E、S、Km、Ofx、Rfb联合用药的 MIC通过 MABA法测定,每个菌株平行做2次测试。联合用药中每种抗结核药的浓度范围是1/32到4×MIC(9个浓度,每个浓度间的梯度值是2倍)。采用分级抑菌浓度指数(fractional inhibitory concentration index,FICI)来计算药物间的相互作用。FICI=MIC甲药联用/MIC甲药单用+MIC乙药联用/MIC乙药单用[6-7]。FICI≤0.5,协同作用;0.5<FICI<1,加合作用;1≤FICI<4,无关作用;FICI≥4,拮抗作用[6]。临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)推荐慢生长分枝杆菌对于TMP联合SMX的MIC≤1/19μg/ml为敏感菌株。质控方法同MABA法。
3.统计学分析:采用SPSS 13.0统计软件进行统计学分析,MDR菌株、非MDR菌株、敏感菌株间MIC的比较采用非参数秩和检验,以P<0.05为差异有统计学意义。
结 果
一、TMP和SMX的体外抑菌活性
1.不同耐药类型结核分枝杆菌SMX、TMP、TMP联合SMX的MIC:TMP对于结核分枝杆菌的体外抑菌效果较差,117 株菌株 (117/121,96.70%)的 MIC>32μg/ml(包括 H37Rv),另外4株菌株的 MIC分别为8μg/ml、8μg/ml、16μg/ml、16μg/ml。TMP和SMX对121株不同耐药类型的结核分枝杆菌的MIC具体见表1。
2.不同耐药类型的结核分枝杆菌SMX和“TMP∶SMX=1∶5”的 MIC分布:SMX和“TMP∶SMX=1∶5”对于敏感菌株组(53株)、MDR菌株组(32株)和非MDR耐药菌株组(36株)的MIC分布如表2所示。107株(107/121,88.43%)可以被20 μg/ml 的 SMX 抑 制 生 长,109 株 (109/121,90.08%)可以被“5μg/ml TMP+20μg/ml SMX”抑制生长。对于结核分枝杆菌,TMP和SMX联合应用未表现出协同效应(单用TMP杀菌时绝大部分 MIC>32μg/ml,TMP、SMX联合用药和单独使用SMX的MIC基本一致,故认为TMP和SMX在杀伤结核分枝杆菌上无协同作用)。单独使用SMX和“TMP∶SMX=1∶5”的MIC分布对于121株结核分枝杆菌的差异没有统计学意义(成组设计秩和检验Z=-0.3,P=0.764)。

表1 不同耐药类型结核分枝杆菌的SMX、TMP、TMP联合SMX体外抑菌活性
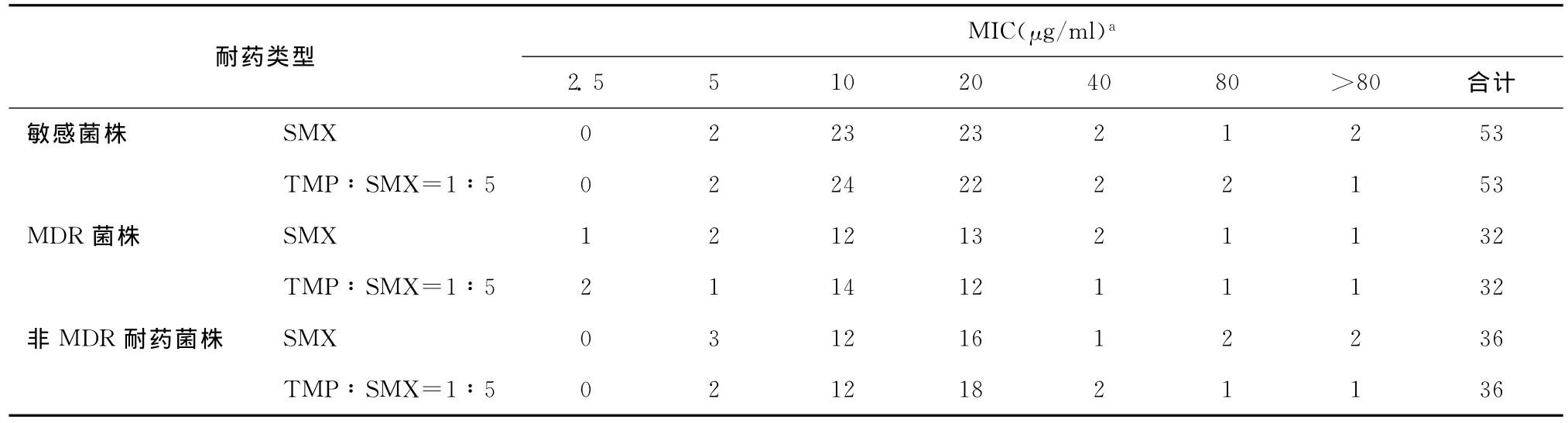
表2 不同耐药类型的结核分枝杆菌SMX和“TMP∶SMX=1∶5”的MIC分布(株)
3.121株结核分枝杆菌“TMP∶SMX=1∶19”的MIC分布:“TMP∶SMX=1∶19”对于敏感菌株、MDR菌株和非MDR耐药菌株的MIC分布如图1所示,3组“TMP∶SMX=1∶19”对不同耐药类型菌株的 MIC差异无统计学意义(χ2=0.111,P=0.946)。3组菌株的“TMP∶SMX=1∶19”的MIC 主 要集中在 “0.5μg/ml TMP+9.5μg/ml SMX”和“1μg/ml TMP+19μg/ml SMX”,在敏感菌株、MDR菌株和非MDR耐药菌株中分别占86.79% (46/53)、75.00% (24/32)和 86.11%(31/36)。纳入的 121 株 菌株 中,109(109/121,90.08%)株 可 以 被 “1μg/ml TMP+19μg/ml SMX”抑制生长,5株的 MIC为“2μg/ml TMP+38μg/ml SMX”,仅有7株的 MIC≥“2μg/ml TMP+38μg/ml SMX”,包括敏感株5株,MDR菌株2株。
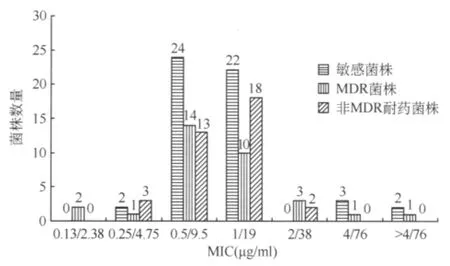
图1 121株结核分枝杆菌对“TMP∶SMX=1∶19”的MIC分布图
4.SMX与其他抗结核药物联用的MIC:SMX与其他抗结核药物联用对H37Rv和18株临床分离株的抑制作用见表3和表4。对于H37Rv,SMX与其他抗结核药联合用药后,除了Rfb表现出协同作用,其余药物均表现为无关作用。对18株临床分离株,SMX 与其他抗结核药联合用药后,14(14/18,77.78%)表现为与Rfb协同。1株表现为与Ofx协同,其余药物联合作用的效果主要表现为无关。
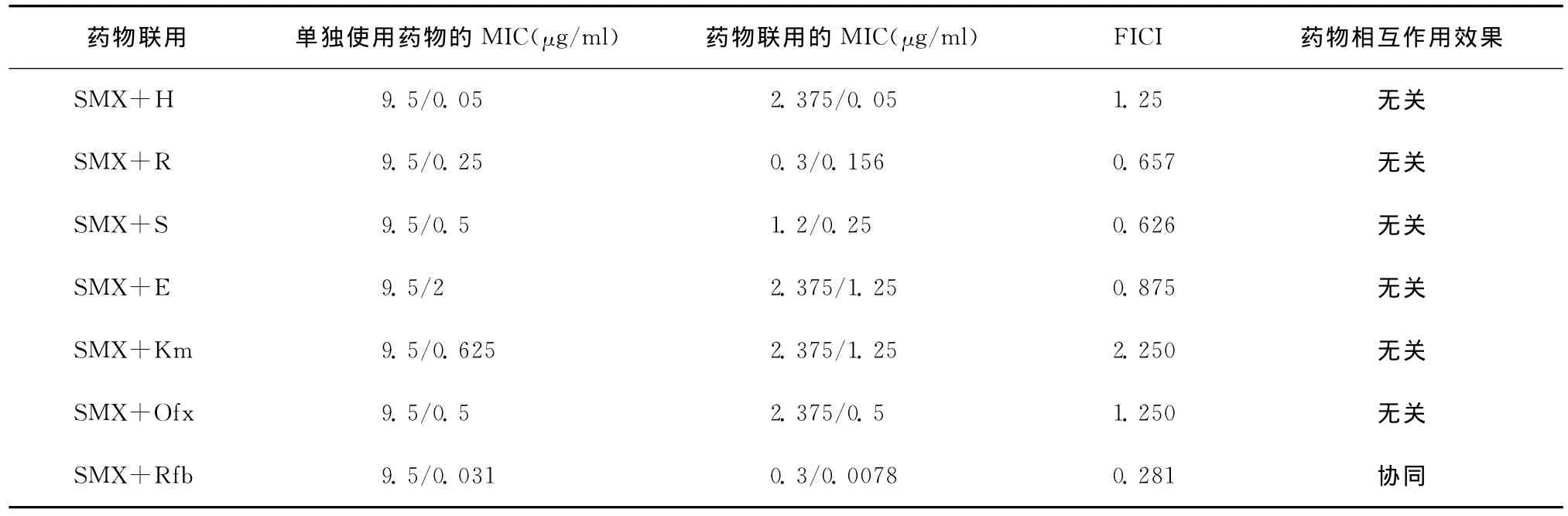
表3 SMX与其他抗结核药联用对H37Rv标准株的作用
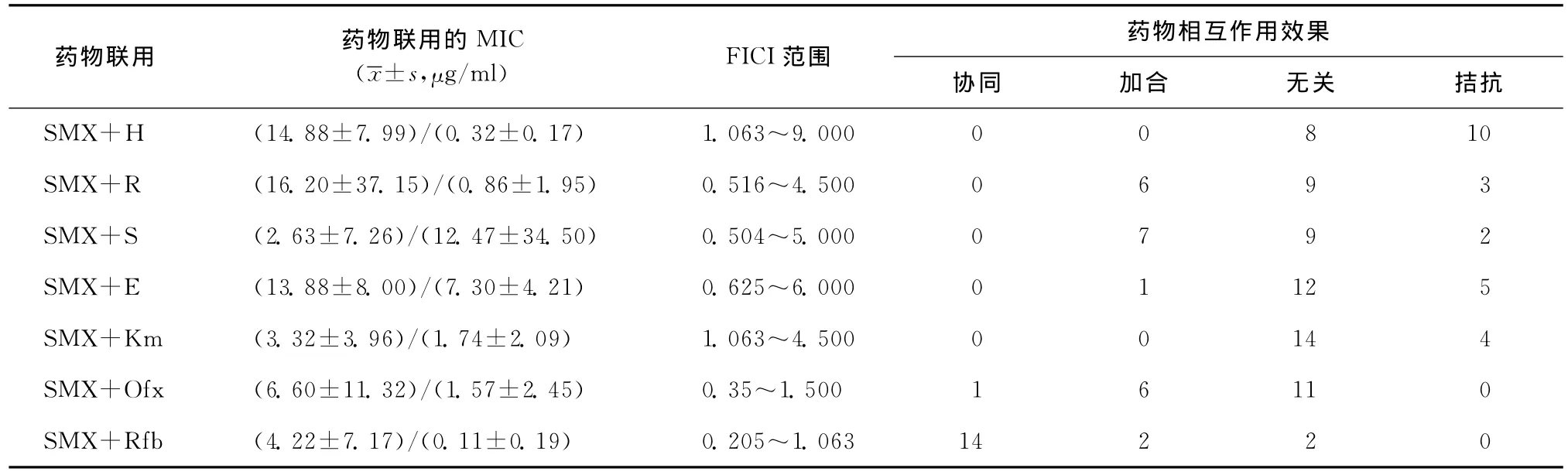
表4 SMX与其他抗结核药联用对18株结核分枝杆菌临床分离株的作用
讨 论
我国2008年耐药基线调查数据表明,目前常规抗结核药物耐药形式非常严峻,对于一线抗结核药物H、R、E和S,初治患者的耐药率分别为16%、6.7%、4.9%和27.7%,而对于复治患者则分别上升至38.5%、29.4%、17.2%和37.2%[8],急需发现新的抗结核分枝杆菌药物或是开发传统药物的抗结核效果。一系列的研究均表明磺胺类药物具有潜在的抗结核疗效。2009年,一篇关于单独应用SMX治疗MDR-TB患者显效的报道引起了对磺胺类药物治疗结核病的关注[4]。同时该研究也表明在44株结核分枝杆菌临床分离株中有98%可以被“1μg/ml TMP+19μg/ml SMX”抑 制 生 长。Huang等[9]研究表明纳入的117株结核分枝杆菌中80%可以被“1μg/ml TMP+19μg/ml SMX”抑制。本研究的数据与上述实验数据基本一致,但鉴于各国流行菌株耐药情况的差异,以及测定MIC时采用培养基的不同(7H10、7H11和7H9),以致敏感度的数据还存在一定的差异。
磺胺类药物问世已经有50余年历史,由于其价格低廉且无明显的不良反应而在临床广泛应用。对流感嗜血杆菌和金黄色葡萄球菌也有较好的抑菌效果,García-Cobos等[10]研究表明109株流感嗜血杆菌有38%对TMP联合SMX耐药,耐药临界值为MIC≥4μg/ml,MIC范围为≤0.25~32μg/ml。对于金黄色葡萄球菌,耐药临界值为1.6μg/ml,4210份菌株中有81(81/4210,1.92%)株对 TMP联合SMX 耐 药,MIC 范 围 为 0.25~16.00μg/ml,97.5%的菌株 MIC集中在0.25μg/ml[11]。本研究表明TMP联合SMX对于结核分枝杆菌也有较好的抑菌作用,CLSI推荐慢生长分枝杆菌对于TMP+SMX复方制剂的 MIC以≤(1μg/ml TMP+19μg/ml SMX)为敏感菌株。按照此判定标准,109株(109/121,90.08%)对 TMP+SMX复方制剂敏感。并且TMP+SMX复方制剂对于结核分枝杆菌的抑菌效果与细菌本身的耐药类型不相关,MIC在MDR组(32株)、敏感组(53株)和非 MDR耐药组(36株)之间差异没有统计学意义(χ2=0.111,P=0.946)。
结核病的治疗以化疗为核心,联合用药为化疗的基本原则,目的是利用多种抗结核药物的交叉杀菌作用,提高杀菌、抑菌的能力,保证疗效和防止产生耐药性[12]。本次研究结果表明,TMP在体外对结核分枝杆菌抑菌效果很差,在药物浓度为32μg/ml时,对于96.70%(117/121)的细菌依然没有抑菌效果。因此,本研究仅对SMX与其他抗结核药联合用药的效果进行评价。在18株结核分枝杆菌临床分离株中,有14株(14/18,77.78%)表现出 SMX与Rfb之间有协同性。对于H37Rv,SMX与其他抗结核药联合用药后,除Rfb表现出协同作用外,其他药物均表现为无关。
本研究证实纳入研究的121株结核分枝杆菌临床分离株有 90.08%(109/121)可以被 “1μg/ml TMP+19μg/ml SMX”剂量的复方制剂所抑制。Vilchèze等[13]研究表明,口服“960mg TMP+4.8g SMX”剂量的复方制剂之后,TMP的血药浓度可以达到4.4μg/ml,SMX 的血药浓度可以达到81.5 μg/ml。Alsaad等[14]研究表明,10例采用复方新诺明进行抗结核治疗的MDR-TB患者,口服480mg的复方新诺明后,平均的fAUC0-24/MIC比值为10.8。因此,从理论上讲SMX可以抑制体内结核分枝杆菌的生长,也非常有希望成为潜在的抗结核治疗药物,但需要更多的体内和体外试验对其抗结核疗效进行系统评价。
本研究虽然对磺胺类药物对结核分枝杆菌的体外抑菌作用进行了系统的分析和评价,但由于试验技术所限,仍存在以下不足:(1)虽然国内外研究均有使用MABA法检测抗生素对结核分枝杆菌MIC的报道[15-18],且该法对于 H和R的 MIC检测结果可靠[15],但对于TMP和(或)SMX检测结果的准确性尚无定论。(2)MABA法作为初步检测TMP和(或)SMX对于Mtb的MIC的方法结果比较可靠,但要慎重判读处于耐药临界值附近的MIC值。
[1]中华人民共和国卫生部疾病预防控制局,中华人民共和国卫生部医政司,中国疾病预防控制中心.中国结核病防治规划实施工作指南(2008年版).北京:中国协和医科大学出版社,2009:1.
[2]Huovinen P.Resistance to trimethoprim-sulfamethoxazole.Clin Infect Dis,2001,32(11):1608-1614.
[3]Young LS.Reconsidering some approved antimicrobial agents for tuberculosis.Antimicrob Agents Chemother,2009,53(11):4577-4579.
[4]Forgacs P,Wengenack NL,Hall L,et al.Tuberculosis and trimethoprim-sulfamethoxazole.Antimicrob Agents Chemother,2009,53(11):4789-4793.
[5]Franzblau S,Witzig R,McLaughlin J,et al.Rapid,low-technology MIC determination with clinicalM.tuberculosisisolates by using the Microplate Alamar Blue Assay.J Clin Microbiol,1998,36(2):362-366.
[6]Lewis RE,Diekema DJ,Messer SA,et al.Comparison of E-test,chequerboard dilution and time-kill studies for the detection of synergy or antagonism between antifungal agents tested against Candida species.J Antimicrob Chemother,2002,49(2):345-351.
[7]Ge F,Zeng F,Liu S,et al.In vitrosynergistic interactions of oleanolic acid in combination with isoniazid,rifampicin or ethambutol againstMycobacterium tuberculosis.J Med Microbiol,2010,59(5):567-572.
[8]Zhao Y,Xu S,Wang L,et al.National survey of drug-resistant tuberculosis in China.N Engl J Med,2012,366(23):2161-2170.
[9]Huang TS,Kunin CM,Yan BS,et al.Susceptibility ofMycobacterium tuberculosisto sulfamethoxazole,trimethoprim and their combination over a 12year period in Taiwan.J Antimicrob Chemother,2012,67(3):633-637.
[10]García-Cobos S,Campos J,Cercenado E,et al.Antibiotic resistance in Haemophilus influenzae decreased,except for betalactamase-negative amoxicillin-resistant isolates,in parallel with community antibiotic consumption in Spain from 1997to 2007. Antimicrob Agents Chemother, 2008,52 (8):2760-2766.
[11]Richter SS,Heilmann KP,Dohrn CL,et al.Activity of ceftaroline and epidemiologic trends inStaphylococcus aureusisolates collected from 43medical centers in the United States in 2009.Antimicrob Agents Chemother,2011,55(9):4154-4160.
[12]马玙,朱莉贞,潘毓萱.结核病.北京:人民卫生出版社,2006:507-531.
[13]Vilchèze C,Jacobs WR Jr.The combination of sulfamethoxazole,trimethoprim,and isoniazid or rifampin is bactericidal and prevents the emergence of drug resistance inMycobacterium tuberculosis.Antimicrob Agents Chemother,2012,56(10):5142-5148.
[14]Alsaad N,van Altena R,Pranger AD,et al.Evaluation of cotrimoxazole in treatment of multidrug-resistant tuberculosis.Eur Respir J,2012[Epub ahead of print].
[15]Leonard B,Coronel J,Siedner M,et al.Inter-and intra-assay reproducibility of microplate Alamar blue assay results for isoniazid,rifampicin,ethambutol,streptomycin,ciprofloxacin,and capreomycin drug susceptibility testing ofMycobacterium tuberculosis.J Clin Microbiol,2008,46(10):3526-3529.
[16]Yu X,Jiang G,Li H,et al.Rifampin stability in 7H9broth and Löwenstein-Jensen medium.J Clin Microbiol,2011,49(3):784-789.
[17]黄海荣,于霞,姜广路,等.利奈唑胺对分枝杆菌体外抑菌作用的初步研究.中华结核和呼吸杂志,2011,34(8):575-578.
[18]陆宇,郑梅琴,王彬,等.氯法齐明抗结核分枝杆菌的体内外活性研究.中华结核和呼吸杂志,2008,31(10):752-501.

