妊娠后期营养限饲蒙古绵羊对其胎儿生长发育及血液生理生化指标的影响
张崇志 刘迎春 高 峰* 曹 平 侯先志 李士栋
(1.内蒙古农业大学动物科学学院,呼和浩特 010018;2.内蒙古农业大学生命科学学院,呼和浩特 010018)
胎儿的生长发育是一个特殊的生理过程,需要母体通过血液循环提供大量的氨基酸、葡萄糖(GLU)和非酯化脂肪酸(NEFA)以满足其营养需要。在此期间母体的营养不良会改变胎儿的生长发育轨迹,使其生长受阻或停滞,导致胎儿宫内生长受限(IUGR)。妊娠期母体营养受限所导致的IUGR影响动物的初生重,阻碍胎儿的生长发育,而且与出生后高的发病率和死亡率密切相关[1]。胎儿期程序性的变化很可能是产后动物易患许多疾病的根本原因,包括胰岛素抵抗[2]、高血压[1,3]、心血管疾病[4]、呼吸道疾病[5]以及生理代谢的紊乱[1]等。IUGR是围产期主要并发症之一,影响动物出生后生产性能的发挥,IUGR的进一步研究对绵羊的生产体系具有重要意义,其针对绵羊胎儿期生长发育方面的研究一直没有全面深入的展开。为此,本试验旨在研究妊娠后期营养限饲蒙古绵羊对其胎儿的生长发育状况及血液生理生化指标的影响,为我国北方草原地区抗灾保畜以及妊娠母羊科学的饲养管理制度提供一定的参考依据。
1 材料与方法
1.1 试验动物
选择体况中等、2~3胎次、经同期发情受孕(Medison-SA-600 B超仪分析确定)、健康的蒙古绵羊42只[(53.28 ±4.87)kg]。基于胎儿生长发育的70%~80%在妊娠期最后2个月内完成的事实,在试验开始(妊娠90d)选择6只体重与总体平均体重接近的母羊进行屠宰,其余参照高峰[6]所述按体重随机分为3个营养水平组(表1):RG1[0.175 MJ/(kg BW0.75·d)]、RG2[0.330 MJ/(kg BW0.75·d) ]、CG [对 照 组,0.670 MJ/(kg BW0.75·d)]。不同营养水平的饲喂进行至妊娠140d,每组再选择6只具有代表性的母羊进行屠宰。

表1 限制饲养期间(妊娠后期)各组营养水平Table 1 Nutrient levels in each groupduring restriction period(late pregnancy)
1.2 饲养管理
试验羊采用人工套袋法饲喂,试验开始前,将装有2~3 cm长优质青干草的自制套袋罩在各限制组母羊嘴部供其采食,经过1周的适应期后,维持设定营养水平饲草供给量不变。试验羊分别于08:30、16:00 2次饲喂;对照组自由采食,为保证对照组充分采食,11:00加喂1次,保证每天的剩草量不低于15%。各组羊自由饮水,自由舔食盐砖。每天采集饲草、剩草样,然后分别混匀,供营养成分分析,结果见表2。
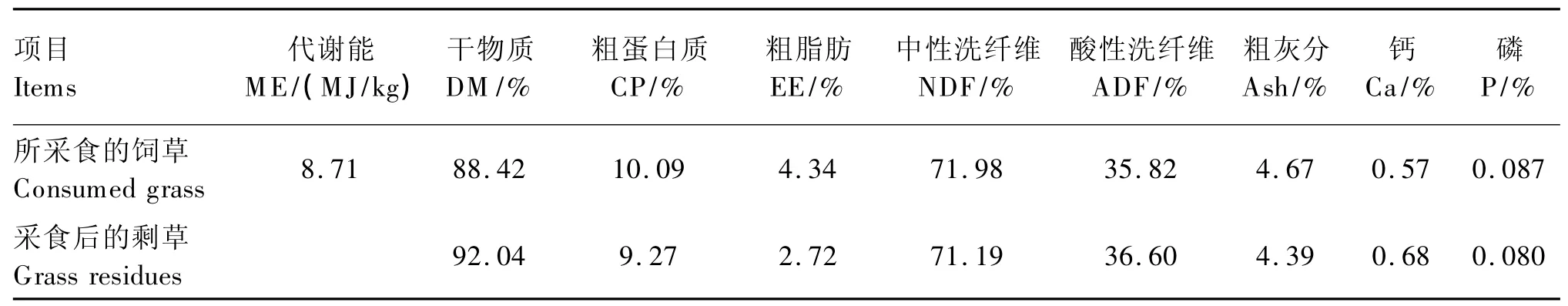
表2 限饲期饲草及剩草营养成分(风干基础)Table 2 Nutrient composition of grass and its residuesduring restriction period(air-dry basis)
1.3 屠宰方法
试验开始(妊娠90d)选择6只体重与总体平均体重接近的母羊进行屠宰,宰前停止饲喂24 h,停止饮水15 h。屠宰时尽量减少挤压,快速取出胎儿称重量取体尺后,立即用真空抗凝管心脏采血2份:一份2 mL全血用于血常规参数分析,另一份20 mL立即离心(3 500 r/min,15 min),分离血浆,-80℃保存。妊娠140d时,各组分别选择具有代表性的母羊6只进行屠宰,方法同上。
1.4 胎儿血常规参数的测定
使用血常规自动分析仪(BC-2800,Mindray,深圳)测定胎儿血浆中白细胞数、红细胞数、血红蛋白含量、红细胞压积、红细胞分布宽度变异系数、血小板数目、平均血小板体积。
1.5 胎儿血中代谢产物的测定
胎儿血浆中GLU含量采用GLU(050520)分析试剂盒(德国Prodiadiagnostics公司提供)测定,NEFA含量采用酶法NEFA(095207)试剂盒(日本积水医疗株式会社提供)测定,β-羟基丁酸(BHBA)含量采用循环酶法BHBA(095207)试剂盒(上海景源有限公司提供)测定,总蛋白(TP)含量采用双缩脲比色法TP(20110422)试剂盒(上海科华生物工程股份有限公司提供)测定,总氨基酸(TAA)含量采用比色法TAA(A026)试剂盒(南京建成生物工程研究所提供)测定,以上指标均使用日立全自动生化分析仪(7600-020)测定,严格按照说明书操作。
1.6 胎儿血中抗氧化能力的测定
胎儿血中的总抗氧化能力(T-AOC)(A015)、超氧化物歧化酶(SOD)活性(A001-1)、谷胱甘肽过氧化物酶(GSH-Px)活性(A005)、丙二醛(MDA)含量(A003-1)采用试剂盒进行测定(南京建成生物工程研究所提供),严格按照说明书测定各项抗氧化指标。
1.7 数据处理
所有数据采用SAS 9.0一般线性模型统计分析,Duncan氏法进行多重比较。
2 结果
2.1 妊娠后期营养限饲蒙古绵羊对其胎儿体重和体尺的影响
妊娠后期营养限饲蒙古绵羊对其胎儿体重和体尺的影响见表3。由表可知,妊娠140d时RG1、RG2胎儿体重显著低于 CG(P <0.01),而且RG1胎儿体重也显著低于 RG2(P<0.01);RG1胎儿体长(P <0.05)、胸围(P <0.05)、腹围(P <0.05)、曲冠臀长(P <0.01)显著低于 CG。
2.2 妊娠后期营养限饲蒙古绵羊对其胎儿血常规参数的影响
妊娠后期营养限饲蒙古绵羊对其胎儿血常规参数的影响见表4。由表可知,妊娠140d时,RG1胎儿红细胞数(P<0.01)、血红蛋白含量(P<0.01)、红细胞压积(P <0.01)显著低于 CG,而红细胞分布宽度变异系数(P<0.05)、平均血小板体积(P<0.05)显著高于CG;RG2胎儿平均血小板体积显著高于CG(P<0.05),而其他血常规参数与CG差异均不显著(P>0.05)。
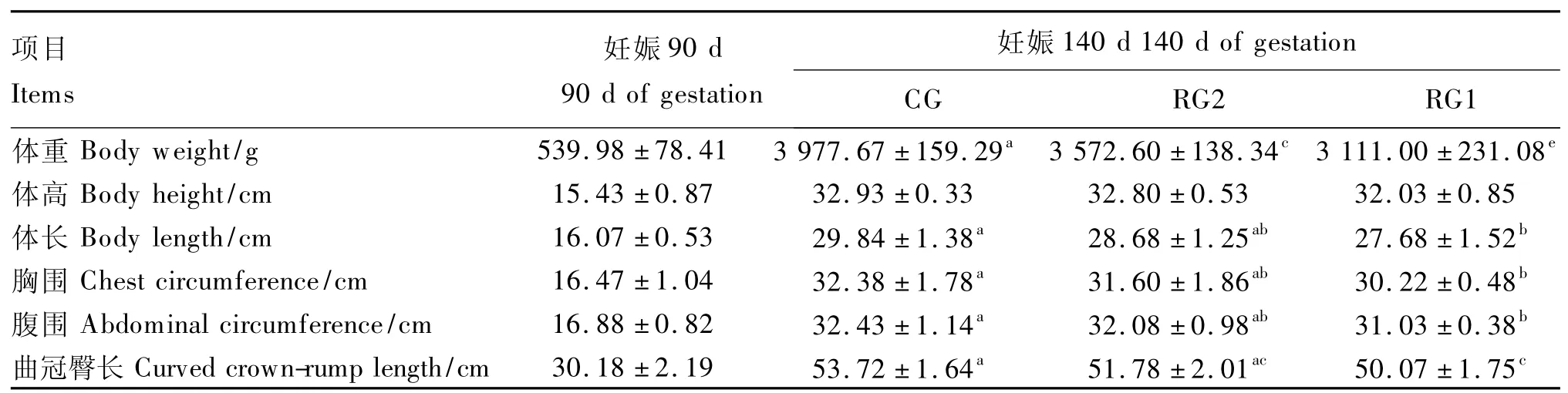
表3 妊娠后期营养限饲蒙古绵羊对其胎儿体重和体尺的影响Table 3 Effects of maternal undernutritionduring late pregnancy on body weight and measurements in Mongolia ovine fetus
2.3 妊娠后期营养限饲蒙古绵羊对其胎儿血中代谢产物的影响
妊娠后期限营养饲蒙古绵羊对其胎儿血中代谢产物的影响见表5。由表可知,随着营养水平的降低,妊娠140d时CG、RG2、RG1胎儿血浆GLU含量呈现出逐渐增加的趋势。RG1胎儿血浆TAA含量显著低于 CG(P<0.05),而 NEFA(P<0.05)、BHBA 含量(P <0.01)显著高于 RG2、CG。
2.4 妊娠后期营养限饲蒙古绵羊对其胎儿血中抗氧化能力的影响
妊娠后期营养限饲蒙古绵羊对其胎儿血中抗氧化能力的影响见表6。由表可知,妊娠140d时,RG1胎儿血浆 T-AOC(P <0.01)、SOD 活性(P<0.05)显著低于 CG,而 GSH-Px活性(P<0.05)、MDA 含量(P <0.05)显著高于 CG;RG2胎儿血浆 SOD活性(P>0.05)、T-AOC(P<0.05)低于 CG,而 GSH-Px活性、MDA含量高于CG,但均差异不显著(P >0.05)。
3 讨论
3.1 妊娠后期营养限饲对蒙古绵羊胎儿体重、体尺和血常规参数的影响
母体妊娠期的营养水平对胎儿的生长发育有显著的影响。在本试验条件下,严重限制了RG1和RG2胎儿的体重,RG1胎儿的体尺指标(除体高外)显著受到影响,这与 Regnault等[7]、高峰[6]报道结果一致。血常规参数中红细胞数、血红蛋白含量、红细胞压积是表现不同类型营养性贫血的重要指标[8-9]。RG1胎儿红细胞数、血红蛋白含量、红细胞压积显著降低,这些参数表明RG1胎儿已发生了严重的营养性贫血。对于RG2来说,只有平均血小板体积显著高于CG,其他血液参数并没有显著变化。单一的平均血小板体积的变化不能说明贫血的发生,但这或许是母体营养不良引发胎儿身体状况改变的一个重要起始信号。

表4 妊娠后期营养限饲蒙古绵羊对其胎儿血常规参数的影响Table 4 Effects of maternal undernutritionduring late pregnancy on blood routine parameters in Mongolia ovine fetus

表5 妊娠后期营养限饲蒙古绵羊对其胎儿血中代谢产物的影响Table 5 Effects of maternal undernutritionduring late pregnancy on metabolites in blood of Mongolia ovine fetus
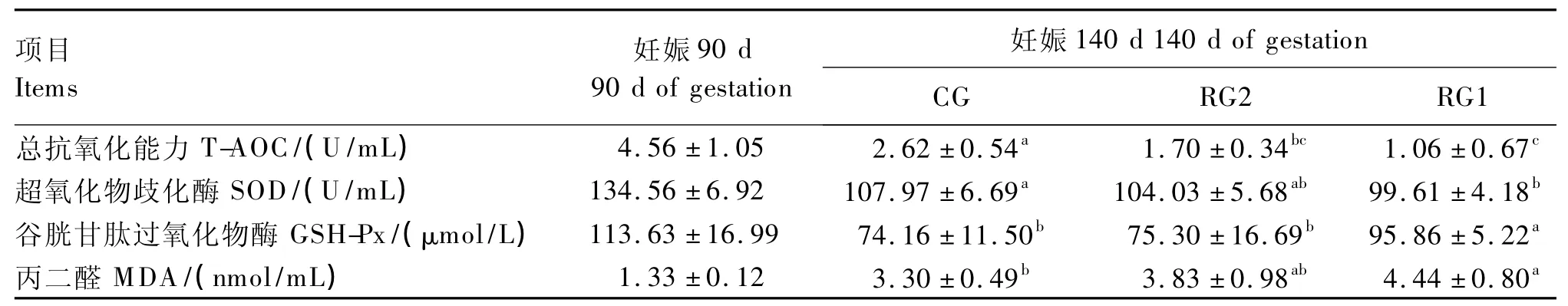
表6 妊娠后期营养限饲蒙古绵羊对其胎儿血中抗氧化能力的影响Table 6 Effects of maternal undernutritionduring late pregnancy on antioxidant capacity in blood of Mongolia ovine fetus
3.2 妊娠后期营养限饲对蒙古绵羊胎儿血中代谢产物的影响
血液中各种生化指标的含量和变化规律是动物体重要的生物学特征。在本试验条件下,RG1胎儿血浆NEFA、BHBA含量的显著升高表明了胎儿大量动员脂肪组织以满足自身的营养需要,但是胎儿对BHBA的氧化速度是有限度的,大量的BHBA蓄积在体内易使胎儿产生一系列代谢疾病[10]。随着营养水平的降低,受限组胎儿血浆GLU含量有增加的趋势,NEFA含量的升高节约了GLU的利用,这可能是动物体在营养不足的情况下经典的 GLU节约机制[11]。另外,RG1胎儿血中显著降低的TAA含量表明母体供给胎儿的氨基酸减少,这也是胎儿蛋白质的合成能力及效率降低的可能原因。随着母体营养水平的降低,从生理生化角度也表明胎儿的受限制程度逐步加深。
3.3 妊娠后期营养限饲对蒙古绵羊胎儿血中抗氧化能力的影响
氧化应激指机体在遭受各种有害刺激时,体内高活性分子产生过多,氧化程度超出氧化物的清除,氧化系统和抗氧化系统失衡,导致组织损伤、细胞死亡[12]。MDA是脂质过氧化产物的降解物,其含量变化反映机体内自由基的积累程度[13]。在本试验条件下,尽管RG1胎儿血浆中GSH-Px活性显著增加去阻止脂质过氧化物的产生,但是胎儿血浆中显著低活性的SOD导致T-AOC显著降低,显著高含量的MDA表明RG1胎儿已发生氧化应激,氧化应激的发生和T-AOC的降低表明RG1胎儿氧化系统和抗氧化系统之间的平衡已被打破。对于RG2来说,T-AOC的显著降低可能是SOD和GSH-Px活性波动的一个累积效应,但是RG2 MDA的含量并没有显著升高,表明RG2胎儿并没有发生氧化应激,氧化系统和抗氧化系统之间的平衡仍在可控制的范围之内。
4 结论
①在本试验条件下,妊娠后期营养限饲母羊显著影响了胎儿的生长发育,而且随着营养水平的降低,受限制程度加剧。
②在本试验条件下,RG1胎儿产生了严重的营养性贫血,营养代谢失调,发生氧化应激,而RG2胎儿受影响程度较轻,其健康状况还在可控范围之内。
[1] MCMILLEN I C,ADAMS M B,ROSS J T,et al.Fetal growth restriction:adaptations and consequences[J].Reproduction,2001,122:195 -204.
[2] HAYDEN J M,WILLIAMS J E,COLLIER R J.Plasma growth hormone,insulin like growth factor,insulin,and thyroid hormone association with body protein and fat accretion in steers undergoing compensatory gain afterdietary energy restriction[J].Journal of Animal Science,1993,71:3327 -3338.
[3] GLUCKMAN P D,HANSON M.Developmental origins ofdisease paradigm:a mechanistic and evolutionary perspective[J].Review Pediatric Research,2004,56:311-317.
[4] BARKER D J P.The long-term outcome of retarded fetal growth 1[J].Schweiz Med Wochenschr,1999,129:189-96.
[5] MARITZ G S,COCK M L,LOUEY S,et al.Fetal growth restriction has long-term effects on postnatal lung structure in sheep[J].Pediatric Research,2004,55:287-295.
[6] 高峰.妊娠后期限母羊对其胎儿生长发育及出生后羔羊补偿生长的影响[D].博士学位论文.呼和浩特:内蒙古农业大学,2006:31-35.
[7] REGNAULT T R,DEVRIJER B,GALAN H L,et al.Development and mechanisms of fetal hypoxia in severe fetal growth restriction[J].Placenta,2007(28):714-723.
[8] VERSPYCK E,GAILLARD G,PARNET F.Fetal lacticdehydrogenase variation in normal pregnancy and in case of severe intrauterine growth restriction[J].Prenatal Diagnosis,1999,19(3):229 -233.
[9] 钟燕芳,廖灿,李秋明等.胎儿血生理指标检测及在产前诊断的研究[J].中国优生与遗传杂志,2005,13(8):57-58.
[10] SMITH T R,HIPPEN A R,BEITZ D C.Metabolic characteristics of induced ketosis in normal and obesedairy cows[J].Journal of Dairy Science,1997,80:1569-1581.
[11] VHEELOCK J B,RHOADS R P,VANBAALE S R.Effects of heat street on energetic metabolism in lactating Holstein cows[J].Journal of Animal Science,2010,93:644 -655.
[12] PHAM-HUY L I,HE H,PHAM-HUY C.Free radicals,antioxidants indisease and health[J].International Journal of Biomedical Science,2008,4:89 -96.
[13] 张庆丽,谭支良,贺志雄,等.营养限制对断奶羔羊血浆和胃肠道上皮组织抗氧化能力的影响[J].动物营养学报,2010,22(5):1320 -1327.

