热应激对奶牛瘤胃液微生物数量的影响
杜瑞平 温雅俐* 姚焰础 江 山 高 民**
(1.内蒙古农牧业科学院动物营养研究所,呼和浩特 010031;2.重庆市畜牧科学院动物营养研究所,重庆 402460)
荷斯坦奶牛具有耐寒不耐热的特性,炎热的夏季,特别是高湿高热的南方地区,奶牛容易发生热应激[1],造成养殖效益严重下滑。热应激时,奶牛表现为呼吸加快、体温升高、散热量减少,从而导致食欲下降,采食量和产奶量显著降低[2];另外,生理代谢紊乱,内分泌发生改变,直接导致奶牛的免疫力和繁殖性能显著降低[3]。因此,确定热应激对奶牛代谢和生产性能影响的程度及作用机理,研发配套的热应激缓解技术并最终提高奶牛福利和牛场养殖效益已成为动物营养工作者的重要任务之一。国内外学者关于奶牛热应激已做了大量的研究,主要集中在热应激对奶牛生理机能[4-7]、采食消化[8-10]、血液生理生化指标[11-12]、瘤胃内 环 境[13-15]、生 产 性 能[2,16-17]以 及 繁 殖 性能[18-20]等影响的研究上,而关于热应激时奶牛瘤胃内菌群结构变化的研究较少。因此,本试验采用实时荧光定量PCR技术研究热应激对不同泌乳阶段奶牛瘤胃液微生物数量的影响,旨在为改善和缓解热应激的不良影响提供理论依据。
1 材料与方法
1.1 试验设计
采用2×3交叉试验设计,选择18头经产中国荷斯坦奶牛,根据试验前1周胎次、平均泌乳天数和产奶量相近的原则,分为泌乳前期(产后15~100d)组、泌乳中期(产后112~175d)组、泌乳后期(产后200~230d)组(表1),每组6个重复,根据实测的牛场温湿指数(temperature and humidity index,THI)变化,采用热应激与非热应激的自身对照试验。预试期为15d,正试期分为热应激期(2010年7月20日—2010年8月30日)和非热应激期(2010年8月31日—2010年9月28日)。热应激期按照 Armstrong[21]的评价(即 THI< 72无热应激反应;72~79轻度热应激;80~89中度热应激;90及以上严重危险)又相应分为热应激前期(2010年7月20日—2010年8月9日)、热应激中期(2010年8月10日—2010年8月13日)和热应激后期(2010年8月14日—2010年8月30日)。

表1 试验分组Table 1 Experimental groups
1.2 饲养管理与试验饲粮
按牛场正常饲养管理规程进行。试验奶牛饲养于含有双侧排风扇的拴系式双列对头牛舍(钟楼式)中,每头奶牛定栏定位饲喂,每天饲喂3次,即05:00~06:00、12:30~13:30、17:00~18:00。饲喂方式为先粗后精。精料定量饲喂,粗料自由采食,自由饮水。试验饲粮组成及营养水平见表2。
1.3 牛场THI的测定
在牛舍的中部和两端距地面1.5 m高处分别挂置干湿球温度计(河北武强滏阳仪表厂生产,有效量程:0~40℃,相对湿度:10% ~100%),保证温湿度表的有效通风,防止阳光照射和雨淋,并避免奶牛触及。每天08:00、14:00、20:00记录干球温度和湿球温度,求3次平均值。计算公式为:

式中:Td为干球温度(℃),Tw为湿球温度(℃)。
1.4 奶牛直肠温度、体表温度和呼吸频率的测定
分别于热应激前、中和后期及非热应激期选择2d,在每天08:00、14:00、20:00分3次测定供试奶牛的直肠温度、体表温度和呼吸频率,取均值用于辅助热应激状态的判定。具体方法参照《家畜环境卫生学》[22]。
1.5 瘤胃液的采集与处理
分别于热应激的前、中和后期以及非热应激期选择1d,在中午限制饲喂之后(14:00~15:00),于18头奶牛中随机选择6头采集瘤胃液[22],方法:奶牛绑定,口腔插管,用泵抽取瘤胃液。每头奶牛采集200 mL,分别装到10 mL灭菌离心管中,于-80℃保存以备微生物数量的测定。
1.6 微生物数量的测定
1.6.1 主要试剂
总 RNA提取试剂(Trizol,Invitrogen,美国);反转录试剂盒(Bio-Serve,上海);普通PCR扩增试剂盒(Hot-start PCR Mix,Bio-Serve,上海);实时荧光定量PCR试剂盒(SYBR Green I PCR Mix,Bio-Serve,上海)。
1.6.2 主要仪器
普通 PTC-200 PCR仪(MJ,美国);电泳仪(Bio-Rod,美国);组织匀浆仪(Pro Scientific,美国);NanoDrop1000微量分光光度计(Thermo,美国);凝胶成像分析仪(UVP,美国);5417R离心机(Eppendorf,德国);ABI7500实时荧光定量 PCR仪(ABI,美国)。
1.6.3 瘤胃液的预处理以及DNA的提取
1)瘤胃液样本完全融化后,先用200目小块纱布覆盖于管口,然后倒置并用新的2 mL灭菌离心管收集约600 μL滤液,残留物保存于-80℃;
2)将上步的600 μL滤液12 000 r/min离心10 min,留下沉淀继续裂解,上清液约500 μL装于新的2 mL灭菌离心管中-80℃保存备用;
3)在上步沉淀中加入500 μL一步法裂解液,振荡混匀1 min,100 ℃煮10 min,12 000 r/min离心10 min后取上清液约500 μL装于新的2 mL灭菌离心管中;
4)将上步上清液12 000 r/min离心10 min,取上清液约400 μL装于新的1.5 mL灭菌离心管中作为PCR扩增模板。

表2 试验饲粮组成及营养水平(干物质基础)Table 2 Composition and nutrient levels of experimentaldiets(DM basis) %
1.6.4 引物设计
引物的设计与合成参考高爱武[23]的方法,并在此基础上做了改进。委托专业技术公司合成。具体引物设计见表3。冻干粉状态的引物离心后,用灭菌超纯水配制成 100 μmol/L贮备液和20 μmol/L工作液,-20 ℃保存。
1.6.5 实时荧光定量PCR反应体系和条件
实时荧光定量PCR反应体系见表4。
优化反应程序:95℃预变性3 min;95℃变性30 s,55 ℃ 退火30 s,72 ℃ 延伸 30 s,35 ~40 个循环;72℃最终延伸15 min。
1.7 数据统计与分析
试验数据统计利用SAS 9.0软件包中的平衡试验设计方差分析过程(ANOVA),均值的多重比较采用Duncan氏法进行,结果用平均值±标准误来表示,其中 P<0.05表示组间差异显著,P<0.01表示组间差异极显著。

表3 引物设计Table 3 Primerdesign

表4 实时荧光定量PCR反应体系Table 4 Real-time fluorescence quantitative PCR reaction system
2 结果
2.1 牛舍环境温度与THI的变化及试验期奶牛直肠温度、体表温度和呼吸频率
5~25℃的环境温度是奶牛的适温区,当牛舍温度高于25℃或者THI>72,即引起奶牛的热应激[24]。由表5可看出,在热应激前、中和后期牛舍平均气温在29.43~36.83℃,超出了奶牛的适温区。由于试验所在地湿度较高,所以选用THI作为评价指标较为适宜。热应激前、中和后期牛舍平均THI在80.92~88.53之间,而非热应激期牛舍的THI<72。判断奶牛热应激的首要标准是THI,其次可结合生理指标进行判断。奶牛正常直肠温度为37.50~39.50℃,而奶牛正常呼吸频率为10~30次/min,生理指标一方面可与正常水平进行比较,另一方面看这些指标在热应激期和非热应激期是否差异显著。所以THI再结合表6中生理指标可知,热应激期整个牛场的奶牛处于中度热应激状态。

表5 牛舍环境温度与THITable 5 Environmental temperature and THI in the house ofdairy cows

表6 试验期奶牛直肠温度、体表温度和呼吸频率表6 The rectum temperature,skin temperature and respiratory rate ofdairy cows in trial period
2.2 热应激对奶牛瘤胃液微生物数量的影响
2.2.1 热应激对奶牛瘤胃液总细菌数量的影响
奶牛瘤胃液微生物在39.0~39.5℃最活跃,高于此温度对瘤胃发酵不利[25]。可见,热应激对奶牛瘤胃微生物有一定的影响。由表7可看出,泌乳中、后期组奶牛热应激期的瘤胃液总细菌数量极显著低于非热应激期(P<0.01),而泌乳前期组奶牛热应激前、中、后期及整个热应激期的瘤胃液总细菌数量均极显著高于非热应激期(P<0.01)。而且不同泌乳阶段组奶牛瘤胃液总细菌数量差异极显著(P<0.01),在热应激中期,THI最高时,泌乳前、中期组奶牛瘤胃液总细菌数量极显著高于泌乳后期(P<0.01),但在整个热应激期,泌乳前、中期组奶牛瘤胃液总细菌数量变化趋势一致即先升高后降低,而泌乳后期组呈增加趋势。
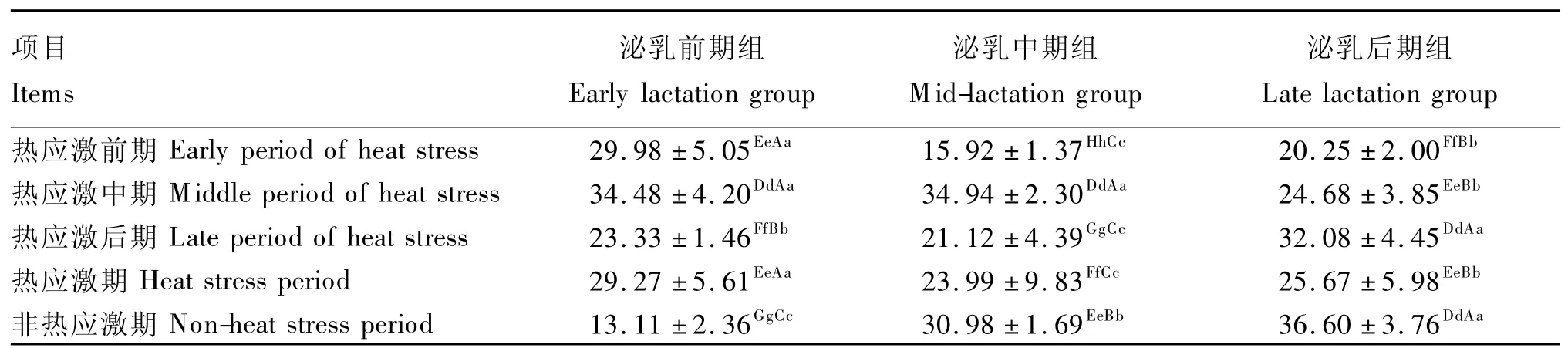
表7 热应激对奶牛瘤胃液总细菌数量的影响Table 7 Effects of heat stress on the number of total bacteria in rumen fluid ofdairy cows 106copies/mL
2.2.2 热应激对奶牛瘤胃液厌氧真菌数量的影响
由表8可看出,泌乳前期组奶牛在热应激前、中、后期及整个热应激期的瘤胃液厌氧真菌数量均极显著高于非热应激期(P<0.01),但泌乳中、后期组奶牛该指标热应激期与非热应激期差异不显著(P>0.05)。且同一热应激期不同泌乳阶段组奶牛瘤胃液厌氧真菌数量差异极显著(P<0.01),但规律不一致。
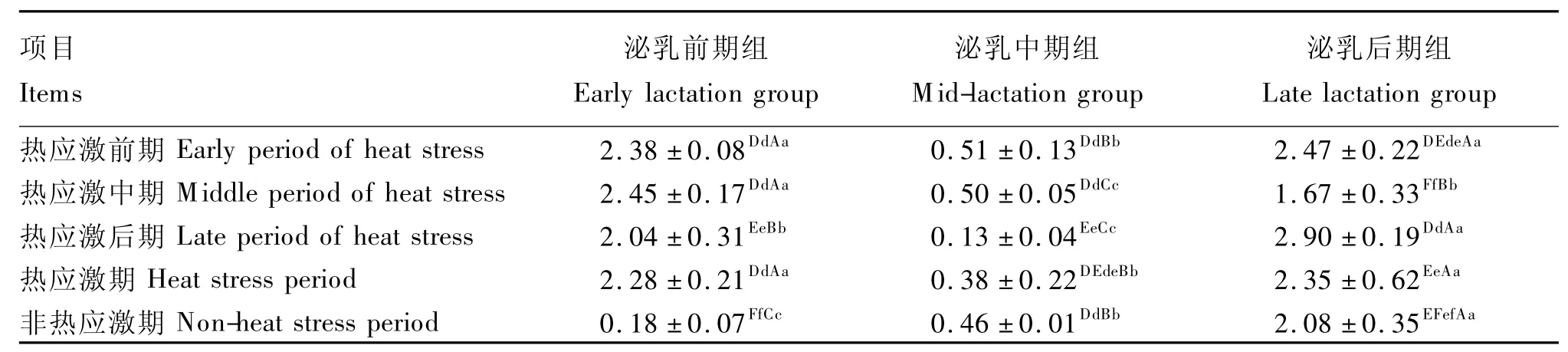
表8 热应激对奶牛瘤胃液厌氧真菌数量的影响Table 8 Effects of heat stress on the number of anaerobic fungi in rumen fluid ofdairy cows106copies/mL
2.2.3 热应激对奶牛瘤胃液纤维分解菌数量的影响
瘤胃中的纤维降解菌主要包括产琥珀酸拟杆菌、黄化瘤胃球菌、白色瘤胃球菌和一些溶纤维丁酸弧菌[26]。
由表9可看出,泌乳前、中期组奶牛热应激期瘤胃液产琥珀酸拟杆菌数量极显著高于非热应激期(P<0.01),而泌乳后期组奶牛瘤胃液产琥珀酸拟杆菌数量则呈相反规律(P<0.01),同一热应激期不同泌乳阶段组奶牛瘤胃液产琥珀酸拟杆菌数量差异极显著(P<0.01),但规律性不一致。
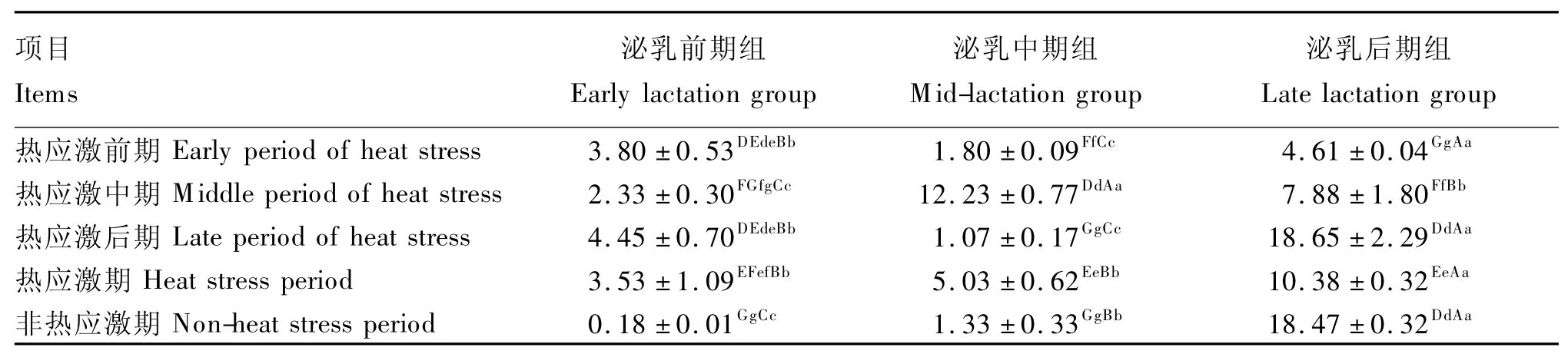
表9 热应激对奶牛瘤胃液产琥珀酸拟杆菌数量的影响Table 9 Effects of heat stress on the number of Bacteroides succinogenes in rumen fluid ofdairy cows 104copies/mL
由表10可看出,泌乳前期组奶牛热应激前、中、后期及整个热应激期瘤胃液白色瘤胃球菌数量均极显著高于非热应激期(P<0.01),而泌乳中、后期组奶牛热应激期的瘤胃液白色瘤胃球菌数量则呈相反规律(P<0.01),且不同泌乳阶段组奶牛在同一热应激期的瘤胃液白色瘤胃球菌数量差异极显著(P<0.01),泌乳前期组的白色瘤胃球菌数量均极显著高于中、后期(P<0.01)。
由表11可看出,泌乳前、后期组的奶牛热应激前、中、后期及整个热应激期瘤胃液黄化瘤胃球菌数量极显著高于非热应激期(P<0.01),且不同泌乳阶段组奶牛同一应激期瘤胃液黄化瘤胃球菌数量差异极显著(P<0.01),但无规律性。
2.2.4 热应激期奶牛瘤胃液微生物数量与THI的相关性分析
由表12可以看出,整个热应激期的THI与泌乳前期组奶牛瘤胃液总细菌数量(P<0.01)、厌氧真菌数量(P<0.05)、白色瘤胃球菌数量(P<0.01)和黄化瘤胃球菌数量(P<0.05)有较强的相关性,而泌乳中、后期组奶牛的瘤胃液微生物数量仅泌乳后期组奶牛瘤胃液的黄化瘤胃球菌数量与THI有极显著相关性(P<0.01),其他相关性均不显著(P >0.05)。

表10 热应激对奶牛瘤胃液白色瘤胃球菌数量的影响Table 10 Effects of heat stress on the number of Ruminococcus albus in rumen fluid ofdairy cows 106copies/mL
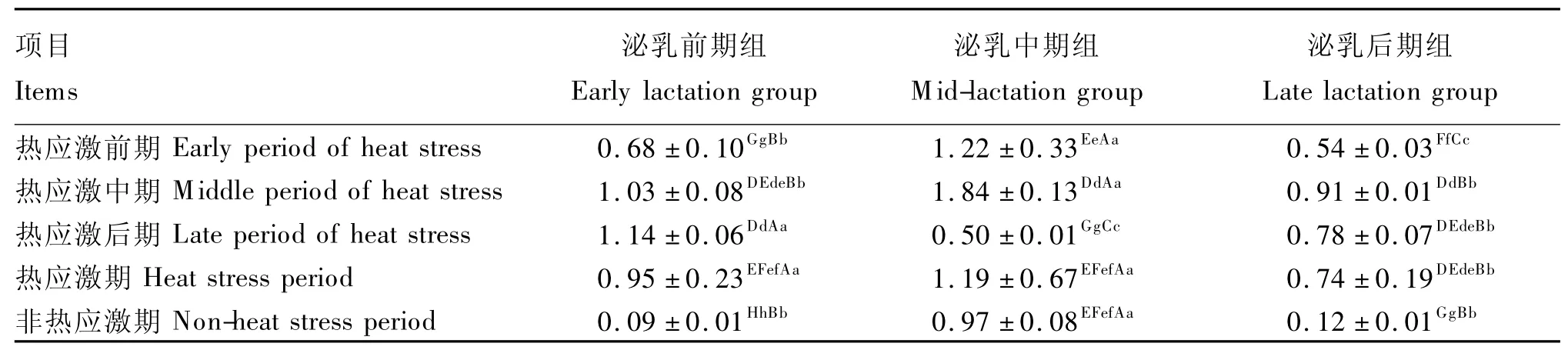
表11 热应激对奶牛瘤胃液黄化瘤胃球菌数量的影响Table 11 Effect of heat stress on the number of Ruminococcus flavefaciens in rumen fluid ofdairy cows 106copies/mL
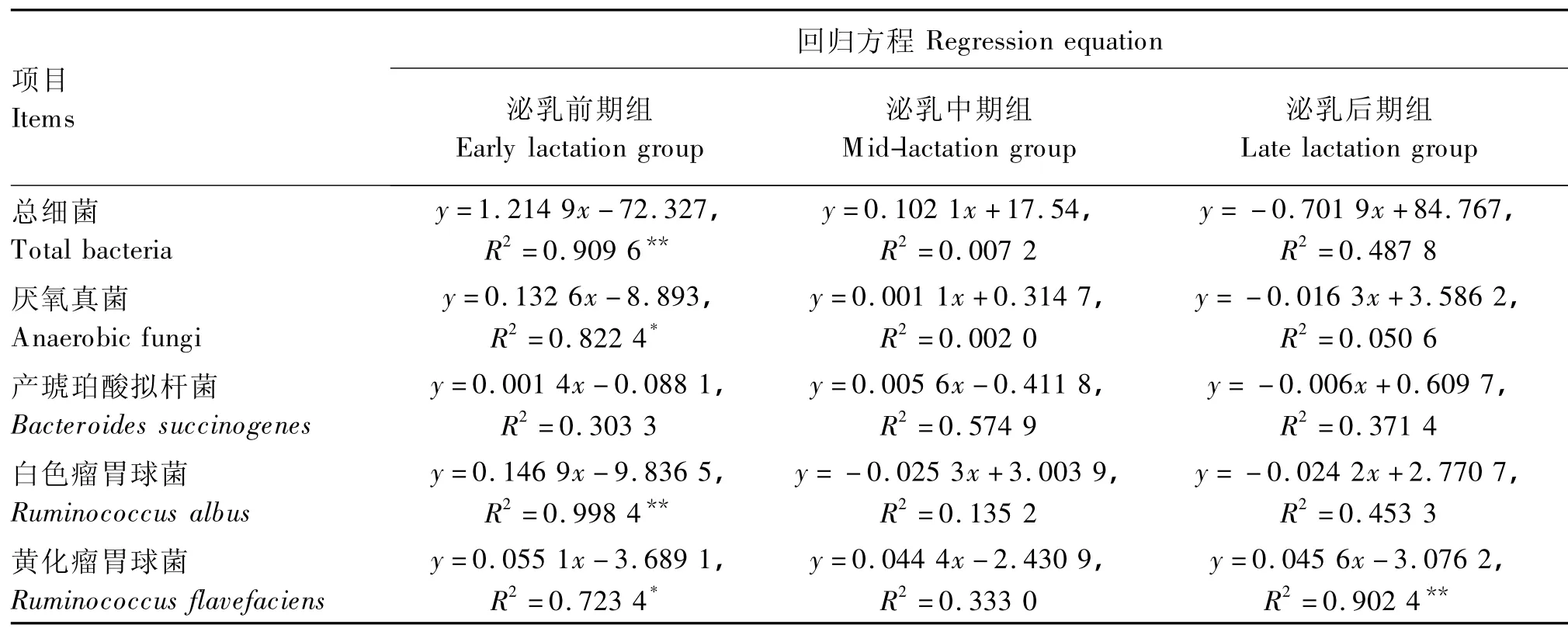
表12 热应激期奶牛瘤胃液微生物数量与THI的相关性分析Table 12 Correlation analysis between microbial number in rumen fluid ofdairy cows and THI in heat stress period
3 讨论
3.1 试验期间牛舍THI的变化
West等[2]认为,尽管白天的较高气温、相对湿度和辐射使奶牛产生明显的热应激反应,但夜间给予奶牛充足的降温时间,奶牛仍可耐受较高的白天温度。Igono等[27]也报道,尽管白天气温较高,但只要夜间低于21℃维持3~6 h将降低产奶量的下降程度。其他研究者认为,环境改变与动物反应之间存在延迟效应,但也有使用当天环境状况来评价热应激对奶牛生产性能影响的报道[28]。West等[2]报道,在热天提前 2d 的 THI对当天的产奶量的影响最大,且提前2天的气温对干物质采食量的影响最敏感。前2天平均THI每增加1单位,荷斯坦奶牛产奶量下降0.88 kg,而干物质采食量在环境温度每增加1℃时,下降0.85 kg。而本试验中,热应激期间,即使在夜间,牛舍的平均最低THI仍>72,奶牛仍然处于热应激状态。本试验同期相关研究(生理、生产试验)表明,奶牛热应激时部分指标有延迟效应,而部分指标与当天的THI相关性较强[29]。因此,本试验采用当天的THI来判断与奶牛热应激的相关性。
3.2 热应激对奶牛瘤胃液微生物数量的影响
早期的瘤胃微生物研究一般采用50年代Hungate设计的体外滚管培养法和微生物厌氧培养技术;20世纪80年代,以核糖体RNA为主的分子生物学技术发展迅速并应用于瘤胃微生物的研究;现在人们可以应用现代分子生物学技术更全面地鉴定瘤胃微生物的种类,完善微生物的分类系统。
瘤胃是一个动态的、开放的微生态系统,其微生物区系主要有细菌、原虫及厌氧真菌组成。众所周知,反刍动物是粗饲料的主要利用者,纤维物质主要在瘤胃中被降解和消化,瘤胃的这种强效降解作用是依靠瘤胃微生物来完成的,其中纤维分解菌发挥着重要的作用。瘤胃中的纤维降解菌主要包括产琥珀酸拟杆菌、黄化瘤胃球菌、白色瘤胃球菌和一些溶纤维丁酸弧菌。2种瘤胃球菌是反刍动物瘤胃中降解植物细胞壁活性最高的革兰氏阳性菌。白色瘤胃球菌和黄化瘤胃球菌均能产生大量的纤维素酶和半纤维素酶,其中主要是木聚糖酶。产琥珀酸拟杆菌为革兰氏阴性菌,不运动,纤维分解活性很高,是瘤胃纤维分解菌的优势菌株之一,但不能降解木聚糖,其纯培养菌具有很强的降解结构性坚韧物质(如秸秆)的能力,能够降解一些黄化瘤胃球菌所不能降解的某些同质异晶体纤维素,是研究纤维素酶最早的瘤胃菌株之一[30]。
瘤胃微生物对温度要求较严格,在39.0~39.5℃时最活跃,高于此温度对瘤胃发酵不利。而且瘤胃内纤维分解菌对pH也有较严格的要求,pH 6.6 ~7.0 最为活跃,对纤维消化较好[25],而热应激时,奶牛流涎增多,采食量下降,这必然导致瘤胃的pH变化,造成消化障碍[31]。可见,热应激对奶牛瘤胃微生物有一定的影响,但对每一种微生物的影响不尽一致。Tajima等[28]报道,不同环境温度对热应激青年牛瘤胃微生物组成无显著影响,但受相对湿度和体重影响较大。李旦等[32]报道,热应激对不同个体奶牛间产琥珀酸拟杆菌和黄化瘤胃球菌数量影响差异较小。王建平等[33]利用实时荧光定量PCR技术定量6种纤维分解菌数量的研究结果表明,在热应激状态下,奶牛瘤胃中黄化瘤胃球菌和栖瘤胃普雷沃氏菌数量变化较大。
本研究结果中,在热应激条件下,泌乳前期组奶牛的几种微生物数量和泌乳后期组的黄化瘤胃球菌数量及泌乳中期组的产琥珀酸拟杆菌数量均极显著高于非热应激期。同时,泌乳中、后期组奶牛瘤胃液总细菌数量和白色瘤胃球菌数量及泌乳后期组的产琥珀酸拟杆菌数量则显著低于非热应激期。这些研究结果与前人不尽一致,本试验同期进行的生产性能试验结果表明,热应激的同一阶段及非热应激期条件下,不同泌乳阶段的试验牛采食量无显著差异,而同一泌乳阶段条件下,非热应激期采食量显著高于热应激期。同时,热应激条件下,泌乳前期的试验牛挥发性脂肪酸、氨氮浓度显著高于泌乳中、后期[29]。所以,泌乳前期与中、后期试验牛采食量无显著差异的情况下,由于瘤胃发酵特性的不同,导致微生物数量的差异。当然还可能与不同泌乳阶段奶牛饲粮结构、生理状态等差异有关,有待持续深入的研究加以验证说明。
4 结论
①泌乳前期组奶牛热应激期的瘤胃液各类微生物数量均极显著高于非热应激期,但对泌乳中、后期组的各类微生物数量影响无规律性。
②热应激THI与泌乳前期组奶牛瘤胃液总细菌数量、厌氧真菌数量、白色瘤胃球菌数量和黄化瘤胃球菌数量有较强的相关性,而THI与泌乳中、后期组奶牛的这些指标相关性较差,说明泌乳前期瘤胃液微生物数量对热应激的反应更敏感。
[1] 谢江昂,傅童生.奶牛热应激研究进展[J].动物医学进展,2008,29(9):82 -85.
[2] WEST J W,MULLINIX B G,BERNARD J K.Effects of hot,humid weather of milk temperature,dry matter intake,and milk yield of lactatingdiary cows[J].Journal of Dairy Science,2003,86:232 -242.
[3] 莫放.养牛生产学[M].北京:中国农业大学出版社,2003:2.
[4] BERMAN Y,FOLMAN M,KAIM M,et al.Upper critical temperatures and forced ventilation effects for high-yieldingdairy cows in a subtropical climate[J].Journal of Dairy Science,1985,68:1488 -1495.
[5] 安代志.高温环境的评定及其高产奶牛体温调节特性[D].硕士学位论文.南京:南京农业大学,2005:6.
[6] 李忠浩,王丽.热应激对荷斯坦奶牛生理常数的影响[J].湖北农业科学,2009,48(9):2205 -2207.
[7] 张峰,王学清,李魁英.热应激下奶牛体温、呼吸频率与环境温湿指数的相关性[J].饲料工业,2010,31(13):24-25.
[8] SAIADY M Y,SHAIKH M A,MUFARREJA S I,et al.Effect of chelated chromium supplementation on lactation performance and blood parameters of Holstein cows under heat stress[J].Animal Feed Science and Technology,2004,117:223 -233.
[9] SOLIMAN E,ABOLEL-MOTY A,FAHMY S,et al.Some physiological responses of lactating Friesian cows todietary fat supplementation[J].Alexandria Journal of Agricultural Research,2001,46:21 -29.
[10] 薛白,王之盛,李胜利,等.温湿指数与奶牛生产性能的关系[J].中国畜牧兽医,2010,37(3):153-157.
[11] 李建国,桑润滋,张正珊,等.热应激对奶牛生理常值、血液生化指标、繁殖及泌乳性能的影响[J].河北农业大学学报,1998(4):69-70.
[12] WISE M E,ARMSTRONG D V,HUBER J,et al.Hormonal alteration in the lactationdairy cow in response to thermal stress[J].Journal of Dairy Science,1998,71:2480 -2484.
[13] 王建平,王加启,卜登攀,等.高温条件下高产和中产奶牛产奶性能及瘤胃发酵的研究[J].动物营养学报,2010,22(1):51 -56.
[14] SCHNEIDER P,SKLAN D,CHALUPA W,et al.Feeding calcium salts of fatty acids to lactating cows[J].Journal of Dairy Science,1988,71(8):2143 -2150.
[15] BAUMGARD L H,WHEELOCK J B,SHWARTZ G,et a1.Effects of heat stress on nutritional requirements of lactatingdairy cattle[C]//Proceedings of the 5th annual Arizonadairy production conference.Arizona:The University of Arizona,2006:8 -16.
[16] UMPHREY J E,MOSS B R,WILCOX C J,et al.Interrelationships in lactating Holsteins of rectal and skin temperatures,milk yield and composition,dry matter intake,body weight,and feed efficiency in summer in Alabama[J].Journal of Dairy Science,2001,84:2680-2685.
[17] 杨毅,梁荣嵘,刘庆华,等.轻微至中度热应激对荷斯坦奶牛生理指标及产奶性能的影响[J].中国农学通报,2009,25(24):28 -31.
[18] 唐俊英.热应激对奶牛生产力的影响[J].中国奶牛,2000(2):27-28.
[19] JORDAN E R,SCHOUTEN M J,QUAST J W,et al.Comparison of two timed artificialinsemination(TAI)protocols for management of first insemination postpartum[J].Journal of Dairy Science,2002,85:1002-1008.
[20] BRYANT J R,LOPEZ-VILLALOBOS N,PRYCE J E.et al.Environmental sensitivity in New Zealanddairy cattle[J].Journal of Dairy Science,2007,90:1538-1547.
[21] ARMSTRONG D V.Heat stress interaction with shade and cooling[J].Journal of Dairy Science,1994,77:2044 -2050.
[22] 李如治.家畜环境卫生学[M].3版.北京:中国农业出版社,2003:42-43.
[23] 高爱武.分别驱除厌氧真菌和原虫对绵阳瘤胃微生物种群及纤维物质降解的影响[D].博士学位论文.呼和浩特:内蒙古农业大学,2008.
[24] 李如治.奶牛热应激研究现状[J].中国奶牛,1995(4):38-40.
[25] 廖晓霞,叶均安.泌乳奶牛热应激研究进展[J].中国饲料,2005(19):21-23.
[26] HOBSON P N,STEWART C S.Rumen microbial ecosystem[M].London:Blackie Academic& Professional,1997.
[27] IGONO M O,BJOTVEDT G,SANFORD-CRANE H T.Environmentalprofile and criticaltemperature effects on milk production of Holstein cows indesert climate[J].International Journal of Biometeorology,1992,36:77 -87.
[28] TAJIMA K,NONAKA I,HIGUCHI K,et al.Influence of high temperature and humidity on rumen bacterialdiversity in Holstein heifers[J].Anaerobe,2007,13(2):57 -64.
[29] 温雅俐.热应激对奶牛生产性能及生理机能的影响[D].硕士学位论文.呼和浩特:内蒙古农业大学,2011.[30] KOIKE S,KOBAYASHI Y.Fibrolytic rumen bacteri
a:their ecology and functions[J].Asian-Australia
Journal of Animal Science,2009,22(1):131 -138.[31] 高民,杜瑞平,温雅俐.热应激对奶牛生产的影响及
应对策略[C]//发展低碳农业应对气候变化-低碳
农业研讨会论文集.北京:中国农业出版社,2010.
[32] 李旦,王加启,卜登攀,等.应用Real-time PCR方法测定瘤胃液功能菌群数量[J].农业生物技术学报,2008,16(5):787 -791.
[33] 王建平,王加启,卜登攀,等.热应激对奶牛瘤胃纤维分解菌的影响[J].农业生物技术学报,2010,18(2):302-307.

