纳米CoOOH 颗粒的合成及其作为锂离子电池负极材料的研究
郑 平,马晓玲
(湖北第二师范学院 化学与生命科学学院,武汉 430205)
为了缓解能源压力、改善生态环境质量、提倡低碳生活,作为环保型的新能源之一,发展锂离子电池具有重要的意义.锂离子电池的性能好坏很大程度上取决于电极材料,包括正极材料和负极材料[1-3].为提高锂离子电池的能量密度和安全性,科研工作者探索研究了大量的负极材料[4].当前,锂离子电池的负极材料主要是石墨,但为更好的满足未来经济社会发展对供能设备的要求,世界各国研究人员投入巨大的精力寻求更好的替代产品[5].自从2000年Poizot和J.M.Tarascon 等科学家提出纳米级的过渡金属氧化物作为可逆锂离子电池的负极材料以来[6],世界各国的研究人员对过渡金属氧化物展开了深入而广泛的研究[7].
虽然研究人员探索了大量过渡金属化合物作为锂电池的负极材料,但是几乎所有的化合物局限于简单的过渡金属氧化物或者其他过渡金属基的二元化合物.前人研究了FeOOH[8]、VOOH[9]作为锂离子电池材料的性能,得到MOOH+Li++e-→MOOHLi(M=Fe,V)的反应机理.但是,就笔者所知,目前为止关于羟基氧化钴(CoOOH)作为锂离子电池负极材料的报道较少.因此本文探索了纳米CoOOH 颗粒的合成及其作为锂离子电池负极材料的性能研究.以CoSO4·6H2O 和NaOH为原料,采用共沉淀法,合成纳米CoOOH,采用X射线衍射(XRD),透射电镜(TEM),热分析(TGDTA),恒流充放电测试等方法对所产物结构,形貌,大小等进行分析,研究了其作为锂离子电池负极材料的性能,并对其首圈放电平台及循环性能进行分析考察.
1 实验部分
1.1 CoOOH 的样品制备
将CoSO4·6H2O 溶于水得到CoSO4溶液,将一定量的H2O2(30%)加入该溶液中混合均匀.然后将该混合溶液滴入55 ℃的NaOH 溶液,搅拌30min.反应停止后,将得到的沉淀过滤、洗涤,然后在80℃下干燥.得到的产物为深棕色.
1.2 样品的表征与性能测试
使用德国Bruker-D8型X-射线粉末衍射仪检测样品.石墨单色器和镍滤光片滤波,Cu 靶Kα1辐射(λ=1.54056 Å),管电压40 kV,管电流20mA,扫描速度(2θ)为4°min-1,步长0.02°.热分析(TG/DTA/DTG)采用Netzsch STA449 热分析仪,氧气气氛,升温速率10°C·min-1;氧气流量20 mL·min-1.使用日本JEOL 公司JSM-5610LV 型透射电子显微镜(TEM)观察样品的颗粒形貌、颗粒尺寸.电池的组装:使用扣式电池,用金属锂为负极材料,乙炔黑为导电剂,聚四氟乙烯乳液为胶黏剂.将活性物质、乙炔黑、胶黏剂以65∶30∶5 的比例混合,压制成膜后每个电极片约5.0mg/cm2,电解液为1mol/L LiPF6(EC∶DMC=1∶1),使用Celgard 2300 隔膜微孔,在充满氩气的手套箱中组装以上材料.充放电测试:电池测试系统为深圳新威(Neware TC481,中国)充放电仪.在恒流充放电测试系统上,以100mA·g-1充放电电流密度进行电化学性能测试,充放电电压范围为3.0~0.01V.
2 结果与讨论
2.1 热分析
图1是产物CoOOH 的热分析图谱.从TG 曲线可以看出,样品从室温到约100℃之间一直有质量的降低.这种不间断的失重来自吸附在样品表面的水分脱附.在约310℃时,样品有12.5%的失重,该失重来自于CoOOH 分解.从相对应的DTA 曲线可以看出,该分解反应为吸热反应.这一步分解反应得到的产物非常稳定,直到温度上升至900℃.在约900℃时,第一步分解反应得到的产物进一步分解,伴随着约6.0%的失重.从相应的DTA 曲线可见,在900℃发生的第二步分解反应还是吸热反应.通过对失重的反应分析,在300℃和900℃发生的两步分解反应分别为:
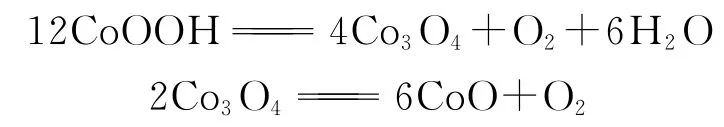
该两步分解反应的理论失重分别为12.7%和6.6%,与实验结果非常接近.
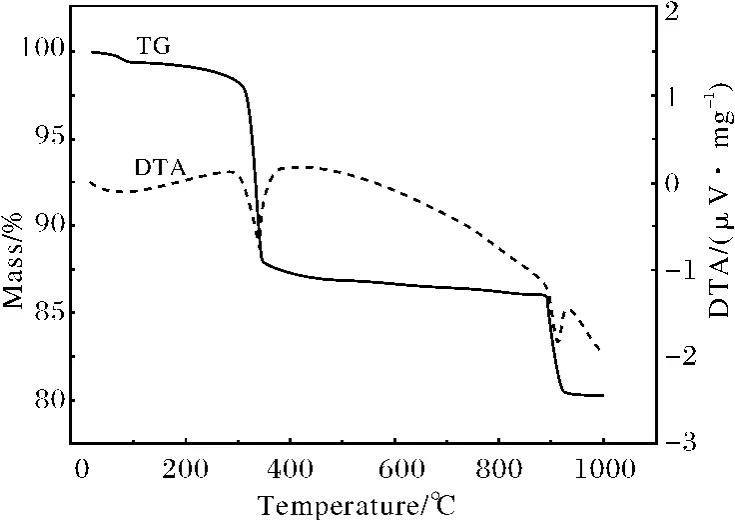
图1 纳米CoOOH 的热分析图谱Fig.1 TG/DTA curves of nano-CoOOH
2.2 X射线粉末衍射分析
如图2 纳米CoOOH 颗粒的XRD 图谱所示,样品经search-match匹配和标准图谱JCPDS卡号07-0169 (Rhombohedral,R-3m,a=b=0.2855nm,c=1.3156nm,α=β=90,γ=120)吻合良好,没有杂峰且强度较大.表明合成的样品CoOOH 纯度很高,结晶较好.从XRD 图中看来,合成的CoOOH 的最强峰为[003]峰.
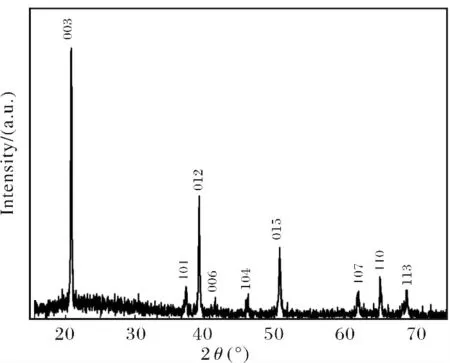
图2 纳米CoOOH 的XRD 图谱Fig.2 XRD patterns of nano-CoOOH
2.3 形貌分析
图3为纳米CoOOH 颗粒透射电镜图.从左图中可以看出,样品CoOOH 的形貌均一,分散均匀,大多数颗粒的直径在200nm 左右.对该透射电镜图进一步放大,从右图可以看出,部分颗粒的直径可以小于20nm.

图3 纳米CoOOH 的透射电镜图Fig.3 TEM images of nano-CoOOH
2.4 电化学性能分析
将纳米CoOOH 颗粒在充满氩气的手套箱中组装成CR 2016扣式电池,在电压范围为0.01~3.0V(vs.Li+/Li),电流密度为100mA·g-1,室温条件下测试其充放电性能,得到的图4和图5所示的电化学性能图.
过渡金属氧化物作为锂离子电池的负极材料在经过J.M.Tarascon等人的首次研究之后曾得到广泛的研究.其充放电循环的反应机理为金属Li和过渡金属氧化物之间发生的可逆氧化还原反应(对于CoO,其可逆反应为CoO+2Li=Co+Li2O).由于Li2O 的高度稳定性,这种氧化还原反应一般为不可逆反应.但是当作为锂离子电池的负极材料使用时,首次放电生成的过渡金属(对于CoO,反应得到的过渡金属为Co)为直径约2~5nm的小颗粒.这种反应生成的新鲜的纳米级小颗粒具有高度的反应活性,使得这种氧化还原反应成为一种可逆反应.对铁的羟基氧化物的充放电分析发现[10],羟基(OH-)并不影响物质作为锂离子电池负极的使用.材料中的羟基在首次放电过程中会和锂发生反应生成LiOH.该氢氧化锂在首次充电过程中不能释放出锂离子,因此会使得材料的首次放电和首次充电的容量相差较大.
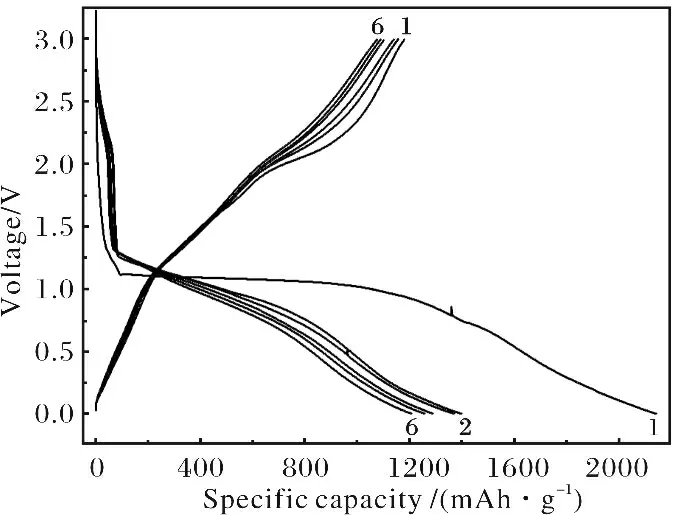
图4 纳米CoOOH 颗粒在0.01~3V 的前6圈循环的充放电曲线Fig.4 The charge-discharge curves between 0.01~3V voltage windows for the nano-CoOOH
图4为CoOOH 纳米颗粒的电压-比容量结果图.从图4 中可以看出,CoOOH 纳米颗粒第一次放电时在~1.1V (vs.Li+/Li)处有一个非常长的放电平台.该放电平台应该对应于CoOOH 与Li之间发生的氧化还原反应(CoOOH+3Li=Co+Li2O+LiOH).在经过该稳定的放电平台后,放电曲线开始缓慢下降直到放电电压为0.01V.放电平台之后放电曲线的缓慢下降源自0.75V 以下电解液的分解.电解液的分解产物包覆在材料的小颗粒表面形成一层SEI膜.从材料的放电曲线可以看出,该SEI膜能储存大量的锂离子.CoOOH与Li之间的氧化还原反应(导致每个CoOOH 分子可以存储3个Li离子)和SEI膜的形成使得材料的首次放电总容量达到2 200mAh·g-1.
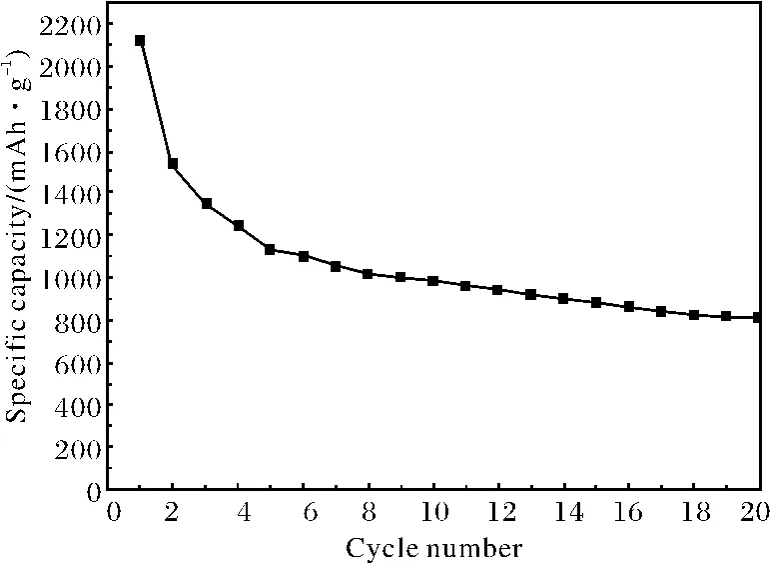
图5 纳米CoOOH 颗粒的循环性能曲线Fig.5 Cycle performance of the nano-CoOOH
图5为纳米CoOOH 颗粒的放电循环性能图.由于首次放电过程所形成的LiOH 在充电过程中不能释放出锂离子,加上颗粒表面SEI膜对锂离子存储的不可逆性,材料在前两次循环过程中均有较大的容量损失.但从图5中可以看出,从第5次循环开始,材料的容量逐渐趋于稳定.到第20次循环时,材料的放电容量稳定在~800mAh·g-1,远远高于目前商用锂离子电池中的负极碳材料(~300mAh·g-1).
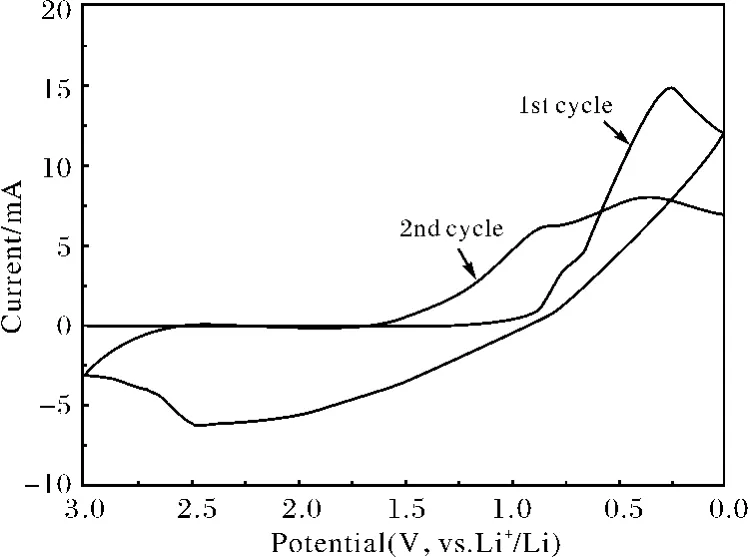
图6 纳米CoOOH 颗粒的循环伏安曲线(扫描速率=1mV·s-1)Fig.6 Cyclic voltammograms of nano-CoOOH(scanning rate=1mV·s-1)
在相同的电势范围内测试CoOOH 纳米颗粒的循环伏安曲线,如图6 所示.由于Li+进入到CoOOH 的晶体结构中,在首圈放电过程中0.3V左右可观察到一个较强的还原电流峰.当放电到截止电压0.01V 后,CoOOH 经电化学转换产生了惰性的LiOH,同时部分电解液分解形成的SEI膜覆盖在电极表面,导致在第二圈放电时还原电流峰大幅度减弱,峰位也提升到纳米CoO 的还原峰位0.75V 附近.这一结果与前两圈充放电容量损失现象比较一致.
3 结论
本文探索了纳米CoOOH 颗粒材料作为锂离子电池负极材料的电化学性能和反应机理.采用共沉淀法合成纳米 CoOOH 颗粒,直径在10~20nm,产物分散均匀,结晶性好,晶体排列规整.以此产物作为锂离子电池负极材料,测试其电化学性能,该材料首次放电曲线在1.1V 左右有放电平台,且放电容量高达1300mAh·g-1左右,经过20圈循环放电容量保持在800 mAh·g-1左右.本文是过渡金属化合物作为锂离子电池电极材料的研究的一部分,由此方法合成的纳米CoOOH颗粒具有较好的电化学性能.
[1]Tarascon J-M,Armand M.Issues and challenges facing rechargeable lithium batteries [J].Nature,2001,414:359-367.
[2]Bruce P G,Scrosati B,Tarascon J-M.Nanomaterials for rechargeable lithium batteries[J].Angewandte Chemie International Edition,2008,47:2930-2946.
[3]PalacÍn M R.Recent advances in rechargeable battery materials:a chemist's perspective[J].Chemical Society Reviews,2009,38:2565-2575.
[4]赵连海,李 琪,乔庆东.锂离子电池正极材料LiFePO4/C的研究进展[J].化工科技,2008,16(4):56-59.
[5]Molenda J,Wilk P,Marzec J.Structural electrical and electrochemical properties of LiNiO2[J].Solid State Ionics,2002,146(1-2):73-79.
[6]唐致远,韩 彬,王健英,等.锂离子蓄电池新型正极材料LiFePO4的研究进展[J].电源技术,2005,29(8):556-559.
[7]Tabuchi T,Katayama Y,Ogumi Z.β-FeOOH thim film as positive electrode for lithium-ion cells[J].Journal of Power Sources,2009,191:640-643.
[8]Tabuchi T,Katayama Y,Ogumi Z.Surface reaction ofβ-FeOOH film negative electrode for lithium-ion cells [J].Journal of Power Sources,2009,191:636-639.
[9]Cheng F Y,Zhao J Z,Song W.Facile controlled synthesis of MnO2nanostructures of novel shapes and their application in batteries[J].Inorganic Chemistry,2006,45:2038-2044.
[10]Lou X M,Wu X Z,Zhang Y X.Goethite nanorods as anode electrode materials for rechargeable Li-ion batteries[J].Electrochemistry Communications,2009,11:1696-1699.

