射黄含片的质量标准研究
田成旺, 郭建华, 张 科, 张铁军, 蒋伶活
(1.天津大学药物科学与技术学院,天津 300072;2.天津药物研究院,天津 300193;3.天津医科大学药学院,天津300070;4.江南大学生物工程学院,江苏无锡 214122)
射黄含片源于“古今济生妙方”的黄芩射干汤,由射干和黄芩两味药材组成,用于治疗咽喉腥臭[1]。现代研究表明,射干中含有异黄酮、酚类、苯醌类等成分[2-3],具有明显的抗炎及抗病毒作用[4-6];黄芩中含有黄酮等成分,并具有抗炎、解热、抗病毒等作用[7-8]。本课题组采用树脂纯化、喷雾干燥、干法制粒等现代制备工艺将射干和黄芩制成射黄含片,临床用于急性咽炎及慢性咽炎急性发作期出现的咽喉干燥,灼热,疼痛等,效果显著。为有效评价射黄含片的质量,确保临床的有效性和安全性,在参考相关文献的基础上[9-12],本实验研究并建立了射黄含片中射干和黄芩的薄层色谱鉴别方法,采用反相高效液相色谱法同时对主要活性成分射干苷、黄芩苷和次野鸢尾黄素进行了定量测定。
1 仪器和试药
1.1 仪器 Dionex液相系统,Chromeleon色谱工作站,配置自动进样器、柱温箱、DAD检测器;电子天平:sartovius(十万分之一天平);METTLER TOLEDO(万分之一天平)。超声仪:AUTOSCIENCE(AS3120)。
1.2 试药 黄芩苷对照品(批号110715-200514)、射干苷对照品 (批号111632-200501)和次野鸢尾黄素 (批号1557-200101)均购自中国药品生物制品检定所;射黄含片,自制,批号分别为110401,110402,110403;水为双蒸水,甲醇为色谱纯,其他化学试剂均为分析纯。
2 定性鉴别
2.1 射干的鉴别 取本品粉末1.0 g,加水20 mL,超声处理15 min,滤过,水液加三氯甲烷萃取3次,每次20 mL,水层挥干三氯甲烷,再用乙酸乙酯萃取3次,每次20 mL,取乙酸乙酯层,水浴蒸干,残渣加甲醇1 mL使溶解,作为供试品溶液。取射干苷对照品适量,加甲醇制成每1 mL含0.6 mg的溶液作为射干苷对照品溶液;另取射干对照药材1.0 g,加甲醇10 mL,超声处理30 min,滤过,滤液浓缩至约1 mL,作为对照药材溶液。照薄层色谱法(《中国药典》2010年版·一部附录ⅥB)试验,吸取供试品溶液及对照品和对照药材溶液各10μL,分别点于同一块硅胶GF254薄层板上,以三氯甲烷-甲醇-冰醋酸 (20∶3∶0.5)为展开剂,展开,取出,晾干,直接置于紫外灯(254 nm)下检视,或喷以2%AlCl3试液后晾干,再置于紫外灯 (254 nm)下检视。供试品色谱中,在与对照品、对照药材色谱相应的位置上,显相同颜色的荧光淬灭斑点,喷以AlCl3试液后,斑点仍然清晰。阴性对照无干扰,结果见图1。
2.2 黄芩的鉴别 取射黄含片粉末0.5 g,加水20 mL,超声处理15 min,滤过,水液加10%盐酸调pH至3.0,过滤,水液弃去,沉淀加甲醇使其溶解,作为供试品溶液。取黄芩苷对照品适量,加甲醇制成每1 mL约含0.5 mg的溶液,作为对照品溶液;另取黄芩对照药材0.5 g,加甲醇15 mL,超声处理30 min,滤过,滤液浓缩至约1 mL,作为对照药材溶液。照薄层色谱法(《中国药典》2010年版一部 附录ⅥB)试验,分别吸取供试品溶液、对照品溶液各5 μL,点于同一硅胶G薄层板上,以乙酸乙酯-丁酮-甲酸-水 (5∶3∶1∶1)为展开剂,展开,取出,晾干,喷以1%FeCl3乙醇溶液,105℃下烘烤至显色清晰。供试品色谱中,在与对照品、对照药材色谱相应的位置上,显相同绿颜色的斑点,阴性对照无干扰。结果见图2。
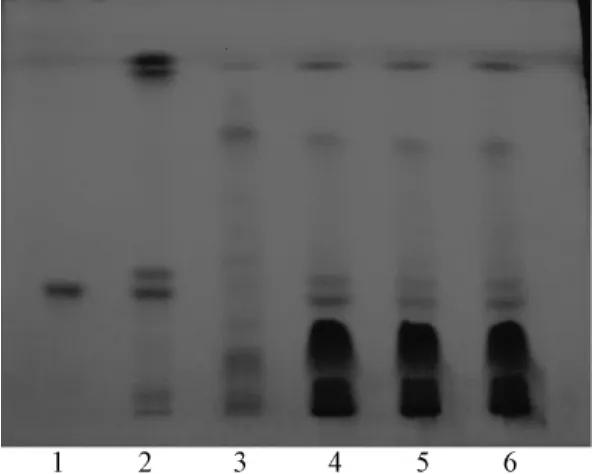
图1 射干薄层色谱图Fig.1 TLC of Belamcandae Rhizoma
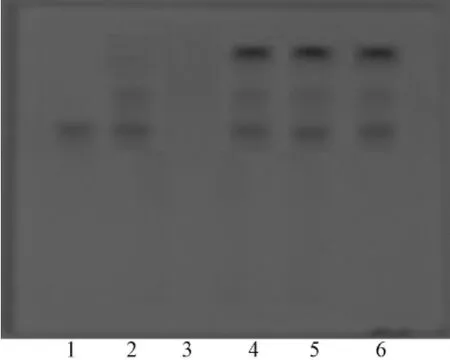
图2 黄芩的薄层色谱图Fig.2 TLC of Scutellariae Radix
3 样品测定
3.1 样品制备
3.1.1 对照品溶液的制备 精密称取黄芩苷、射干苷和次野鸢尾黄素对照品适量,加甲醇配制成每1 mL含黄芩苷0.07 mg、射干苷0.02 mg和次野鸢尾黄素0.01 mg的溶液。
3.1.2 供试品溶液的制备 取射黄含片适量,研细,取0.1 g,精密称定,置50 mL量瓶中,加甲醇适量,超声处理 (功率250 W,频率33 kHz)30 min,放冷,加甲醇至刻度,摇匀,滤过,取续滤液,即得。
3.1.3 阴性样品溶液的制备 按照射黄含片的制备工艺分别制得缺黄芩和缺射干的阴性样品,取阴性样品,研细,取0.1 g,精密称定,置50 mL量瓶中,加甲醇适量,超声处理 (功率250 W,频率33 kHz)30 min,放冷,加甲醇至刻度,摇匀,滤过,取续滤液,即得。
3.2 色谱条件及系统适应性 试验Diamonsil C18色谱柱 (4.6 mm×250 mm,5 μm),流动相甲醇-0.05%磷酸 (42∶58);体积流量1.0 mL/min;检测波长270 nm;柱温30℃。分别取混合对照品溶液、供试品溶液各10 μL注入液相色谱仪,理论塔板数以射干苷峰计算应不低于3 000;射干苷、黄芩苷、次野鸢尾黄素与其它组分的分离度都大于1.5,且阴性无干扰。见图3。
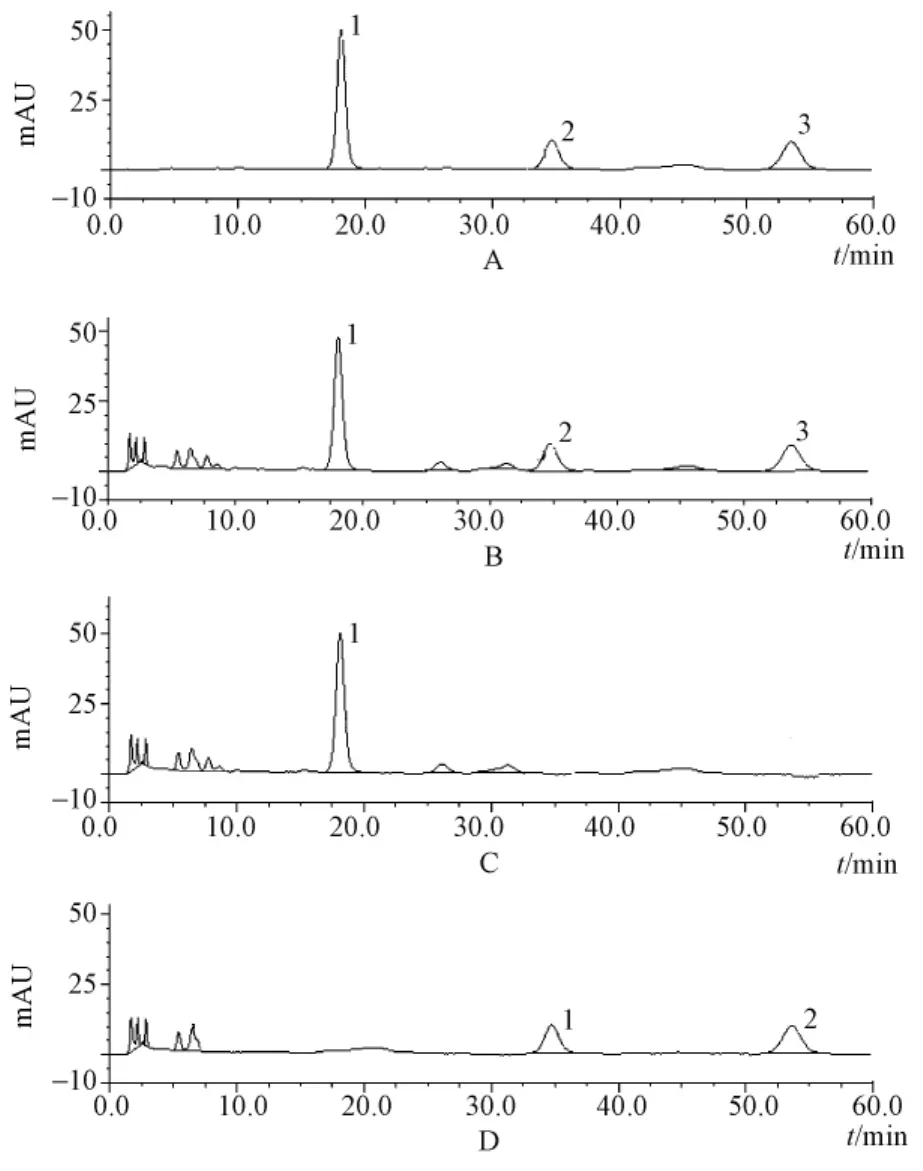
图3 混合对照品 (A)、样品 (B)、缺射干阴性样品 (C)和缺黄芩阴性样品 (D)液相色谱图Fig.3 HPLC chromatograms of mixed substances(A),sample(B),negative sample without Belamcande Rizoma(C)and negative sample without Scutellariae Radix(D)
3.3 方法学考察
3.3.1 线性关系考察 精密吸取上述黄芩苷、射干苷和次野鸢尾黄素混合对照品溶液2、4、6、8、10、12 μL进行色谱测定,按上述色谱条件测定峰面积,并以峰面积 (y)对进样量 (x)进行回归,得标准曲线:黄芩苷Y=21.56X+234.35,r=0.999 6;射干苷Y=49.11X-635.11,r=0.999 8;次野鸢尾黄素Y=53.22X+117.21,r=0.999 9。表明黄芩苷在140~840 ng,射干苷在40~240 ng,次野鸢尾黄素在20~120 ng进样量范围内线性关系良好。
3.3.2 精密度试验 取黄芩苷、射干苷和次野鸢尾黄素的混合对照品溶液10 μL连续进样,测定6次,RSD分别为0.54%、1.12%、1.46%,表明仪器精密度良好。
3.3.3 稳定性试验 取供试品溶液 (批号110401)在0、2、4、6、8、12h分别进样10 μL,黄芩苷、射干苷和次野鸢尾黄素的RSD分别为1.31%、1.45%、1.77%,表明供试品溶液在12 h内稳定。
3.3.4 重复性试验 取同一批号 (批号110401)样品6份,按3.1.2项下的制备方法处理,进样检测,根据样品图谱中测得的黄芩苷、射干苷和次野鸢尾黄素峰面积,代入线性方程中进行计算相应的溶液质量浓度,并由溶液体积和称样量求得相应成分的质量分数。测得射黄含片中黄芩苷的质量分数为63.05 mg/g(RSD为1.16%),射干苷的质量分数为9.88 mg/g(RSD为1.33%),次野鸢尾黄素的质量分数为1.11 mg/g(RSD为1.25%),结果表明分析方法重复性良好。
3.3.5 加样回收试验 精密称取射黄含片样品(批号110401)共9份,加入相应量的黄芩苷、射干苷、次野鸢尾黄素对照品,按3.1.2项下的制备方法处理并测定,进样检测,并计算回收率。黄芩苷平均回收率为98.89%,RSD为1.63%;射干苷平均回收率为100.32%,RSD为1.06%;次野鸢尾黄素的平均回收率为98.65%,RSD为1.53%。表明本方法准确可靠,结果见表1~3。
3.4 样品测定 取射黄含片3个批号样品,按3.1.2项下的制备方法处理后测定,获得黄芩苷、射干苷及次野鸢尾黄素的质量分数,结果见表4。
由表中数据可以看出,3批射黄含片中黄芩苷、射干苷和次野鸢尾黄素的量基本保持稳定。
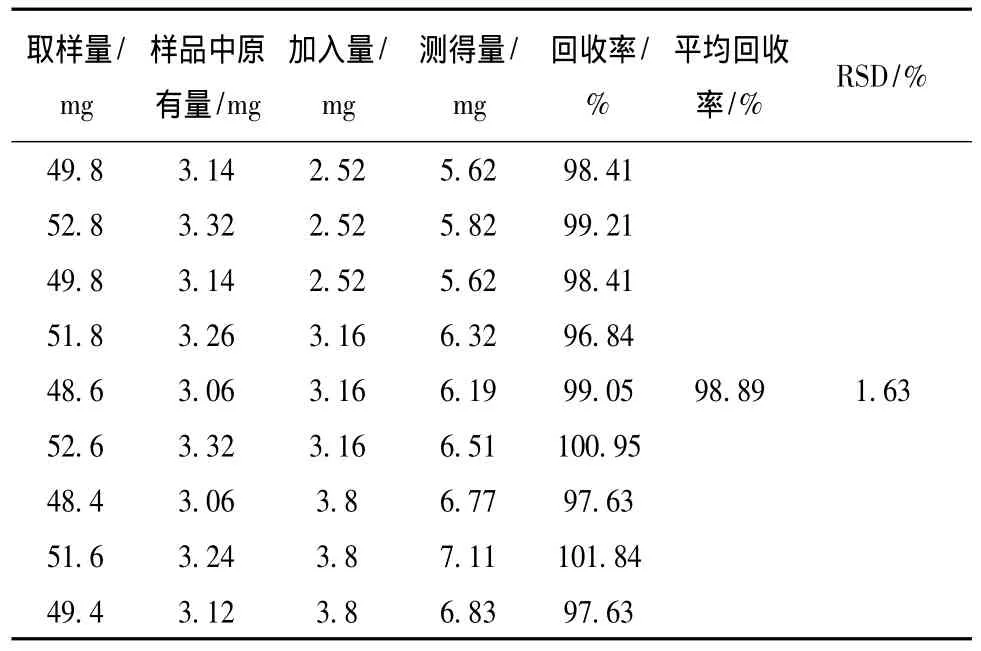
表1 黄芩苷回收率试验结果 (n=9)Tab.1 Results of recovery tests of baicalin(n=9)
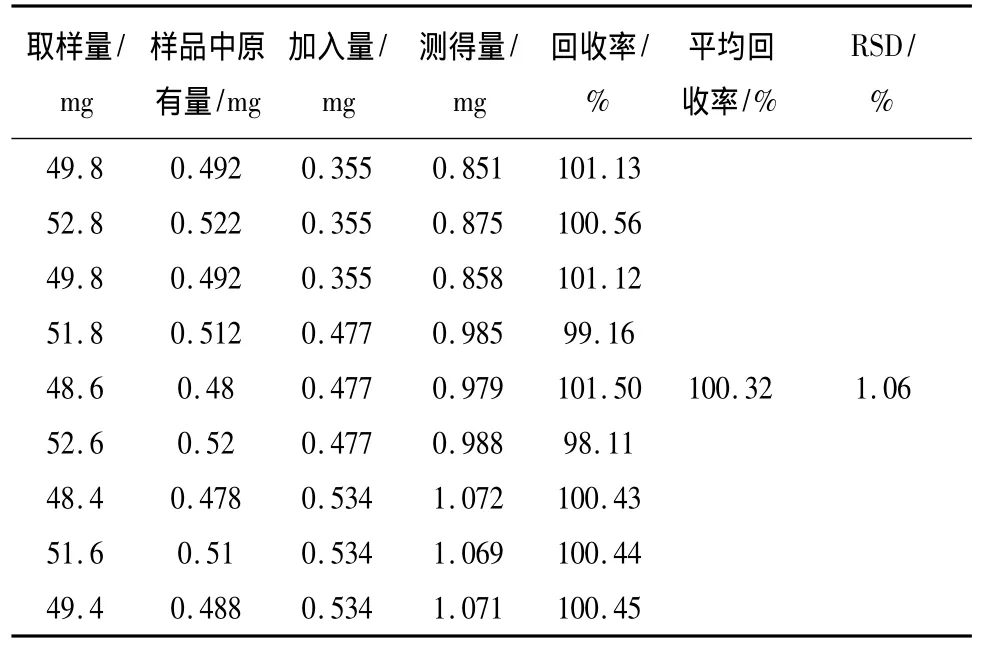
表2 射干苷回收率试验结果 (n=9)Tab.2 Results of recovery tests of tectoridin(n=9)
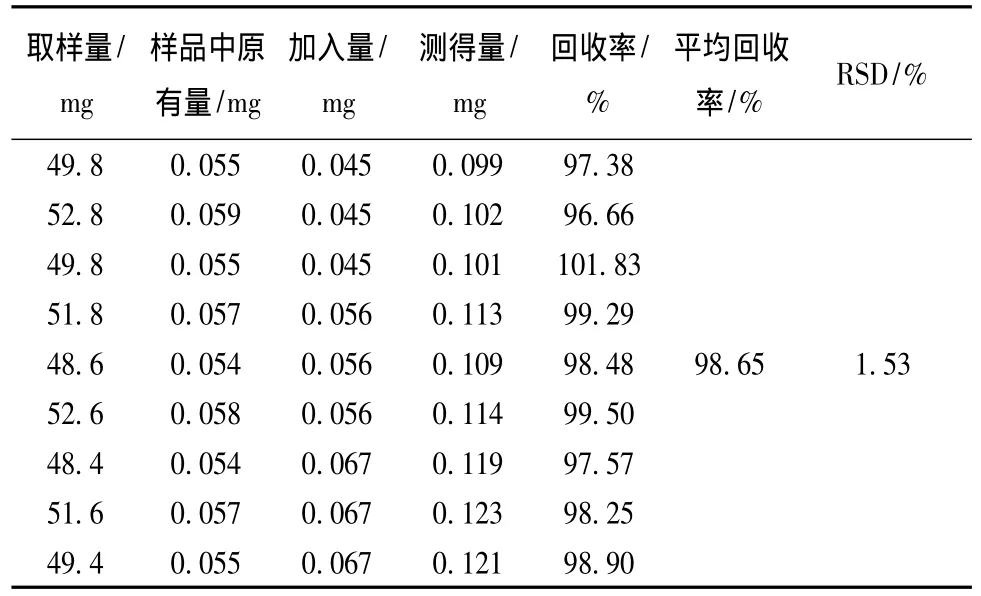
表3 次野鸢尾黄素回收率试验结果 (n=9)Tab.3 Results of recovery tests of irisflorentin(n=9)
表4 射黄含片中黄芩苷、射干苷和次野鸢尾黄素的测定结果(n=3,±s)Tab.4 Determination of baicalin,tectoridin and irisflorentin in Shehuang Lozenges(n=3,±s)
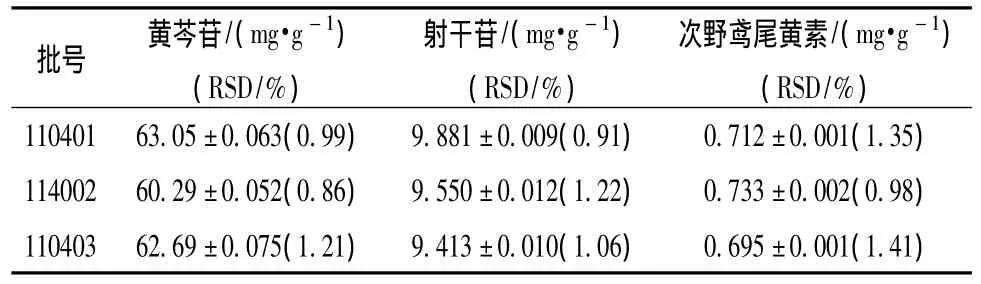
表4 射黄含片中黄芩苷、射干苷和次野鸢尾黄素的测定结果(n=3,±s)Tab.4 Determination of baicalin,tectoridin and irisflorentin in Shehuang Lozenges(n=3,±s)
批号 黄芩苷/(mg·g-1)(RSD/%)射干苷/(mg·g-1)(RSD/%)次野鸢尾黄素/(mg·g-1)(RSD/%)110401 63.05±0.063(0.99) 9.881±0.009(0.91) 0.712±0.001(1.35)114002 60.29±0.052(0.86) 9.550±0.012(1.22) 0.733±0.002(0.98)110403 62.69±0.075(1.21) 9.413±0.010(1.06) 0.695±0.001(1.41)
4 讨论
4.1 在射干的薄层鉴别中,考虑到射干中主要活性成分为异黄酮类成分,其中射干苷为其代表性成分,在供试品溶液制备方面,采用水超声提取,三氯甲烷萃取除杂,乙酸乙酯萃取的方法,可有效提取有效成分和减少杂质带来的干扰。先后比较了硅胶G板、硅胶GF254板等薄层板,发现硅胶GF254板重现性更为理想,先后采用①三氯甲烷-丁酮-甲醇(3∶1∶1)、②三氯甲烷-甲醇-冰醋酸 (10∶1∶0.1)、③三氯甲烷-甲醇-冰醋酸 (20∶3∶0.5)展开剂系统为展开剂,结果系统③较为理想,置于紫外254 nm下检视,结果显示图谱效果较好,在喷以AlCl3试液显色后,斑点仍清晰。
4.2 黄芩的薄层鉴别中,考虑到黄芩主要含有黄酮类成分,其中黄芩苷为其代表性成分,在供试品溶液制备方面,采用水溶酸沉的方法,可有效地提取有效成分和减少杂质带来的干扰。先后比较了聚酰胺膜、硅胶G板等薄层板,发现硅胶G板重现性更为理想,采用乙酸乙酯-丁酮-甲酸-水 (5∶3∶1∶1)为展开剂,喷以1%的FeCl3乙醇试液,结果显示图谱效果较好。
4.3 射黄含片由射干和黄芩两味药组成,主要活性成分包括黄芩苷、黄芩素、汉黄芩素、射干苷、次野鸢尾黄素等黄酮类成分,其中次野鸢尾黄素、黄芩苷分别为2010年《中国药典》射干和黄芩项下的含量限度指标,同时考虑到射干中射干苷量较高,本实验选取黄芩苷、射干苷、次野鸢尾黄素作为指标进行定量测定研究。
4.4 因本实验建立的方法为同时检测黄芩苷、射干苷和次野鸢尾黄素成分,为保证检测结果的科学性和准确性,我们对色谱条件进行了考察,通过对供试品溶液进行全波长扫描,确定其较佳吸收波长为270 nm;通过对乙腈-水、甲醇-水等流动相组成及其比例的考察确定了合适的流动相;通过对回流、超声、索氏提取等不同提取方式,不同的溶剂、用量和提取时间进行系统考察,确定了供试品的最佳制备方法。研究结果表明本实验建立的检测方法简便易行且准确可靠。
[1]张树生.古今济生妙方[M].北京:中国医药科技出版社,1995:735.
[2]邱鹰昆,高玉白,徐碧霞,等.射干异黄酮类化合物的分离与结构鉴定[J].中国药物化学杂志,2006,16(3):175-177.
[3]刘 杰,陈海生,王建娇.射干化学成分研究[J].中药材,2005,28(1):29.
[4]韩 杨,孔 红,李宜平,等.射干的抗病毒实验研究[J].中草药,2004,35(3):306-308.
[5]秦民坚,吉文亮,刘 峻,等.射干中异黄酮成分清除自由基的作用[J].中草药,2003,34(7):640-641.
[6]Wu J A,Attele A S,Zhang L,et al.Anti HIV activity of medicinal herbs usage and potenitial development[J].Am J Chin Med,2001,29(1):69-81.
[7]赵铁华,杨鹤松,邓淑华,等.黄芩茎叶总黄酮解热作用的实验研究[J].中国中医药科技,2001,8(3):174.
[8]侯艳宁,朱秀媛,程桂芳,等.黄芩苷的抗炎机理[J].药学学报,2000,35(3):161-164.
[9]董占军,韩桂茹,安丽娜,等.小儿咽扁颗粒质量控制方法的简化研究[J].河北中医,2011,33(8):1224-1226.
[10]刘 伟.三黄颗粒质量标准的研究[J].黑龙江医药.2011,24(2):205-206.
[11]杨 明,庞 贺,李国信,等.HPLC法测定射干中射干苷的含量[J].中华中医药学刊,2008,26(4):782-783.
[12]陆 祥,宋剑锋.RP-HPLC法测定止血祛瘀明目片中黄芩苷含量[J].浙江中医杂志,2011,46(12):921-923.

