EM对嗜水气单胞菌体外抑制作用试验
朱芝秀,何后军,张文波,邬向东,万 根,邓舜洲,刘松林
(江西农业大学 动物科技学院,江西 南昌 330045)
嗜水气单胞菌广泛存在淡水、污水、淤泥及土壤中,其致病性菌株可产生气溶素、溶血素、细胞毒性、肠毒素、胞外蛋白等。该菌的感染谱广,可感染鱼类、两栖类、爬行类、鸟类和哺乳类等动物。嗜水气单胞菌是典型的人-兽-鱼共患病病原菌[1],也是我国淡水养殖鱼暴发性传染病的主要病原之一[2],该病的高发期为每年的5—10月,此时温度适宜,水体中嗜水气单胞菌大量繁殖,可引起该病的爆发。
长期以来,我国水产动物病害控制主要依靠各种抗菌药物及消毒剂。长期滥用药物,不仅使药物作用受到制约,延误治病,造成大量死亡和药物投入的双重损失,还可诱发细菌基因突变或因转移而产生抗药性,导致无药可用,更严重的是药物在鱼体内残留和对养殖环境的严重污染,违背发展无公害食品的宗旨,危害人体健康,破坏水体生态环境。因此,寻找新的环境友好病害防控措施,使我国的水产养殖业实现可持续发展已迫在眉睫。
EM(Effective Microorganisms)微生态制剂由光合细菌、乳酸菌群、酵母菌群、放线菌群、丝状菌群等5科10属80余种微生物组成。它是由世界著名应用微生物学家日本琉球大学比嘉照夫教授发明的,EM技术是目前世界上应用范围最广的一项生物工程技术。EM体内抑菌机理:在动物消化道内产生有益菌群,与致病菌间就生存和繁殖的空间、时间、定居部位以及营养素等展开竞争,抑制致病菌的生存、繁殖、定居以及附着[3]。EM在养殖水体中的抑菌机理:EM渗入水体后,它就会与所到之处的良性力量迅速结合,产生抗氧化物质,清除氧化物质,消除腐败,抑制水中的病原菌,形成适于动植物生长的良好环境。同时,它还产生大量易为动植物吸收的有益物质,净化养殖池中的排泄物和残饵,改善水质,减少鱼病[4]。EM具有无毒副作用、无耐药性、无残留、低成本、效果显著等特点,有效地克服抗生素、激素、防腐剂、农药、化肥等化学农业所产生的种种副作用。使用微生态制剂是实施水产健康养殖的一项重要技术手段[5]。
本实验首先分离鉴定鱼体和养殖水体中的致病性嗜水气单胞菌,在此基础上,研究EM对致病性嗜水气单胞菌的抑制作用,为今后EM在水产养殖中的提供试验依据。
1 材料与方法
1.1 材料
病料:取自江西某水产养殖场的病鱼和养殖水。细菌微量生化反应管:购自杭州天和微生物试剂有限公司。药敏试纸:购自杭州天和微生物试剂有限公司。EM:购自江西省天意生物技术开发有限公司。嗜水气单胞菌16S rDNA和Aero基因的特异性扩增引物:由上海生工生物工程技术服务有限公司合成。脱脂奶蔗糖胰蛋白胨琼脂培养基:购自青岛高科园海博生物技术有限公司。牛津杯:内径为8 mm。
1.2 方法
1.2.1 嗜水气单胞菌的分离 无菌操作取病鱼肌肉接种普通琼脂培养基,37℃培养24 h。将养殖水涂布胰蛋白酶琼脂培养基,37℃培养24 h。
1.2.2 分离菌纯化培养 挑选形态一致的疑似菌落,进行革兰氏染色、镜检,划线接种普通琼脂培养基纯化,37℃培养24 h。
1.2.3 分离菌株分子生物学检测 按照李绍戊等[6]方法,对分离菌株进行嗜水气单胞菌的保守基因16S rDNA基因及特异性Aero基因片段进行扩增,扩增产物送上海生工测序。

1.2.4 嗜水气单胞菌生长曲线图绘制 选取一株嗜水气单胞菌分离株,无菌操作接种10支普通肉汤,37℃ 160 r/min振荡培养。相隔一定时间定期取样,测定每份样品的OD630值,以OD630值为纵坐标、培养时间为横坐标绘制生长曲线图。
1.2.5 药敏实验 将分离菌分别接种普通肉汤培养基,37℃培养24 h,按琼脂扩散法用14种抗生素做药敏实验。
1.2.6 EM体外抑制实验 将分离菌株肉汤培养物均匀涂布普通琼脂培养基,将不同浓度的EM小心滴入牛津杯内,37℃培养24 h,分别测量抑菌圈大小。
2 结果和分析
2.1 嗜水气单胞菌分离结果
从病鱼肌肉和水体中共分离纯化到14株细菌,在普通营养琼脂平板上形成表面光滑、隆起、湿润的乳白色菌落,在胰蛋白酶琼脂培养基形成透明溶蛋白圈的中等大小菌落,菌体均为革兰氏阴性杆菌。
2.2 分离菌株分子生物学检测结果
14株分离菌株均扩增到嗜水气单胞菌16S rDNA,其中7株扩增到气溶素基因(Aero基因)。与Gen-Bank已经登录的嗜水气单胞菌16S rDNA和气溶素基因之间的同源性分别为97.9% ~100% 和97.1% ~100%。因此,可确定14株分离菌均为嗜水气单胞菌,其中7株为携带气溶素基因的分离菌株为致病性嗜水气单胞菌。
2.3 分离菌株生长曲线
Jxg-1株生长曲线(图1)表明,在本试验条件下嗜水气单胞菌培养21 h后进行停滞期。因此,本试验以18 h的细菌培养物进行药敏试验。
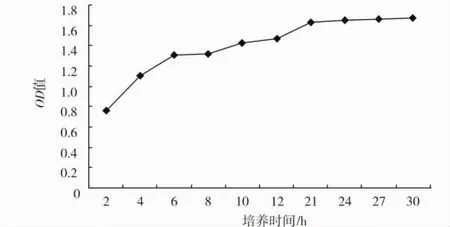
图1 分离菌株Jxg-1的生长曲线Fig.1 The growth curve of Aeromonas hydrophila isolate Jxg-1
2.4 药物敏感试验结果
药物敏感性试验结果见表1。本试验的嗜水气单胞菌分离株对部分药物呈现一致的耐药性,14株菌对青霉素G、氨苄西林、头孢拉定、头孢唑啉、四环素、甲氧嘧啶、林可霉素、头孢氨苄均耐药;对头孢噻肟和呋喃唑酮表现高度敏感;对强力霉素、头孢砒肟、大观霉素、乙酰螺旋霉素的耐药性表现不一。
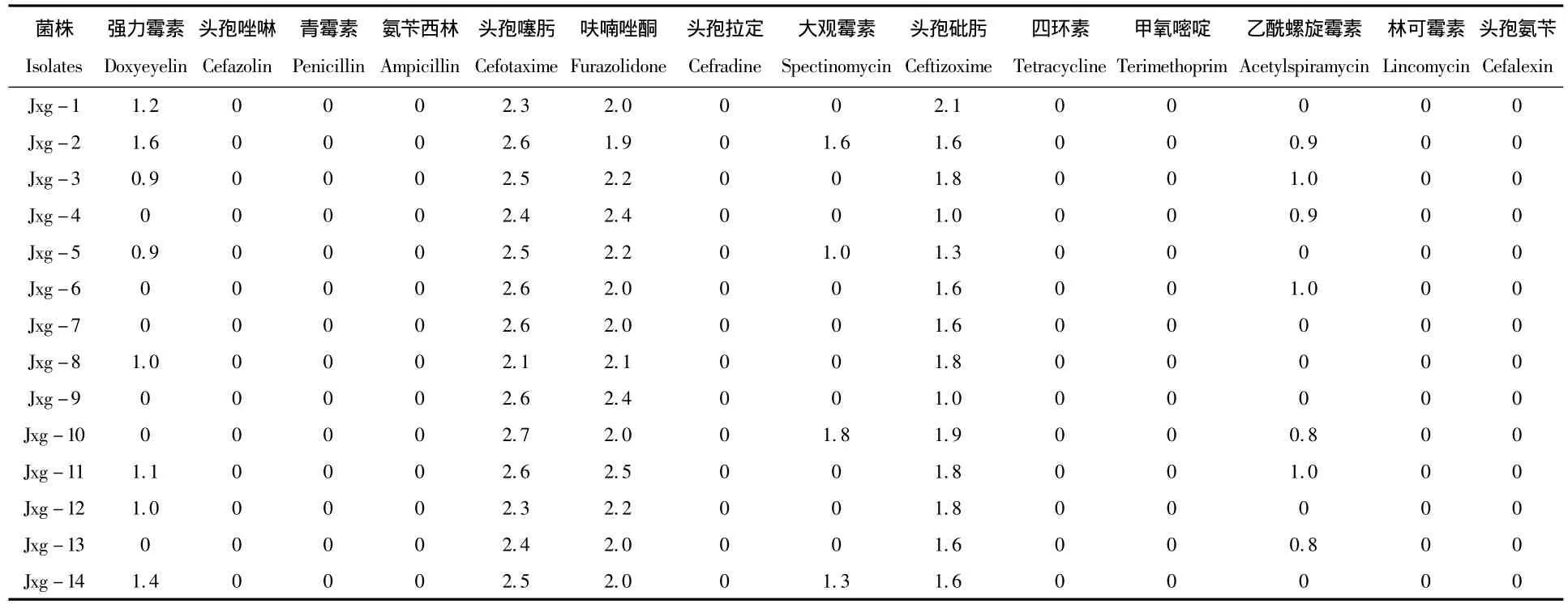
表1 嗜水气单胞菌分离菌株对14种抗生素的耐药实验结果Tab.1 Drug risistance test of 14 Aeromonas hydrophila isolates cm
2.5 EM体外抑制实验结果
EM对14株嗜水气单胞菌的体外抑菌试验结果见表2,结果表明:EM对嗜水气单胞菌的体外抑制作用与浓度呈正相关,浓度大于60%则对14株菌种均有抑制作用,浓度越大,抑菌圈越大。
3 结论与讨论
嗜水气单胞菌广泛存在于淡水、污水、淤泥及土壤中,如水体中的营养丰富、水温适宜,致病性嗜水气单胞菌大量增殖,可导致大量鱼发病。本试验从病鱼和水体中共分离到14株分泌蛋白酶的细菌,通过16S rDNA基因的扩增和测序列证明均为嗜水气单胞菌,通过对嗜水气单胞菌气溶素基因(Aero基因)的扩增表明其中的7株为致病性嗜水气单胞菌[7]。从病鱼和水体中分离到的致病性嗜水气单胞菌的生化特性和对药物的敏感性基本一致,且部分菌株的16S rDNA基因和Aero基因的同源性为100%,表明病鱼的嗜水气单胞菌是通过水体感染。
本试验分离的嗜水气单胞菌均对青霉素、阿莫西林、头孢类抗生素表现耐药,对其他抗菌药药物也表现不同程度的耐药性,与之前的文献报道一致[8-11],如果水产养殖中长期使用抗菌药物,则耐药谱会越来越广。EM是一种复合微生物菌剂,它由光合细菌、乳酸菌、放线菌等10个属80多种微生物复合培养而成,具有促进动、植物生长,去除粪便恶臭,改善生态环境,增强机体的抗病力和免疫力等功效。因此,EM应用于水产养殖中,具有净化水质、促进生长、提高成活率、减少病原菌的作用[12-15],因此可减少水产养殖中抗菌药物的使用。本试验通过EM对嗜水气单胞菌的体外抑菌作用进行测定,结果表明EM在体外具有抑制嗜水气单胞菌增殖的作用,抑菌作用与浓度呈正相关,但其对嗜水气单胞菌的抑菌机理及抑菌成分仍不完全清楚,有待进一步研究。
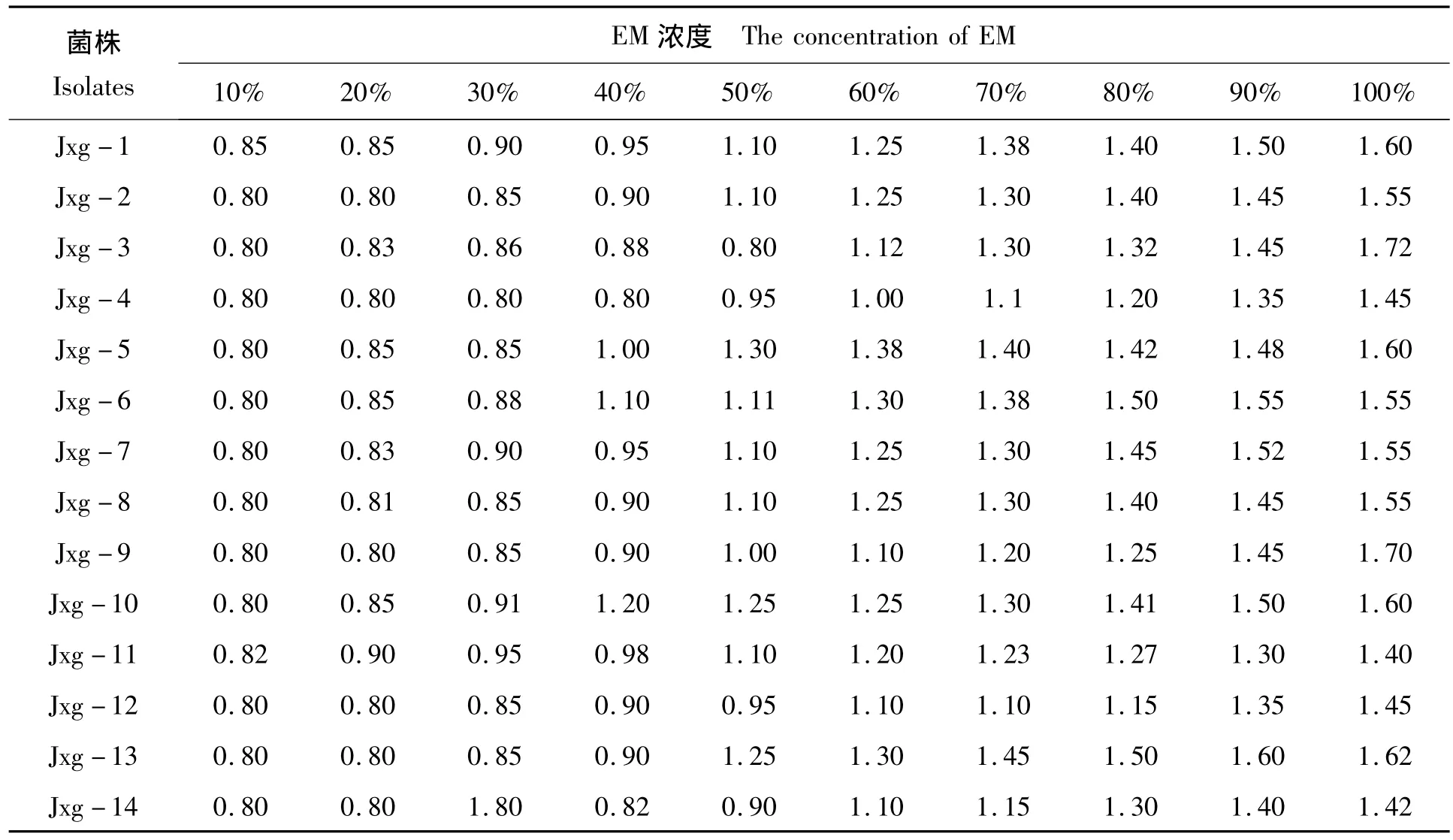
表2 不同浓度EM对分离菌体外抑制实验结果Tab.2 Antibacterial effect in vitro of different dilution EM on Aeromonas hydrophila cm
[1]蔡丽娟,许宝青,林启存.水产致病性嗜水气单胞菌耐药性比较与分析[J].水产科学,2011,30(1):42-45.
[2]张文丽,张玉芬,张秀军.鲤鱼嗜水气单胞菌的检测与分析[J].湖北农业科学,2011,50(3):564-569.
[3]李维炯,倪永珍.EM(有效微生物群)的研究与应用[J].生态学杂志,1995,14(5):58 -62.
[4]李晓东.EM生物技术及应用[J].南京农专学报,1996(2):25-28.
[5]杨怀金,谭显东,叶芝祥.EM技术在我国水环境保护中的应用研究进展[J].成都信息工程学院学报,2006,21(3):445-448.
[6]司力娜,李绍戊,王荻,等.东北三省15株致病性嗜水气单胞菌分离株的药敏实验分析[J].江西农业大学学报,2011,33(4):786-790.
[7]朱建萍,叶展翔,朱烨,等.嗜水气单胞菌气溶素毒力基因检测研究[J].中国热带医学,2009,9(5):810-811.
[8]田甜.鱼源嗜水气单胞菌的分离鉴定及耐药性研究[D].武汉:华中农业大学,2010.
[9]童国忠,石亚素,斯国静.甲鱼嗜水气单胞菌分离鉴定与药敏试验[J].浙江预防医学,2004,16(8):80-88.
[10]童照威,张龙琪,王伟洪,等.嗜水气单胞菌感染现状及耐药分析[J].中国微生态学杂志,2008,20(l):75-77.
[11]宋铁英,陈强,郑在予,等.不用来源嗜水气单胞菌的抗菌素耐药性及耐药机制分析[J].福建农业学报,2007,23(2):119-121.
[12]黄永春,王盛伦,黄志明,等.有效微生物制剂(EM)对建鲤生长和水质变化的影响[J].集美大学学报:自然科学版,1999,4(1):41 -46.
[13]黄永春.有效微生物菌群对养虾水体细菌生态和水质的影响[J].广东海洋大学学报,2009,29(1):44-48.
[14]黄永春,吴友义,王盛伦,等.EM 在长毛对虾养殖中的应用研究[J].福建畜牧兽医,1997(3):6-8.
[15]田功太,刘飞,段登选,等.EM 菌对海参养殖水体理化因子的影响[J].水生态学杂志,2012,33(1):75-79.

