嗜水气单胞菌诱导中华绒螯蟹消减文库的构建及初步分析
赵大显,陈敏文,江 坤,吴小平*
(1.南昌大学 生命科学与食品工程学院,江西 南昌 330031;2.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330031)
中华绒螯蟹(Eriocheir sinensis)是我国重要增养殖对象之一,近年来,由细菌、病毒和类立克次体生物等引起的各种疾病日趋严重,导致巨大的经济损失,严重制约了我国蟹类养殖业的健康发展。而目前蟹病主要采用抗生素等药物进行防治,这无形中也对病原菌进行了耐药性筛选,促成了病原菌的基因变异,提高了它们的抗药性,从而有恶性循环的潜在可能。因此,研究中华绒螯蟹的免疫机制,有效提高蟹类本身的抗病能力,越来越受到人们的重视。国内学者先后从生理生化水平对中华绒螯蟹免疫防御机制进行了探讨[1-4],近年来,又逐渐向分子水平深入,获得了一些与免疫相关的表达序列标签(ESTs)和基因序列[5-8]。这些研究将有助于更好的了解中华绒螯蟹和病原之间的关系,也为今后研究该物种的抗病分子机理奠定了基础。
嗜水气单胞菌(Aeromonaz hydrophila)作为一种重要的人-兽-鱼共患病病原,在自然界分布广泛,可以感染多种水生及陆生动物并引起不同的疾病,给人类的健康带来威胁同时也给水产养殖业造成惨重的经济损失,危害性极大。Zhu[9]从患病濒死的中华绒螯蟹肝胰腺中分离到3株嗜水气单胞菌也均能引起健康蟹的死亡,从而发现该菌也是引起中华绒螯蟹患病的重要病原之一。
抑制性消减杂交技术(Suppression Subtractive Hybridization,SSH)是近年来发展起来的一项新的分离、克隆差异基因的技术,该技术具有假阳性率低、筛选效率高、实验周期短等优点,能有效地分离扩增低丰度差异表达的基因[10]。本研究利用该技术,成功构建了嗜水气单胞菌诱导下中华绒螯蟹差异表达基因的cDNA文库,并对该文库进行了初步分析,为进一步开展该物种抗病相关基因的筛选、克隆和功能分析奠定了基础,同时也为中华绒螯蟹大规模细菌性疾病的检测、控制提供了有力的技术支撑。
1 材料与方法
1.1 实验材料
1.1.1 实验动物与实验菌株 中华绒螯蟹成体(50~100 g)购于南昌市墩子塘水产市场,于实验室暂养一周后选取健康、活泼且四肢健全的蟹用于试验。嗜水气单胞菌为本实验室保存菌种。
1.1.2 感染与血淋巴细胞收集 在感染组中,中华绒螯蟹体侧肌肉注射0.1 mL 7.2×108 CFU/mL嗜水气单胞菌[8],同时对照组注射0.1 mL无菌生理盐水。在12 h内连续观察,待中华绒螯蟹出现个体明显活动异常或个别死亡时抽取血淋巴,4℃,12 000 r/min离心10 min,收集血淋巴细胞。
1.2 实验方法
1.2.1 RNA抽提和mRNA的分离 于血淋巴细胞中按0.1 g/mL加入Trizol Reagent(Invitrogen),振荡混匀,加入等体积的氯仿,盖紧盖子,颠倒摇动15 s,室温放置2~3 min;4℃,13 000 r/min离心20 min,取上清,移至新的EP管中;向EP管中加入0.8倍体积的异丙醇,混匀,-20℃沉淀1 h,4℃,13 000 r/min离心20 min;弃上清,加入75%乙醇洗涤,溶于一定体积的DEPC水中。用紫外分光光度计检测总RNA的浓度和纯度,根据其浓度,取约150 ng进行凝胶电泳分析,观察是否被降解;在确定该总RNA未被污染的前提下,取约600 μg的总RNA,按Oligotex mRNA Kit的方法分离mRNA。取1 μL获得的mRNA用于凝胶电泳,用紫外分光光度计检测OD260/OD280的比值,取约0.5 μg用于合成cDNA。
1.2.2 抑制性消减杂交 采用Clontech公司提供的PCR-Select TM cDNA Subtraction Kit进行抑制性消减杂交,具体操作步骤参照试剂盒的操作手册。其中正向杂交以嗜水气单胞菌感染后的中华绒螯蟹血淋巴细胞mRNA为tester,以生理盐水处理的中华绒螯蟹血淋巴细胞mRNA为driver;反向杂交以生理盐水处理的中华绒螯蟹血淋巴细胞mRNA为tester,经嗜水气单胞菌感染后的中华绒螯蟹血淋巴细胞mRNA 为 driver。
1.2.3 消减效率的检测 用中华绒螯蟹β-actin特异的上游引物:5'-GCATCCACGAGACCACTT ACA-3',下游引物:5'-CTCCTGCTTGCTGATCCACATC-3',对消减后第2次PCR产物进行消减效率分析。同时,以未经消减杂交的cDNA(在制备Tester cDNA连接2种接头时,将刚好加样还未进行连接反应的Tester1-1 cDNA和Tester1-2 cDNA各取2:l混合,进行连接反应完成)作为对照进行PCR,反应条件:94℃预变性5 min,然后94℃,30 s;60℃,30 s;72℃,1 min扩增,33个循环,分别在第18、23、28、33循环处各取5 μL进行电泳,检测消减效率。
1.2.4 消减文库的构建及检测 将第2次PCR的产物连接到Promega公司提供的载体pGEM-T easy,转化到E.coli DH5α感受态细胞,用氨苄青霉素和蓝白斑法筛选阳性克隆。随机挑取15个阳性克隆进行PCR检测,引物为Nesetd PCR Primer l和Nested PCR Primer 2R。随机从文库中挑取54个阳性克隆送样测序。
1.2.5 序列分析与同源性比对 利用DNAMAN软件对测序结果进行去除载体及接头序列、剔除重复序列分析,获得部分差异表达序列标签(ESTs),将获得的ESTs序列提交到NCBI使用BLASTn进行序列相似性搜素,并初步推断差异表达基因的功能。
2 结果与分析
2.1 总RNA电泳鉴定
提取的感染组和对照组中华绒螯蟹血淋巴细胞总RNA经1%琼脂糖凝胶电泳后发现,总RNA以18 S条带为主,未见弥散现象,说明总RNA未发生降解(图1),达到了构建文库要求。
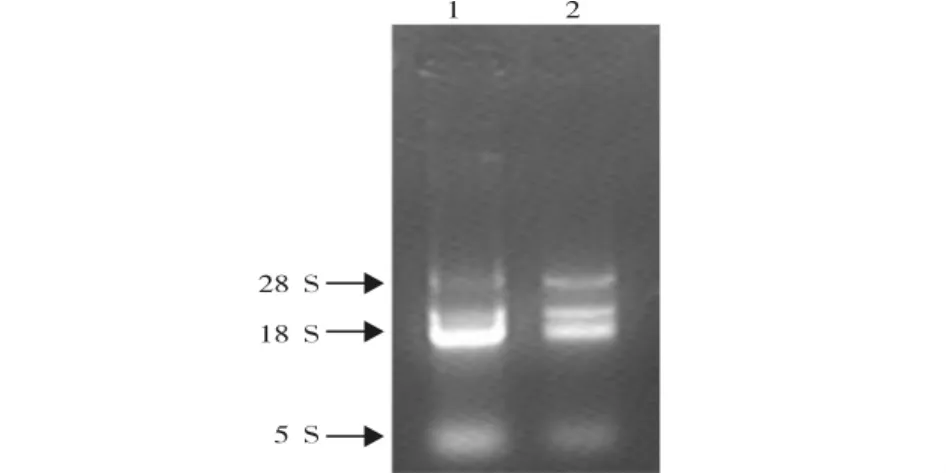
图1 中华绒螯蟹总RNA电泳图Fig.1 Electrophoresis of Eriocheir sinensis total RNA

图2 双链cDNA电泳图Fig.2 Electrophoresis of Eriocheir sinensis cDNA
2.2 SMART cDNA 合成
提取的总RNA经反转录酶逆转录合成第一、第二链cDNA,获得双链cDNA,经1%琼脂糖凝胶电泳后发现,双链cDNA为弥散状条带,片段大小均大于0.1 kb(图2),符合试验要求。
2.3 Rsa I酶切
对双链DNA进行酶切后电泳,结果发现,酶切后的片段明显较未经酶切片段减小(图3),说明酶切效果较好,可以进行下一步cDNA接头的连接。
2.4 接头连接效率分析
双链cDNA与接头连接效率的高低是决定抑制性消减杂交成败非常关键的一步。利用中华绒螯蟹管家基因β-actin上下游特异性引物以及试剂盒所带的3'端特异性引物与PCR primer 1对两组分别连接有接头1和接头2的cDNA进行PCR扩增,经琼脂糖凝胶电泳后发现,管家基因的3'端特异引物与接头的外侧引物primer 1组合的扩增片段大于管家基因3'、5'端特异引物组合的扩增片段,且以β-actin内部特异引物和接头引物组成的引物组扩增产物亮度超过以β-actin 2个特异引物为引物组扩增产物亮度的1/4(图4),说明连接效果较好,接头的连接效率至少达到25%,可以用于消减杂交。
2.5 第一轮PCR
用接头序列的外侧引物对消减杂交产物进行第一轮PCR扩增,30个循环后,正向和反向消减杂交产物的PCR产物均呈弥散状条带(图5)。

图3 Rsa I酶切分析Fig.3 Reverse transcription cDNA of Eriocheir sinensis after Rsa I digestion and not Rsa I digestion
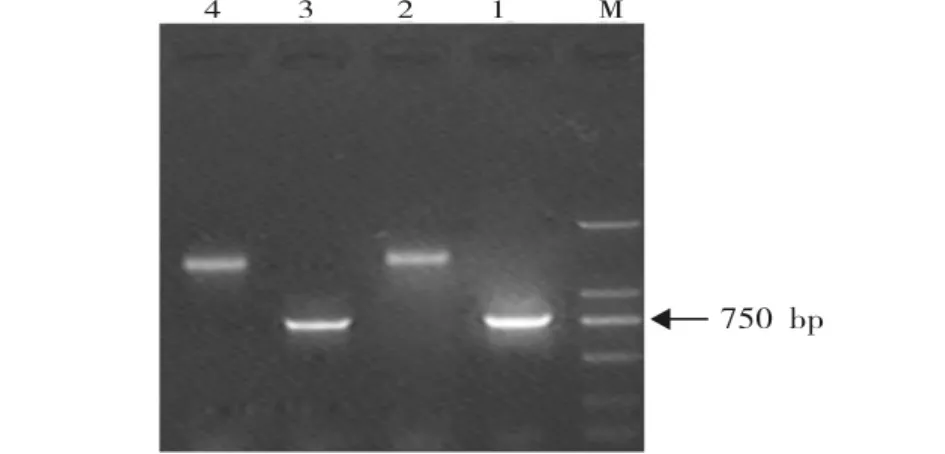
图4 接头连接效率检测Fig.4 Test of adaptors ligation efficiency

图5 消减产物第一轮PCRFig.5 The first PCR result of subtractive hybridization product

图6 消减产物第二轮PCRFig.6 The second PCR result of subtractive hybridization product
2.6 第二轮PCR
用接头序列的内侧引物对第一轮PCR稀释产物进行第二次PCR扩增(巢式PCR),15个循环后发现,第二轮PCR产物为0.2~1.5 kb之间的大小不一条带(图6)。
2.7 消减文库的质量检测
将第二次PCR扩增产物与pGEM-T Easy载体连接,转化DH5α感受态细胞,进行消减cDNA质粒文库的构建。随机从文库挑取15个阳性克隆,以Nesetd PCR Primer l和Nested PCR Primer 2R为引物进行菌落PCR扩增,结果发现,插入cDNA片断的大小主要集中在100~1 000 bp之间(图7),表明所构建文库质量较好,可以用于后续的测序分析。
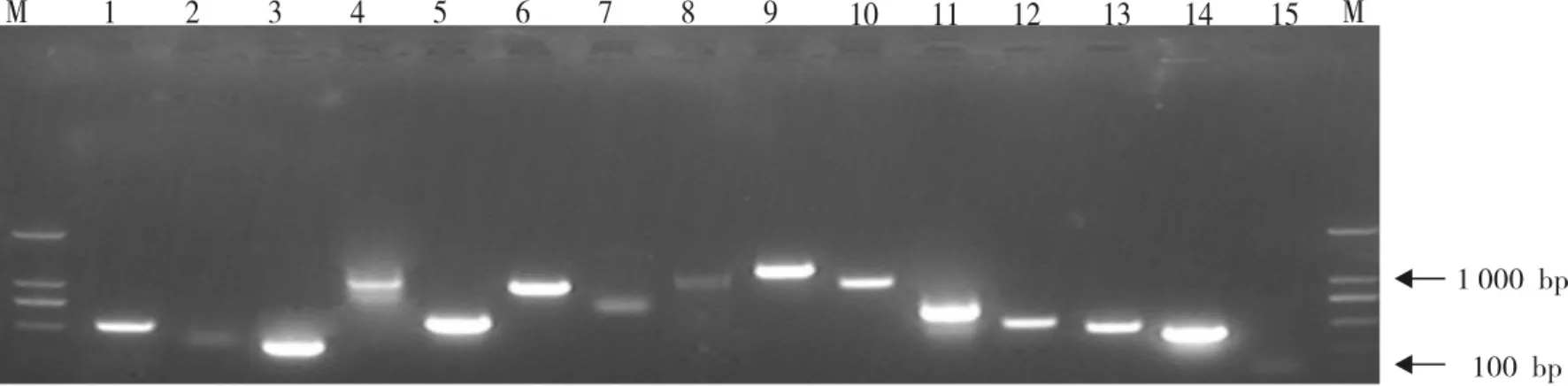
图7 菌落PCR检测消减cDNA文库克隆插入片段大小Fig.7 Identification of the inserted cDNA fragment in subtractive cDNA library by PCR
2.8 差异表达的EST序列分析
将54个阳性克隆送样测序,测序结果通过DNAMAN软件分析,获得37条EST序列。将获得序列提交到NCBI选择BLASTn进行比对发现,有6条ESTs与其他物种的免疫基因序列具有较高的同源性(表1),说明所构建的文库达到了富集抗病相关基因的目的,可用于下一步免疫相关基因的筛选和功能分析。

表1 免疫相关的差异表达片段BLAST同源性比对结果Tab.1 BLAST analysis result of differentially expressed immune-related segments
3 讨论
起始总RNA和mRNA的质量和完整性是差异表达cDNA文库能否成功构建的关键步骤之一。从图1可见,本试验所提取的血淋巴细胞总RNA经琼脂糖凝胶电泳检测发现有18 S、28 S和5 S三条清晰的条带,说明提取的总RNA具有很好的完整性。一般认为,在真核生物中,总RNA在正常情况下28 S rRNA的亮度约为18 S rRNA的两倍[11],但本试验发现,28 S rRNA的亮度低于18 S rRNA,这种现象在中国对虾[12]和凡纳滨对虾[13]中也存在。出现这种现象的原因可能有四点:一是试验过程中有部分28 S rRNA被降解;二是中华绒螯蟹总RNA的28 S rRNA比18 S rRNA少;三是RNA在电泳过程中28 S rRNA更易形成二级结构;四是不同物种间总RNA的28 S rRNA和18 S rRNA比例不同所致[13]。另外,在文库构建过程,从反转录合成cDNA及RasⅠ酶切检测、加接头连接效率到消减cDNA片段的消减效率分析等每个环节都进行实时监控,保证每步获得的结果达到后续试验的要求,确保获得高质量的差异表达cDNA文库。从菌落PCR扩增及阳性克隆测序结果可以看出,所获得的阳性克隆片段大小具有很好的多态性,同时一些与抗病相关的基因得到了富集。
通过进一步对随机挑取的54个阳性克隆进行测序和序列比对发现,有6条EST序列与免疫相关。其中,Hem 01与油橄榄(Olea europaea)类甜蛋白(Thaumatin-like protein,TLP)基因序列相似性达到100%,该基因已被证实具有显著的抗真菌活性,一些转TLPs基因的植物对于真菌性病害的抗性也显著增强[15]。Hem 02与栽培苹果(Malus domestica)金属硫蛋白(metallothionein,MT)基因序列相似性为100%,已有研究表明,该基因在中华绒螯蟹先天免疫应答中发挥重要功能[16]。作为先天性免疫系统的重要组成部分,Toll样受体(Toll-like receptors,TLRs)是生物的一种模式识别受体(pattern recognition receptor,PRR),它主要通过识别病原相关分子模式(pathogen-associated molecular patterns,PAMPs)来启动免疫反应。已发现TLRs在炎症、细胞凋亡、肿瘤等发生过程中扮演重要角色,同时具有介导抗真菌感染信号转到的功能。本研究从文库中筛选的Toll样受体(Hem 03)及已报道的从中华绒螯蟹cDNA文库中获得的该基因EST序列[5]表明,Toll样受体在该物种抗病过程中具有重要的功能,对该基因的进一步研究将有助于更深入的了解中华绒螯蟹的免疫应答机制。Crustin是一类具有广谱抗菌活性的抗菌肽,研究表明,Crustin普遍存在于甲壳动物(蟹、对虾、龙虾、螯虾等)血淋巴中,对细菌和真菌均有抗菌活性[17-18]。本研究筛选到的该基因(Hem 04)与大西洋小龙虾(Nephrops norvegicus)相似性为97%,且该基因已被证实参与了中华绒螯蟹的先天免疫应答反应[19]。另外,有研究表明,从文库中筛选获得的组织蛋白酶基因(Hem 04)也与中华绒螯蟹抗病相关[20]。转化生长因子(TGF)是多种免疫细胞的骨泌或旁分泌调节因子,在特异性抗原等刺激下,核巨噬细胞和淋巴细胞被激活,产生并释放TGF。这些免痤细胞都有TGF受体,激活后所释放的TGF以自分泌或旁分泌方式反馈作用于这些细胞。几乎所有的正常细胞表面都有TGF受体,现已知有三种高亲和性的细胞膜受体,称为I型、Ⅱ型和Ⅲ型受体。其中,I型受体是糖蛋白,是一种跨膜的丝氨酸/苏氨酸激酶,主要介导TGF对细胞外基质作用的信号转导[21]。本研究筛选到的转化生长因子受体基因(Hem 06)将有助于进一步了解中华绒螯蟹免疫信号识别及传递途径和机制。
以上结果表明,本研究获得了中华绒螯蟹高质量的差异表达cDNA文库,可用于后续大规模测序及EST分析,并且可以从该文库中筛选出一些差异表达的与免疫相关的基因序列。对这些基因序列可进一步通过设计引物,进行基因全长扩增,并对其功能进行研究,为阐述中华绒螯蟹先天免疫反应的分子机制提供理论依据。
[1]宋林生,季延宾,蔡中华,等.温度骤升对中华绒螯蟹(Eriocheir sinensis)几种免疫化学指标的影响[J].海洋与湖沼,2004,35(1):74 -77.
[2]艾春香,陈立侨,高露姣,等.VC对河蟹血清和组织中超氧化物歧化酶及磷酸酶活性的影响[J].台湾海峡,2002,21(4):431-438.
[3]马贵华,钟青,曹义虎,等.中华绒螯蟹酚氧化酶的初步研究[J].江西农业学报,2006,18(1):41-44.
[4]沈锦玉,钱冬.中华绒螯蟹病毒病原的初步研究[J].华中农业大学学报,2000,19(5):487-489.
[5]Gai Y C,Wang L L,Zhao J M,et al.The construction of a cDNA library enriched for immune genes and the analysis of 7535 ESTs from Chinese mitten crab Eriocheir sinensis[J].Fish and Shellfish Immunology,2009,27(6):684 -694.
[6]Mu C K,Zhao J M,Wang L L,et al.A thioredoxin with antioxidant activity identified from Eriocheir sinensis[J].Fish and Shellfish Immunology,2009,26(5):716 -723.
[7]Qin C J,Chen L Q,Qin J G,et al.Characterization of a serine proteinase homologous(SPH)in Chinese mitten crab Eriocheir sinensis[J].Developmental and Comparative Immunology,2010,34(1):14 -18.
[8]Zhao D X,Chen L Q,Qin C J,Zhang H,Wu P,Zhang F Y.A delta-class glutathione transferase from the Chinese mitten crab Eriocheir sinensis:cDNA cloning,characterization and mRNA expression[J].Fish and Shellfish Immunology,2010,29(4):698-703.
[9]Zhu Y X,Cao G L,Xue R Y,et al.The identification and characteristic of Aeromonas hydrophila from Eriocheir sinensis[J].Journal of Suzhou University(Natural Science),2002,18(3):100 -106.
[10]Diatchenko L,Lau Y F,Campbell A P,et a1.Suppression subtraction hybridization:a method for generating differentially regulated or tissue specific cDNA probes and libraries[J].Proc Nail Acad Sci USA,1996,93(12):6025 - 6030.
[11]王在照,焦传珍,张晓军,等.中国对虾蜕皮抑制激素全长cDNA的克隆及序列分析[J].遗传学报,2003,30(2):128-134.
[12]Wang B,Li F H,Dong B,et al.Discovery of the genes in response to white spot syndrome virus(WSSV)infection in Fenneropenaeus chinensis through cDNA microarray[J].Marine Biotechnology,2006,8(5):491 -500.
[13]蔡小辉,鲁义善,吴灶和,等.溶藻弧菌诱导凡纳滨对虾消减文库的构建及其表达序列标签分析[J].水生生物学报,2010,34(1):157 -163.
[14]贾锡伟,王艺磊,张子平,等.利用SMART技术构建锯缘青蟹精巢和卵巢的cDNA文库[J].厦门大学学报:自然科学版,2004,43(4):547 -550.
[15]Zhu B L,Chen T H,Li P H.Analysis of late-blight disease resistance and freezing tolerance in transgenic potato plants expressing sense and antisense genes for an osmotin-like protein[J].Planta,1996,198(1):70 -77.
[16]Ren F,Jiang H,Sun J L,et al.Cloning,characterization,expression,and copper sensitivity of the metallothionein-1 gene in the Chinese mitten crab,Eriocheir sinensis[J].Molecular Biology Reports,2011,38(4):2383 -2393.
[17]Relf J M,Chisholm J R,Kemp G D,et al.Purification and characterization of a cysteinerich 11.5 kDa antibacterial peptide from the granular haemocytes of the shore crab,Carcinus maenas[J].European Journal of Biochemistry,1999,264(2):350 -357.
[18]Smith V J,Fernandes JMO,Kemp G D,et al.Crustins:enigmatic WAP domain-containing antibacterial proteins from crustaceans[J].Developmental and Comparative Immunology,2008,32(7):758 -772.
[19]Mu C K,Zheng P L,Zhao J M,et al.Molecular characterization and expression of a crustin - like gene from Chinese mitten crab,Eriocheir sinensis[J].Developmental and Comparative Immunology,2010,34(7):734 -740.
[20]Li W W,Jin X K,He L,et al.Molecular cloning ,characterization and expression analysis of cathepsin C gene involved in the antibacterial response in Chinese mitten crab,Eriocheir sinensis[J].Developmental and Comparative Immunology,2010,34(11):1170-1174.
[21]李京红.转化生长因子β受体研究进展[J].国外医学生理、病理科学与临床分册,1998(1):28-30.

