一种人源性穿膜肽融合蛋白中连接肽的引入及其在HeLa细胞中的穿膜活性
李堰忠,杨旭中,吕 强,王富军,赵 健*
(1.华东理工大学 生物反应器工程国家重点实验室,上海 200237;2.上海中医药大学,上海 201203)
许多药物蛋白需要在细胞内才能发挥作用。然而细胞膜作为细胞的天然屏障,使其无法进入细胞发挥效应[1],主要原因是活性分子的亲水特性[2],因此成为一些蛋白药物开发的瓶颈。
细胞穿膜肽(cell-penetrating peptides,CPPs)是一些小于30个氨基酸[3]的短肽,能够携带分子量比自身大许多倍的分子进入细胞[4],这一特性依赖于其自身所带正电荷和特殊的二级结构[5]。Green和Frankel[6-7]首次观察到来自HIV-1反式激活因子的TAT序列可以被不同类型的细胞高效吸收。但由于来源于病毒的TAT在临床因安全性方面存在风险,人源性的穿膜肽正不断受到人们的关注。
p14ARF是一种人肿瘤抑制因子,在正常细胞中参与细胞周期的调控。研究人员发现化学法合成的p14ARF N端22个氨基酸(MVRRFLVTLRIRRACGPPRV RV-NH2),即ARF,具有携带大分子穿过细胞膜进入细胞的功能,其穿膜效率具有浓度和时间依赖性,并且ARF还能进一步诱导细胞凋亡效应[3]。但化学法合成ARF用于携载药物蛋白成本高,本文根据大肠杆菌密码子偏爱性,设计合成ARF核酸序列,构建重组质粒,以绿色荧光蛋白EGFP作为携载分子与ARF进行融合表达,观察ARF在HeLa细胞中的转导活性。
在融合蛋白构建中,为了保证融合蛋白中各蛋白的活性,融合蛋白之间通常需要加入特定的短肽,称为Linker[8],从空间上分隔融合的两个蛋白分子折叠时的互相干扰,保持各自的功能[9]。连接肽序列(linker peptide)的选择与设计是构建融合蛋白的关键[10],包括连接肽的长度、结构的刚性和柔性以及连接肽电荷性质等[11]。鞠武建等[12]在重组蛋白中引入连接肽后,蛋白活力提高四倍。Ryoichi等[13]研究了不同形式的连接肽,结果表明刚性连接肽和柔性连接肽能保证融合蛋白正确折叠,发挥作用,甚至增强其功能。另有报道[8]认为连接肽长度过长时,融合蛋白稳定性下降,并对蛋白酶敏感,表达时易被降解,导致活性蛋白产量下降。本实验尝试在ARF与EGFP融合蛋白之间引入不同长度(linker2、linker7)和不同结构特点如柔性(flexible linker)或刚性 (stable linker)的连接肽,研究其对融合蛋白功能的影响,并观察各种连接肽对ARF携载EGFP穿膜活性的影响,为ARF携带药物蛋白进入细胞内有效发挥药理作用进行探索研究。
1 材料与方法
1.1 材料
1.1.1 菌株与载体 文中所使用的大肠杆菌JM83由叶江老师惠赠;HeLa细胞、大肠杆菌BL21(DE3)为本实验室保存;表达载体pET28a-EGFP由本实验室构建。
1.1.2 培养和表达纯化 大肠杆菌培养基为LB培养基;诱导剂为异丙基硫代-β-D-半乳糖苷(IPTG)终浓度为50 μg/mL;表达重组质粒时添加卡那霉素,终浓度为50 μg/mL;15℃下诱导12~16 h;超声破碎菌体,Ni-NTA柱纯化目的蛋白。
1.1.3 试剂 限制性内切酶、T4连接酶、DNA Marker、蛋白Marker购自TAKARA;IPTG购自上海生工;质粒抽提试剂盒购自上海捷瑞生物工程有限公司;DNA凝胶回收试剂盒购自Biomiga公司。
1.2 方法
1.2.1 常规操作 酶切和连接、大肠杆菌感受态制备及转化、SDS-PAGE电泳等技术参见《现代分子生物学实验技术》等。
1.2.2 重组质粒pET28a-EGFP-linker2-ARF的构建 依据文献所报道的ARF氨基酸序列(VRVRPPGCARRIRLTVLFRRVM)和大肠杆菌密码子偏爱性,设计并由上海捷瑞生物工程有限公司合成ARF正反义链,引入酶切点BamH I和Xho I(下划线)。
正义链:
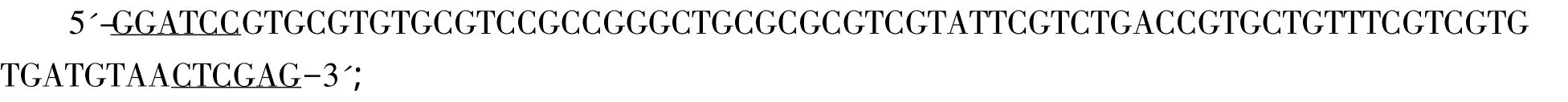
反义链:
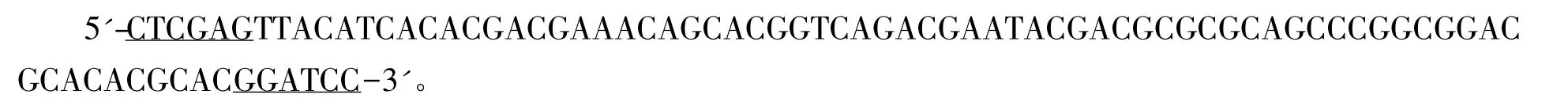
将合成的ARF核酸序列溶解、混合,100℃沸水浴变性10 min,室温下复性,用T4 ligase与BamH I/Xho I联合酶切的pET28a-EGFP(本实验保存)连接,转化感受态大肠杆菌JM83,鉴定并测序。重组质粒命名为 pET28a-EGFP-linker2-ARF。
1.2.3 pET28a-EGFP-linker7S-ARF、pET28a-EGFP-linker7F-ARF 融合质粒构建 以 EGFP 基因为模板,在其3'端分别引入柔性7肽(GGGGSGS)和刚性7肽(EAAAKGS),并引入酶切位点Nde I和BamH I,引物见表 1。
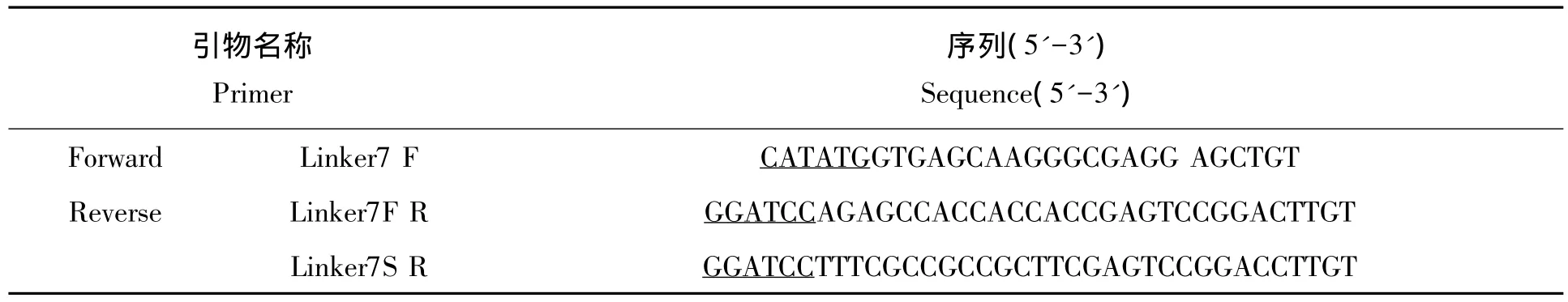
表1 扩增7个氨基酸柔性和刚性连接肽的PCR引物Tab.1 The PCR primers for stable and flexible linker peptide of 7 amino acids
PCR反应条件如下:95℃预变性5 min;95℃变性50 s,退火温度0.5 min,72℃延伸1 min,循环30次;72℃延伸10 min,4℃保温。电泳并回收目的条带,连接至pMD19-T simple vector后测序。测序正确后以Nde I/BamH I联合酶切并回收目的片段,并与相同内切酶处理的pET28a-EGFP-linker2-ARF载体连接,构成重组质粒,分别命名为 pET28a-EGFP-linker 7F-ARF、pET28a-EGFP-linker 7S-ARF(图1)。
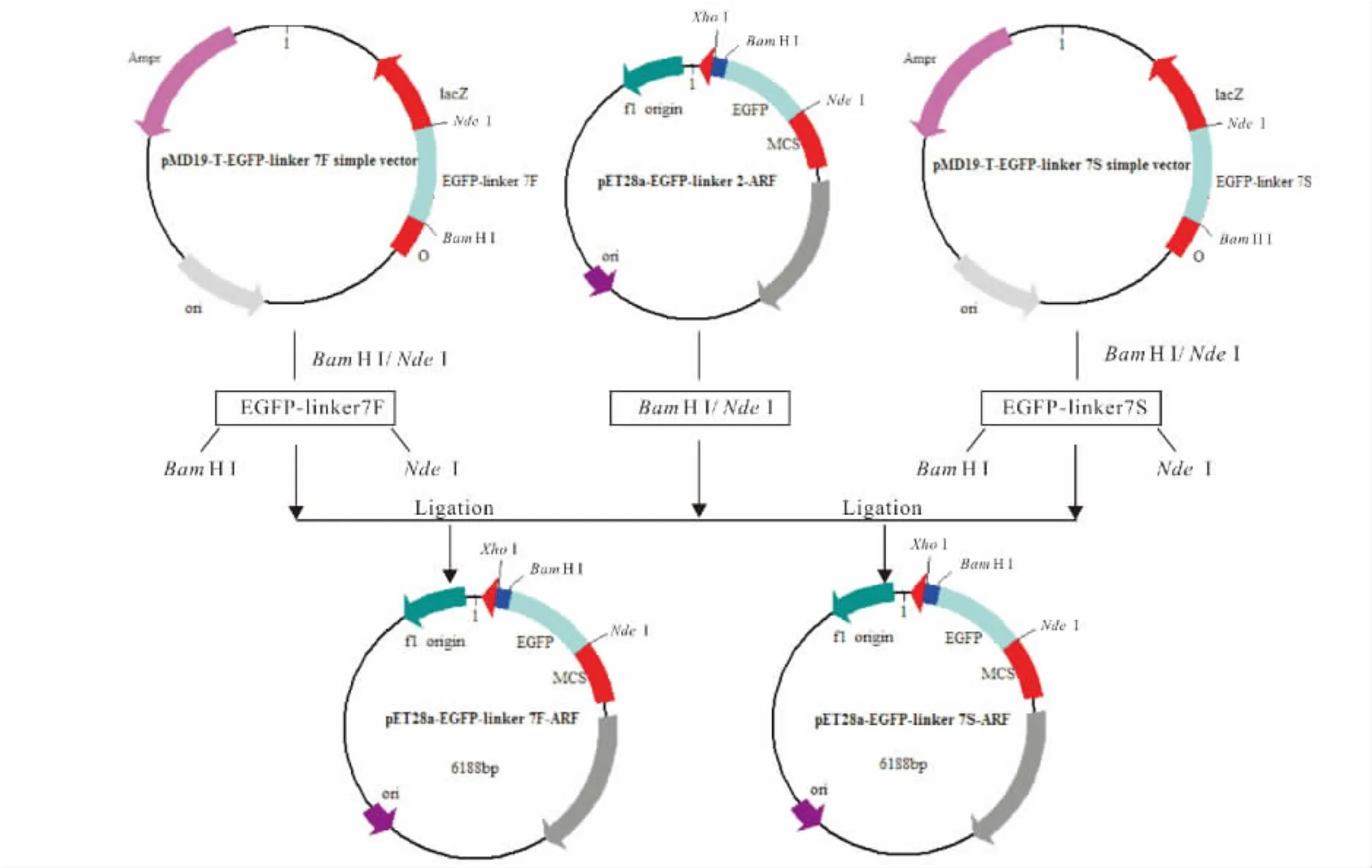
图1 pET28a-EGFP-linker 7S-ARF、pET28a-EGFP-linker 7F-ARF 重组质粒的构建Fig.1 Construction of recombinant plasmids of pET28a-EGFP-linker 7S-ARF、pET28a-EGFP-linker 7F-ARF
1.2.4 融合蛋白在E.coli中的表达与纯化 将表达质粒转化E.coli BL21(DE3),挑取LB固体培养基上单菌落,接种于30 mL含卡那霉素(50 μg/mL)的LB培养基中,培养8~12 h;将此培养物以1%的接种量接种至200 mL含卡那霉素(50 μg/mL)的LB培养基中,培养至菌液OD600为0.8~1.0后,加入IPTG,终浓度为50 μg/mL,15℃诱导表达过夜。将过夜表达的菌液离心收集,用缓冲液(20 mmol/L Tris-HCl,0.5 mmol/L NaCl,5%甘油,pH 8.5)重悬,超声破碎并离心,收集上清。
利用融合蛋白N端6×His标签,由Ni-NTA柱纯化富集(填料型号:Ni-NTA Agarose Cat#R901-15,Invitrogen)。用20 mmol/L Tris-HCl缓冲液(pH8.5)平衡 Ni-NTA 柱后,将上述上清过柱。20 mmol/L Tris-HCl缓冲液洗涤,共5倍柱体积。200 mmol/L咪唑洗脱得到目的蛋白。收集目的蛋白,用梯度浓度NaCl透析液透析蛋白,13.5%SDS-PAGE电泳鉴定蛋白纯度。
1.2.5 融合蛋白荧光强度检测 Bradford法测定3个蛋白浓度,用缓冲液(20 mmol/L Tris-HCl,pH7.2)稀释至10 μg/mL。各取100 μL加至黑色96孔板内,利用荧光酶标仪分析三者的荧光强度。1.2.6 激光共聚焦检测 将HeLa细胞以5×104/孔接于放有玻片的24孔板中,于37℃培养约8 h,至其贴壁后加入100 μg/mL样品孵育10 h,用0.4%多聚甲醛固定后DAPI染色,激光共聚焦观察。
2 结果与分析
2.1 EGFP-linker2-ARF 融合蛋白的构建、表达和纯化
按照材料与方法1.2.2构建 pET28a-EGFP-linker2-ARF,测序表明质粒构建成功。将其转化BL21(DE3)菌株,IPTG诱导表达、纯化,得到融合蛋白EGFP -linker2- ARF,SDS-PAGE 电泳结果显示融合蛋白分子量约为30 ku(图2),与预期相符,说明融合蛋白成功进行了表达。
但EGFP-linker2-ARF融合蛋白荧光强度非常弱(图3),推测由于linker2过短,导致ARF严重干扰了EGFP的折叠,因此影响融合了EGFP功能的发挥。

图2 重组蛋白EGFP-linker2-ARF的SDS-PAGE检测Fig.2 SDS-PAGE detection of expressed recombinant protein EGFP-linker2-ARF
2.2 EGFP-linker7 F/S-ARF 融合蛋白表达质粒的构建
为了避免ARF对EGFP折叠的影响,进一步将连接肽优化为linker 7S和linker 7F。按照方法1.2.3,以设计的 linker7引物进行 PCR(表1)扩增得到大小为759 bp的片段,如图4(a),酶切后将其与相同内切酶处理的pET28a-EGFP-linker2-ARF表达质粒连接,构建重组质粒pET28a-EGFP-linker 7S-ARF 和 pET28a-EGFP-linker 7F-ARF,由双酶切鉴定,插入片段大小正确,如图4(b),重组质粒构建正确。

图3 融合蛋白荧光强度比较Fig.3 Comparison of fluorescence intensity between 3 recombinant proteins
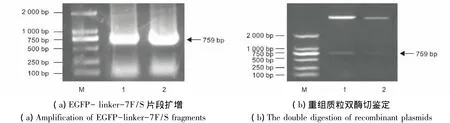
图4 EGFP-linker 7S和EGFP-linker 7F核酸片段的扩增及重组质粒双酶切鉴定Fig.4 Amplification of EGFP-linker 7S and EGFP-linker 7F fragments and identification of recombinant plasmids by double digestion
2.3 EGFP-linker 7S-ARF、EGFP-linker 7F-ARF 在 E.coli中的表达与纯化
按照1.2.4 节所述,将构建成功的表达质粒 pET28a-EGFP-linker 7S-ARF 和 pET28a-EGFP-linker 7F-ARF在宿主菌E.coli中表达,其表达纯化图谱分别如图5(a)、5(b)所示。融合蛋白分子量大小约为30 ku,与预测相符。经Ni-NTA亲和层析柱一步纯化后,分别得到目的蛋白EGFP-linker 7S-ARF(图5a,lane7)和 EGFP-linker 7F-ARF(图 5b,lane7),电泳条带显示目的蛋白可能有降解,因此进行Western blot检验。图5(b)-8为EGFP-linker 7F-ARF融合蛋白的Western杂交结果,说明纯化的样品确有部分降解。
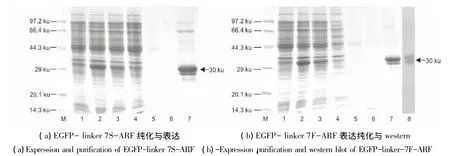
图5 融合蛋白的SDS-PAGE和western blot检测Fig.5 SDS-PAGE and western blot detection of expressed recombinant protein
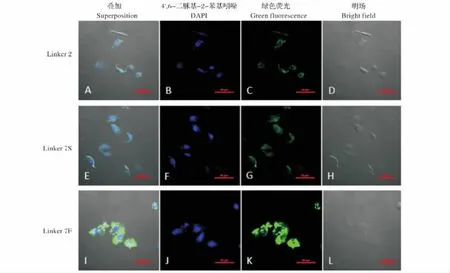
图6 激光共聚焦显微镜检测融合蛋白对HeLa细胞的穿膜活性(60×)Fig.6 The uptake efficiency of fusion proteins by HeLa via laser confocal microscope(60×)
2.4 不同linker的融合蛋白荧光强度检测
利用荧光酶标仪,在相同蛋白浓度下(10 μg/mL),对 EGFP-ARF 各种不同连接肽的融合蛋白进行荧光检测,测定3种蛋白荧光强度(图3)。结果表明,EGFP-linker 7S-ARF和EGFP-linker 7F-ARF荧光强度分别 EGFP-linker 2-ARF高 2.5倍和2.9倍。说明引入linker 7后,融合蛋白荧光强度增加,即增加连接肽长度有利于绿色荧光蛋白的正确折叠。
2.5 融合蛋白 EGFP-linker 7-ARF的穿膜活性检测
由于linker7连接肽的引入使融合蛋白的荧光强度增强,进一步利用激光共聚焦技术对EGFP-linker7-ARF的穿膜活性进行观察。以EGFP-linker 2-ARF为对照,发现不同连接肽对融合蛋白细胞的转导活性有显著影响,结果见图6。胞内荧光强度定量分析表明,EGFP-linker 7F-ARF胞内荧光强度与 EGFP-linker2-ARF和 EGFP-linker 7S-ARF相比有明显增强,分别提高了4.9倍和3.8倍 (图7)。进一步观察发现融合蛋白EGFP-linker 7F-ARF在HeLa细胞中的细胞核和胞质中均有分布(图6K)。
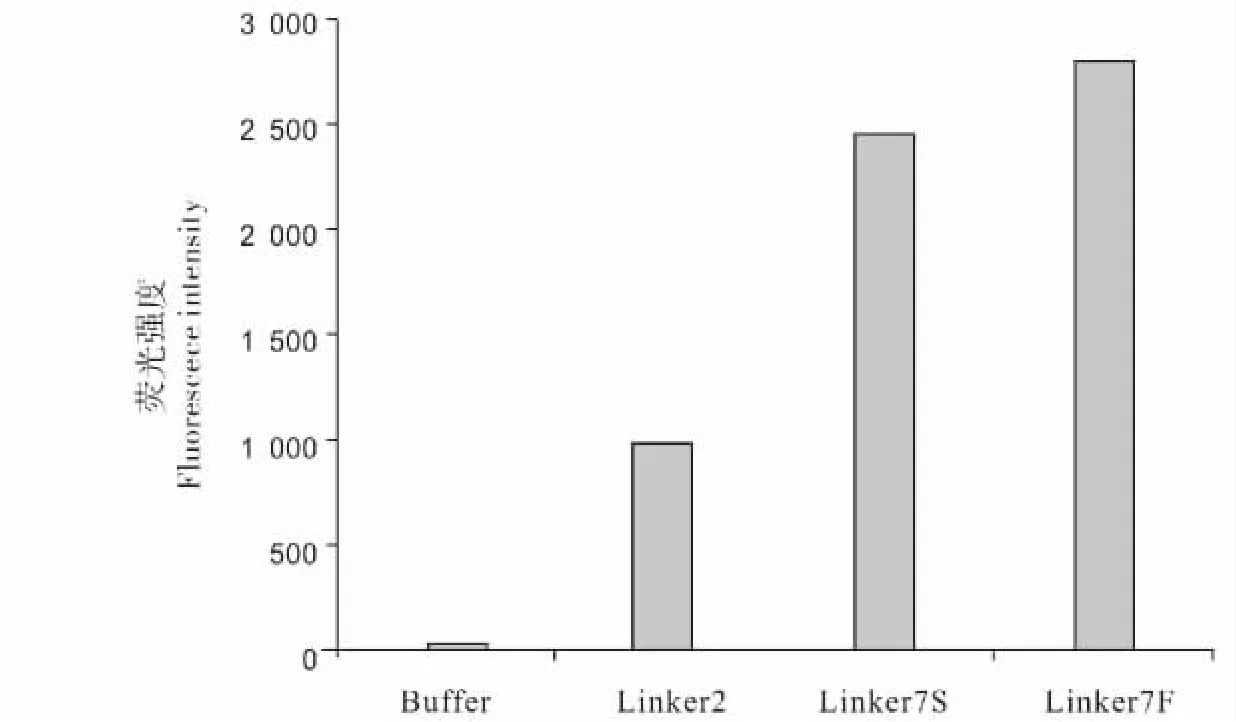
图7 3种不同连接肽的融合蛋白胞内平均荧光强度比较Fig.7 Comparison of average fluorescence intensity of recombinant proteins with three different linker peptides in cells
3 讨论
真核细胞及其细胞器的膜对亲水性活性分子和药物到达靶点发挥功能形成障碍。许多技术被用于提高外源分子进入细胞的内化效率,如脂质体转染等,但效率都较低。细胞穿膜肽(cell-penetrating peptide)作为一种新型的药物运输工具,由于其转导活性高,目前已经引起研究者的广泛关注[4]。
ARF是由Henrik等[3]发现的一种人源性穿膜肽,研究人员通过其多肽直接合成的方法进行了ARF穿膜活性研究,但化学合成的方法成本高,且无法判断其对蛋白药物的运输能力。本课题组以EGFP为携载蛋白,利用融合蛋白表达技术,表达并纯化了融合蛋白EGFP-ARF,观察它对HeLa细胞的转导活性。
实验设计中首先在融合蛋白EGFP-ARF中引入2个氨基酸的连接肽,称为EGFP-linker2-ARF,但重组蛋白荧光强度非常弱。据相关文献报道[11],适宜的连接肽长度对融合蛋白的功能至关重要,推测是由于连接肽过短,导致EGFP蛋白功能受到影响。随后在EGFP和ARF之间引入7个氨基酸长度的连接肽,并且分别以刚性和柔性的方式进行连接,称为融合蛋白EGFP-linker 7S-ARF(刚性连接)和EGFP-linker 7F-ARF(柔性连接),并成功地进行了融合蛋白的表达和纯化,Western blot结果显示,与linker2相比,较长的连接肽可能会导致目的蛋白稍有降解,后续研究中可以考虑将His标签置于融合蛋白C端,可以避免重组蛋白表达和纯化过程中的降解。荧光强度检测结果显示EGFP-linker 7-ARF的荧光强度比EGFP-linker 2-ARF的高,表明增加连接肽长度,可以明显提高EGFP的生物活性。进一步通过激光共聚焦技术观察3种不同连接肽的融合蛋白对HeLa细胞的穿膜活性,结果显示EGFP-linker 7F-ARF和EGFP-linker 7S-ARF的胞内荧光强度与EGFP-linker 2-ARF相比都有提高,其中linker 7S连接方式提高最明显,为linker 2的5倍左右。说明柔性连接肽对EGFP正确结构的折叠和ARF空间结构影响都比较小,因此保持了EGFP-linker 7F-ARF对HeLa细胞较高的穿膜活性。
人源性穿膜肽以其出色的携载能力、穿膜能力和安全性,已经成为肿瘤药物开发的热点;然而连接肽的选择是融合蛋白技术中的关键步骤,本实验比较了连接肽长度和性质,实验结果显示ARF和EGFP之间引入7个柔性连接的氨基酸连接肽的融合蛋白EGFP-linker 7F-ARF穿膜活性最佳。本课题为人源性穿膜肽ARF连接肽的选择及其作为药物运输载体的研究提供了借鉴。
[1]赵健,肖伟,范立强,等.一种新型凋亡素融合蛋白的克隆表达及活性测定[J].食品与药品,2009,11(7):7-11.
[2]EL-Andaloussi,Holm S,Langel ü T.Cell-penetrating peptides:mechanisms and applications[J].Current Pharmaceutical Design,2005,28(11):3597-3611.
[3]Henrik J Johansson,Samir El-Andaloussi.Characterization of a novel cytotoxic cell-penetrating peptide derived from p14ARF protein[J].Molecular Therapy,2008,16(1):115-123.
[4]Niarchos D K,Perez S A.Characterization of a novel cell penetrating peptide derived from Bag-1 protein[J].Peptides,2006,27(11):2661-2669.
[5]Zhao J,Gao P.A novel human derived cell-penetrating peptide in drug delivery[J].Molecular Biology Report,2011,38(4):2649-2656.
[6]Frankel A D,Pabo C O.Cellular uptake of the tat protein from human immunodeficiency virus[J].Cell,1988,55:1189-1193.
[7]Green M,Loewenstein P M.Autonomous functional domains of chemically synthesized human immunodeficiency virus tat trans-activator protein[J].Cell,1988,55:1179-1188.
[8]Gustavsson M,Lehtio J,Denman S,et al.Stable linker peptides for a cellulose-binding domain-lipase fusion protein expressed in pichia pastoris[J].Protein Eng,2001,14(9):711-715.
[9]Crasto C J,Feng J A.LINKER:a program to generate linker sequences for fusion proteins[J].Protein Eng,2000,13(5):309-312.
[10]王永祥,韩小艳,赵娜,等.Linker长度对MDC和CVB3VP1融合基因疫苗免疫效果的影响[J].河北医科大学学报,2007,28(3):224-227.
[11]房永祥,冯海燕,莫斯科,等.细胞因子融合蛋白技术及其应用前景[J].细胞与分子免疫学杂志,2009,25(9):856-859.
[12]鞠武建,胡美浩.导向溶栓分子scFv-UK32中连接肽的引入和在昆虫细胞中的表达[J].北京大学学报,2001,37(6):785-790.
[13]Ryoichi A,Hiroshi U,Atsushi K,et al.Design of linkers which effectively separate domains of a bifunctional fusion protein[J].Protein Eng,2001,14:529-532.

