黄芪总苷注射液人体耐受性Ⅰ期临床试验
陈光宇 丁红 刘永家 王若竹 张亚玲
黄芪总苷注射液系成都地奥九泓制药厂申报的中药第7类新药,拟用于心气虚损、气虚血瘀之病毒性心肌炎的治疗。在完成该品种的制剂、质量控制、药理、毒理等研究后。根据国家食品药品监督管理局《新药临床研究批件》(2004L03002)的要求,由成都中医药大学附属医院国家药物临床试验机构负责于2004年11月至2005年1月进行黄芪总苷注射液的Ⅰ期临床试验—人体耐受性试验。试验按照《药品注册管理办法》[1]、《药物临床试验质量管理规范》[2]、《中药新药临床研究的技术要求》[3]及黄芪总苷注射液的处方组成、功能主治、药效学、毒理学研究资料进行,现将试验结果报道如下。
1 对象与方法
1.1 对象
受试者均为健康志愿者。各组受试者用药前性别相当,年龄、身高、体重等人口统计学资料相近,无重要既往病史和药物过敏史,体温、心率、呼吸、血压、脉搏等生命体征均在正常范围,各实验室检查结果无具有临床意义的异常。
1.1.1 入选标准 (1)健康志愿者。(2)年龄18~40岁,男女各半。(3)体重指数18.5~23[体重指数=体重(kg)/身高(m)2]。(4)体格检查(体温、脉率、心率、心律、呼吸、血压,临床症状和体征,眼科检查,神经系统检查)。(5)正常者实验室检查(全血细胞分析、尿常规、大便常规含隐血、血电解质、血脂、空腹血糖、总胆红素、直接胆红素、丙氨酸氨基转换酶、门冬氨酸氨基转移酶、白球蛋白比、尿素氮、肌酐、乙肝标志物在正常范围内者;(6)心电图、胸部X光透视、肝、胆、脾、胰B型超声各项指标均在正常范围者。(7)皮肤划痕试验阴性者。(8)对试验目的、黄芪总苷注射液的主要药理作用、可能发生的不良反应及受试者的权益等有所了解,自愿参加本试验并签署知情同意书者。
1.1.2 排除标准 (1)经常用药、嗜烟酒者。(2)具有原发性心血管病变、肝脏病变、肾脏病变、血液病、肺脏疾病者。(3)精神或法律上的残疾者。(4)过敏体质,有药物、食物过敏史或已知对本药组成成分过敏者。(5)近3个月内参加过其它药物临床试验,或近3个月内用过已知对某脏器有损害的药物。(6)近1年内患过重病,正在使用其他预防或治疗药物者。(7)月经期、妊娠期及哺乳期妇女。
1.1.3 剔除标准 对已被选入本临床研究,属于以下情况之一者,作为剔除病例。(1)入组后发现不符合纳入标准,或符合排除标准者。(2)一次药未用者。(3)无任何记录者。
1.1.4 终止试验标准 在剂量递增过程中出现了严重不良反应,虽未达到最大剂量,亦应终止试验。如半数受试者出现轻度不良反应,应终止试验。在达到最大剂量时,虽未出现不良反应,亦应终止试验。
1.1.5 退出标准 (1)受试者依从性差,不能按时按量用药。(2)使用其他影响耐受性判断的药物。(3)受试者不愿意继续进行临床试验,向主管医生提出退出者。
1.2 研究药物
试验药品:黄芪总苷注射液,由成都地奥九泓制药厂提供,生产批号:040911,规格:100ml/瓶。
1.3 单次给药耐受性试验
1.3.1 初试剂量确定 根据改良Blachwell法计算。急性毒性试验资料:小鼠单次尾静脉注射半数致死量(LD50)为184.2g(生药)/kg,大鼠LD50为183.2g(生药)/kg;其1/600分别为0.307、0.305g(生药)/kg:按成人60kg计,预计初试剂量分别为18.42g生药、18.3g生药,相当于注射液36.84ml、36.6ml。长期毒性试验资料:犬长毒试验出现毒性的剂量为13.2g(生药)/kg,其1/60为0.22g(生药)/kg生药,按成人60kg计,预计初试剂量为13.2g生药,相当于注射液26.4ml。根据以上计算结果,结合临床可操作性,确定本试验的初试剂量为25ml/次。
1.3.2 最大剂量确定 根据犬长毒试验出现中毒症状的最小剂量13.2g/kg的1/10计算,60kg体重成人的最大剂量为79.2g生药,相当于注射液158.4ml。根据犬长毒试验资料,长期无毒剂量或安全剂量为6.24g/kg,其1/5~1/2分别为1.248~3.12g/kg,成人体重按照60kg计,最大剂量为74.88~187.2g生药,相当于黄芪总苷注射液149.76~374.4ml,考虑到受试者的安全,结合临床情况,拟定最大剂量为250ml/日/人。
1.3.3 剂量递增方案 参照费氏递增法(改良Fibonacci法)递增,见表1。

表1 剂量递增方案
1.3.4 试验例数 32例,男女各半。
1.3.5 分组方法 在试验开始前,预筛出32例符合入选标准的合格健康志愿受试者,按男性和女性分别根据体重编码排序随机分配至各剂量组。每个受试者只接受一个相应的剂量。
1.3.6 给药方法 25~250ml/人,静脉滴注,滴速20~30滴/分钟。
1.3.7 观察指标 受试者筛选指标:同入选标准(见1.1)。安全性观察指标:为筛选指标中除乙肝标志物、胸部X光透视、B型超声以外的所有指标;不良反应观察:仔细观察、记录试验过程中的不良事件,认真分析不良事件与试验药物的因果关系。在试验中出现的任何异常症状、体征、实验室检查结果、或其他特殊检查结果都应随访。
1.3.8 试验方法与观察时点 每次只试验一个剂量组,间隔1天或以上进行下一组试验,不可同时进行两个以上剂量组的试验。每个受试者只接受一个相应的剂量。从小剂量开始,每个剂量应用后未见明显不良反应,才可进行下一剂量组的试验。出现较重不良反应时或如半数受试者出现轻度不良反应,即使未达到最大剂量,均应停止试验。
32例合格健康志愿受试者的预筛、分组工作完成后,每个剂量组试验前24~48小时完成该组受试者病例登记、体格检查、眼科检查、神经科检查、实验室检查、心电图检查、乙肝标志物检查、B型超声检查及胸部X光透视等各项指标检查。
在开始给药即刻观察临床症状,给药后0.5小时、1小时、2小时、4小时、6小时、8小时、12小时、24小时观察记录一般情况、眼科检查、神经、循环、呼吸、泌尿、消化等系统及皮肤粘膜的临床症状和体征,并于给药后第24小时进行心电图检查和实验室检查,其检查内容为安全性观察指标检查(见1.3.7);并在给药后48小时、72小时分别观察临床症状。试验期间如出现不良反应者,应进行心电监护。
试验期间,受试者不得离开Ⅰ期临床试验病房,其饮食由医院膳食科统一配置清淡饮食。
1.4 连续给药耐受性试验
共12名受试者,按男性和女性分别根据体重编码排序被随机分为甲、乙两组,每组各6人,男女各半。剂量:甲组:剂量根据单次给药耐受性试验结果分析后与根据经验预测的Ⅱ期临床试验的剂量相同,100ml/次;乙组:剂量根据单次给药结果分析后确定为200ml/次,静脉滴注,滴速20~30滴/分,每天1次。疗程:10天。观察指标:与单次给药耐受性试验相同。
试验方法及观察时点试验前受试者的预筛同单次给药耐受性试验。观察时点为给药前、给药后每日及停药后24小时观察一般情况、临床症状、体征、眼科检查及神经科检查,给药后第24小时、72小时(第4天)、第7天以及第11天(即停药后24小时)还应进行实验室检查及心电图检查,检查内容为安全性观察指标检查内容(见1.3.7)。用药后第0小时(即刻)开始在整个试验期间观察临床症状,若出现与中毒有关的症状,应立即进行各项相关检查。对试验中出现反应的患者应追踪观察到恢复正常后一月;无反应者追踪观察到停药后一月。饮食要求同单次给药的耐受性试验。整个试验期间,受试者在Ⅰ期临床试验病房住院观察。
2 结果
2.1 单次给药的耐受性试验
本次试验实际观察受试者32例。用药后受试者体温、心率、呼吸、血压、脉搏等生命体征均在正常范围,用药后心电图检查未见与药物有关的有临床意义的异常改变。
150ml组有1例出现球蛋白轻度升高,未进行处理,与药物的关系无法判定;200ml组有1例出现白细胞减少,4天后恢复正常,未进行处理,与药物的关系无法判定;250ml组有1例出现皮疹,经皮肤科会诊后诊断为虫咬性皮炎,用药后消失,考虑与试验药物无关。
2.2 连续给药耐受性试验
本次试验实际观察受试者12例。按实验方案规定的时点,对两组受试者进行系统的问诊和体格检查,结果表明,用药后受试者体温、心率、呼吸、血压、脉搏等生命体征均在正常范围,用药后心电图检查未出现与药物有关的具有临床意义的异常改变。
两组各有1例出现咽痛等症状,诊断为上呼吸道感染,200ml组1例解2次稀便,均未作处置,未影响试验用药,考虑与试验药物可能无关。与试验药物有关或无法判定的不良事件见表2,其中不良事件绝大多数程度轻,均未进行相关处置,在继续用药的情况下,复查最终均恢复正常,说明以上事件可能为轻微的不良反应或不能确定为不良反应。
2.3 黄芪总苷注射液静脉滴注的安全剂量
单次给药耐受性试验7个剂量组实验结果,25ml、50ml、75ml、100ml和 250ml剂量组未出现与试验药物有关的不良反应,150ml和200ml剂量组各有1例不良事件,与试验药物的关系无法判定。未出现较重不良反应或半数受试者出现轻度不良反应,故I期耐受性临床试验单次给药安全剂量最大为250ml。
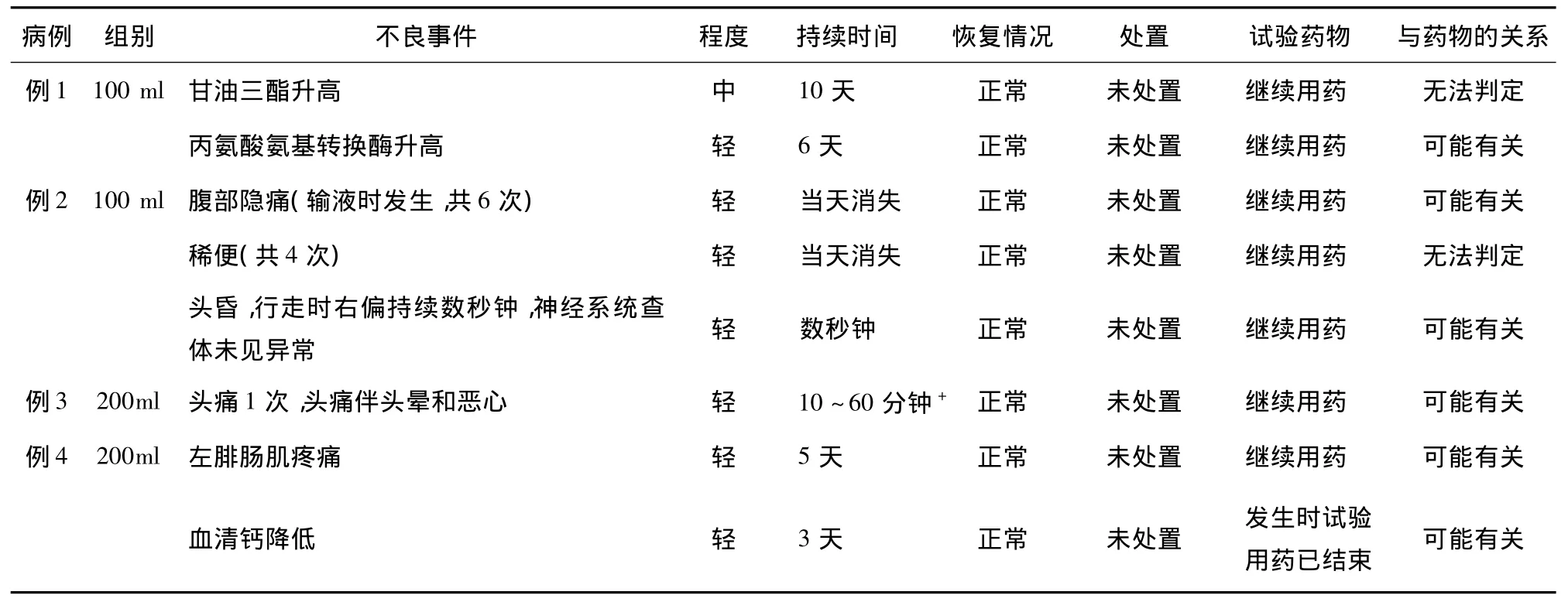
表2 连续给药不良事件
连续给药耐受性试验2个剂量组实验结果,每个剂量组各有2例出现与试验药物可能有关的轻度不良反应,均未进行任何处置,且未影响继续输入试验药物,均恢复正常。其中3例为出现症状和体征,1例为实验室指标异常,为100ml剂量组有1例甘油三酯中度升高,丙氨酸氨基转换酶轻度升高,但仍在未减量,未停用试验药物的情况下测值下降,最后复查恢复正常,与试验药物的关系无法判定或可能有关,该现象在200ml组中并未出现,故200ml可作为安全剂量。故I期耐受性临床试验连续给药安全剂量最大为200ml。
3 讨论
新药的I期耐受性临床试验是通过选择健康志愿者作为受试者,对药物的安全性和耐受性进行初步评价的人体药物试验,为制定该药的Ⅱ期临床试验给药方案提供依据。该试验药物的适应症为病毒性心肌炎,病毒性心肌炎的病机特点主要为虚实夹杂,而以虚为主[4]。莫晓飞等[5]通过对 6853 篇文献研究得出,使用频率较高的45味中药主要为补虚药,黄芪排第3位。周亚滨等[6]对该病的研究进展分析,在治疗上要从整体上提高或调整免疫功能,清除或防止病毒感染,减轻病毒对心肌的损害。单位中药首先是黄芪。黄芪具有抗病毒、调节机体免疫、抗氧化、抑制钙超载、增加心肌收缩力及恢复心功能等作用,对病毒性心肌炎有很好的预防和治疗效果[7]。古平等[8]通过对小鼠柯萨奇B3病毒性心肌炎的实验研究证明黄芪总苷对小鼠病毒性心肌炎有良好的治疗作用,且有明显的量效关。本次试验的黄芪总苷注射液是由黄芪根中提取的总皂苷与氯化钠制成的灭菌水溶液。根据临床前主要药效学试验结果得出该药具有扶正祛邪、益气养元、养心通脉的功能,临床拟用于心气虚损、气虚血瘀之病毒性心肌炎,症见胸闷、心前区隐痛、心悸、头晕、气短、乏力、脉沉弱、细涩或结代者。
根据Ⅰ期临床人体耐受性试验结果,推荐黄芪总苷注射液Ⅱ期临床试验的剂量为100~200ml/次,每天一次,静脉滴注。
本次人体耐受性试验单次和连续给药各剂量组无较重的不良反应或同一组超过半数的轻度不良反应,仅见轻微头痛、头昏、恶心,腹痛稀便,腓肠肌疼痛等症状,出现球蛋白升高、甘油三酯和丙氨酸氨基转换酶升高、白细胞减少、血清钙降低各1例,健康人体对黄芪总苷注射液耐受性较好,临床应用较安全。在黄芪总苷注射液进一步的Ⅱ期、Ⅲ期临床试验的有效性和安全性评价中,应重点关注黄芪总苷注射液可能出现的头痛、头昏、恶心、腹痛、稀便、腓肠肌疼痛等症状的观察和球蛋白、甘油三酯、丙氨酸氨基转换酶和白细胞、血清钙降的监测。
[1]国家药品监督管理局.药品注册管理办法(试行)[EB/OL].(2002-10-31)[2013-7-29].http://www.sda.gov.cn/WS01/CL0053/24478.html.
[2]国家食品药品监督管理局.药品临床试验管理规范[EB/OL].(1999-09-01)[2013-7-29].http://www.csco.org.cn/gcp/class/zhn002.html.
[3]国家药品监督管理局.中药新药临床研究的技术要求.1999-11-12.
[4]吴美芳,张军平,吕仕超.病毒性心肌炎中医病因病机研究概况[J].中国中医药信息杂志,2011,18(8):108-109.
[5]莫晓飞,韩丽华,王振涛,等.病毒性心肌炎中医用药规律文献研究[J].中医杂志,2013,54(5):424-426.
[6]周亚滨,翟文姬,陈会君,等.病毒性心肌炎的中医治疗进展[J].中医临床研究,2013,(3):121-122.
[7]赵海.浅谈黄芪抗病毒性心肌炎的作用机制[J].科技咨询,2007,(25):214.
[8]古平,何民.黄芪总苷治疗小鼠柯萨奇B3病毒性心肌炎的实验研究[J].西南国防医药,2007,17(3):281-284

